1 . 已知: ,
, 晶胞如图所示,晶胞边长为a pm,设
晶胞如图所示,晶胞边长为a pm,设 为阿伏加德罗常数的值。下列叙述错误的是
为阿伏加德罗常数的值。下列叙述错误的是
 ,
, 晶胞如图所示,晶胞边长为a pm,设
晶胞如图所示,晶胞边长为a pm,设 为阿伏加德罗常数的值。下列叙述错误的是
为阿伏加德罗常数的值。下列叙述错误的是
A.该晶胞中含有4个 |
B.离 最近的 最近的 有12个 有12个 |
C.该晶体的密度为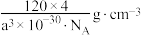 |
D.上述反应中,每生成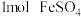 ,转移电子数为 ,转移电子数为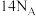 |
您最近一年使用:0次
2024-02-25更新
|
173次组卷
|
2卷引用:吉林省部分名校2023-2024学年高二下学期期中联考化学试题
名校
2 . 维生素C是一种水溶性维生素,有强还原性、水溶液显酸性。化学式为 。某小组同学测定了某新鲜水果中维生素C的含量,实验报告如下:
。某小组同学测定了某新鲜水果中维生素C的含量,实验报告如下:
【实验目的】测定某新鲜水果中维生素C的含量。
【实验原理】 ,
,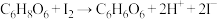 。
。
【实验用品】 标准溶液、指示剂、
标准溶液、指示剂、 溶液、
溶液、 溶液、蒸馏水等。
溶液、蒸馏水等。
【实验步骤】
(1)配制待测溶液:称取新鲜水果样品 ,加入适量蒸馏水进行粉碎、过滤,并将滤液转移至
,加入适量蒸馏水进行粉碎、过滤,并将滤液转移至 容量瓶中,定容,随后将待测溶液加到滴定管中。根据维生素C的性质,待测溶液应用
容量瓶中,定容,随后将待测溶液加到滴定管中。根据维生素C的性质,待测溶液应用___________ (填“酸式”或“碱式”)滴定管盛装。
(2)氧化还原滴定法:取(1)中配制好的待测溶液 于锥形瓶中,调节
于锥形瓶中,调节 至3,加入适量指示剂后,小心地滴入
至3,加入适量指示剂后,小心地滴入 标准溶液,直至滴定终点,记录相关数据。平行测定三次,计算新鲜水果中维生素
标准溶液,直至滴定终点,记录相关数据。平行测定三次,计算新鲜水果中维生素 的质量分数。
的质量分数。
①上述氧化还原滴定法应用___________ 作指示剂,滴定终点的现象为___________ 。
②除了样品的质量、待测溶液的体积外,计算新鲜水果中维生素C的质量分数还需要的数据有___________ 。
(3)库仑滴定法:取(1)中配制好的待测溶液 ,用库仑仪测定其中维生素C的含量。平行测定三次,计算新鲜水果中维生素C的质量分数。
,用库仑仪测定其中维生素C的含量。平行测定三次,计算新鲜水果中维生素C的质量分数。
已知:库仑仪中电解原理示意图如下。检测前,电解质溶液中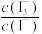 保持定值时,电解池不工作。将待测溶液加入电解池后,维生素C将
保持定值时,电解池不工作。将待测溶液加入电解池后,维生素C将 还原,库仑仪便立即自动进行电解到
还原,库仑仪便立即自动进行电解到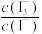 又回到原定值,测定结束,通过测定电解消托的电量可以求得维生素C的含量。
又回到原定值,测定结束,通过测定电解消托的电量可以求得维生素C的含量。

①库仑仪工作时电解池的阳极反应式为___________ 。
②若电解消耗的电量为Q库仑,维生素C的摩尔质量为 ,则新鲜水果中维生素C的质量分数为
,则新鲜水果中维生素C的质量分数为___________ 。(用含 的代数式表示)已知:电解中转移
的代数式表示)已知:电解中转移 电子所消耗的电量为96500库仑。
电子所消耗的电量为96500库仑。
③测定过程中,需控制电解质溶液 ,当
,当 时,部分
时,部分 易被空气中的
易被空气中的 直接氧化为
直接氧化为 ,该过程的离子方程式为
,该过程的离子方程式为___________ 。这部分非电解生成的 ;将导致测得的维生素C的含量
;将导致测得的维生素C的含量___________ 。(填“偏大”或“偏小”)。
 。某小组同学测定了某新鲜水果中维生素C的含量,实验报告如下:
。某小组同学测定了某新鲜水果中维生素C的含量,实验报告如下:【实验目的】测定某新鲜水果中维生素C的含量。
【实验原理】
 ,
,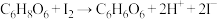 。
。【实验用品】
 标准溶液、指示剂、
标准溶液、指示剂、 溶液、
溶液、 溶液、蒸馏水等。
溶液、蒸馏水等。【实验步骤】
(1)配制待测溶液:称取新鲜水果样品
 ,加入适量蒸馏水进行粉碎、过滤,并将滤液转移至
,加入适量蒸馏水进行粉碎、过滤,并将滤液转移至 容量瓶中,定容,随后将待测溶液加到滴定管中。根据维生素C的性质,待测溶液应用
容量瓶中,定容,随后将待测溶液加到滴定管中。根据维生素C的性质,待测溶液应用(2)氧化还原滴定法:取(1)中配制好的待测溶液
 于锥形瓶中,调节
于锥形瓶中,调节 至3,加入适量指示剂后,小心地滴入
至3,加入适量指示剂后,小心地滴入 标准溶液,直至滴定终点,记录相关数据。平行测定三次,计算新鲜水果中维生素
标准溶液,直至滴定终点,记录相关数据。平行测定三次,计算新鲜水果中维生素 的质量分数。
的质量分数。①上述氧化还原滴定法应用
②除了样品的质量、待测溶液的体积外,计算新鲜水果中维生素C的质量分数还需要的数据有
(3)库仑滴定法:取(1)中配制好的待测溶液
 ,用库仑仪测定其中维生素C的含量。平行测定三次,计算新鲜水果中维生素C的质量分数。
,用库仑仪测定其中维生素C的含量。平行测定三次,计算新鲜水果中维生素C的质量分数。已知:库仑仪中电解原理示意图如下。检测前,电解质溶液中
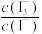 保持定值时,电解池不工作。将待测溶液加入电解池后,维生素C将
保持定值时,电解池不工作。将待测溶液加入电解池后,维生素C将 还原,库仑仪便立即自动进行电解到
还原,库仑仪便立即自动进行电解到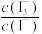 又回到原定值,测定结束,通过测定电解消托的电量可以求得维生素C的含量。
又回到原定值,测定结束,通过测定电解消托的电量可以求得维生素C的含量。
①库仑仪工作时电解池的阳极反应式为
②若电解消耗的电量为Q库仑,维生素C的摩尔质量为
 ,则新鲜水果中维生素C的质量分数为
,则新鲜水果中维生素C的质量分数为 的代数式表示)已知:电解中转移
的代数式表示)已知:电解中转移 电子所消耗的电量为96500库仑。
电子所消耗的电量为96500库仑。③测定过程中,需控制电解质溶液
 ,当
,当 时,部分
时,部分 易被空气中的
易被空气中的 直接氧化为
直接氧化为 ,该过程的离子方程式为
,该过程的离子方程式为 ;将导致测得的维生素C的含量
;将导致测得的维生素C的含量
您最近一年使用:0次
2023-12-11更新
|
105次组卷
|
3卷引用:吉林省梅河口市第五中学2023-2024学年高二下学期开学化学试题
名校
3 . 富氧条件下,一种利用氨通过铜交换沸石催化还原氮氧化物的原理如图,下列说法正确的是
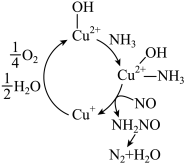

A. 是该反应的催化剂,能提高总反应的平衡转化率 是该反应的催化剂,能提高总反应的平衡转化率 |
B.总反应方程式为 |
| C.该过程属于人工固氮 |
D.每转移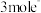 ,生成 ,生成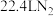 |
您最近一年使用:0次
2023-11-04更新
|
114次组卷
|
3卷引用:吉林省松原市前郭县第五高级中学2023~2024学年高二上学期期中考试化学试题
名校
4 . 设 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是A.将 通入足量水中所得溶液含有的 通入足量水中所得溶液含有的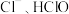 和 和 的总数为 的总数为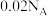 |
B. 与 与 反应生成 反应生成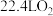 转移电子数为 转移电子数为 |
C.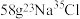 中含有的中子数目为 中含有的中子数目为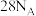 |
D.由 与 与 反应制得 反应制得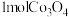 时转移的电子数目为 时转移的电子数目为 |
您最近一年使用:0次
2023-07-18更新
|
76次组卷
|
3卷引用:吉林省通化市梅河口市第五中学2022-2023学年高二下学期7月期末考试化学试题
名校
解题方法
5 . 我国科学家研制的高效固体催化剂LDH,实现了在常温常压、可见光条件下“人工固氮”,其原理如图所示。下列有关说法不正确的是
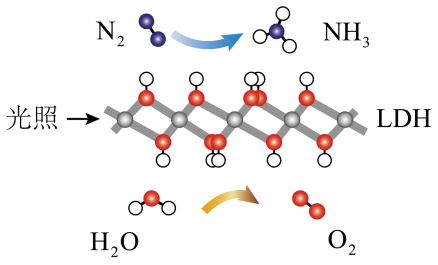

| A.使用LDH,可降低反应的焓变 | B.反应过程中存在共价键的断裂与形成 |
| C.反应过程中存在太阳能转化为化学能 | D.反应生成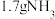 时,电子转移了 时,电子转移了 |
您最近一年使用:0次
2023-06-25更新
|
149次组卷
|
2卷引用:吉林省长春外国语学校2023-2024学年高二下学期开学化学试题
6 . 某工厂采用如下工艺处理镍钴矿硫酸浸取液(含 和
和 )。实现镍、钴、镁元素的回收。
)。实现镍、钴、镁元素的回收。
回答下列问题:
(1)用硫酸浸取镍钴矿时,提高浸取速率的方法为_______ (答出一条即可)。
(2)“氧化”中,混合气在金属离子的催化作用下产生具有强氧化性的过一硫酸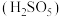 ,
, 中过氧键的数目为
中过氧键的数目为_______ 。
(3)“氧化”中,用石灰乳调节 ,
, 被
被 氧化为
氧化为 ,该反应的离子方程式为
,该反应的离子方程式为_______ ( 的电离第一步完全,第二步微弱);滤渣的成分为
的电离第一步完全,第二步微弱);滤渣的成分为 、
、_______ (填化学式)。
(4)“氧化”中保持空气通入速率不变, (Ⅱ)氧化率与时间的关系如下。
(Ⅱ)氧化率与时间的关系如下。 体积分数为
体积分数为_______ 时, (Ⅱ)氧化速率最大;继续增大
(Ⅱ)氧化速率最大;继续增大 体积分数时,
体积分数时, (Ⅱ)氧化速率减小的原因是
(Ⅱ)氧化速率减小的原因是_______ 。
 (Ⅱ)在空气中可被氧化成
(Ⅱ)在空气中可被氧化成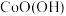 ,该反应的化学方程式为
,该反应的化学方程式为_______ 。
(6)“沉镁”中为使 沉淀完全
沉淀完全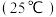 ,需控制
,需控制 不低于
不低于_______ (精确至0.1)。
 和
和 )。实现镍、钴、镁元素的回收。
)。实现镍、钴、镁元素的回收。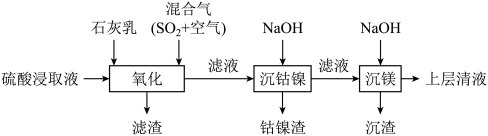
| 物质 |  |  |  |  |
 |  |  |  | 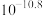 |
(1)用硫酸浸取镍钴矿时,提高浸取速率的方法为
(2)“氧化”中,混合气在金属离子的催化作用下产生具有强氧化性的过一硫酸
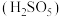 ,
, 中过氧键的数目为
中过氧键的数目为(3)“氧化”中,用石灰乳调节
 ,
, 被
被 氧化为
氧化为 ,该反应的离子方程式为
,该反应的离子方程式为 的电离第一步完全,第二步微弱);滤渣的成分为
的电离第一步完全,第二步微弱);滤渣的成分为 、
、(4)“氧化”中保持空气通入速率不变,
 (Ⅱ)氧化率与时间的关系如下。
(Ⅱ)氧化率与时间的关系如下。 体积分数为
体积分数为 (Ⅱ)氧化速率最大;继续增大
(Ⅱ)氧化速率最大;继续增大 体积分数时,
体积分数时, (Ⅱ)氧化速率减小的原因是
(Ⅱ)氧化速率减小的原因是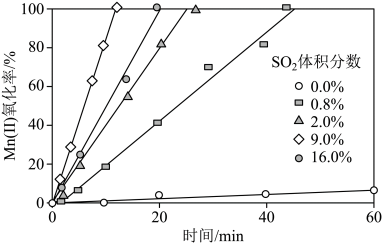
 (Ⅱ)在空气中可被氧化成
(Ⅱ)在空气中可被氧化成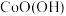 ,该反应的化学方程式为
,该反应的化学方程式为(6)“沉镁”中为使
 沉淀完全
沉淀完全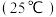 ,需控制
,需控制 不低于
不低于
您最近一年使用:0次
2023-06-13更新
|
11783次组卷
|
19卷引用:吉林省通化市梅河口市第五中学2023-2024学年高二上学期1月期末化学试题
吉林省通化市梅河口市第五中学2023-2024学年高二上学期1月期末化学试题(已下线)第19练 化学工艺流程题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)辽宁省葫芦岛市第一高级中学2023-2024学年高二上学期化学期末复习提升卷福建泉州科技中学2022-2023学年高二下学期期末考化学试题2023年高考辽宁卷化学真题(已下线)T16-工业流程题(已下线)2023年高考化学真题完全解读(辽宁卷)(已下线)专题18 工艺流程题(已下线)2023年高考山东卷化学真题变式题(工业流程题)(已下线)专题18 工艺流程题(已下线)专题18 工艺流程题(已下线)专题13 工艺流程综合题-2023年高考化学真题题源解密(新高考专用)(已下线)专题13 工艺流程综合题-2023年高考化学真题题源解密(全国通用)江苏省华罗庚中学2023-2024学年高三夏令营学习能力测试化学试题山西省三重教育联盟2023-2024学年高三上学期9月联考化学试题四川省成都市第七中学2023-2024学年高三上学期入学考试理综化学试题(已下线)考点47 无机工艺流程(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)江苏省镇江市丹阳市吕叔湘中学2023-2024学年高三上学期10月月考化学试题甘肃省白银市会宁县第四中学2023-2024学年高三上学期第三次月考化学试题
名校
解题方法
7 . 将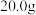 铜镁合金完全溶解于某浓度的硝酸中,得到
铜镁合金完全溶解于某浓度的硝酸中,得到 和
和 的混合气体
的混合气体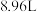 (标准状况),当向反应后的溶液中加入一定浓度
(标准状况),当向反应后的溶液中加入一定浓度 溶液时,金属离子全部转化为沉淀,测得沉淀的质量为
溶液时,金属离子全部转化为沉淀,测得沉淀的质量为 。
。 和
和 的混合气体中,
的混合气体中, 的体积分数是
的体积分数是
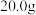 铜镁合金完全溶解于某浓度的硝酸中,得到
铜镁合金完全溶解于某浓度的硝酸中,得到 和
和 的混合气体
的混合气体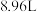 (标准状况),当向反应后的溶液中加入一定浓度
(标准状况),当向反应后的溶液中加入一定浓度 溶液时,金属离子全部转化为沉淀,测得沉淀的质量为
溶液时,金属离子全部转化为沉淀,测得沉淀的质量为 。
。 和
和 的混合气体中,
的混合气体中, 的体积分数是
的体积分数是A. | B. | C. | D. |
您最近一年使用:0次
2023-04-30更新
|
662次组卷
|
7卷引用:吉林省长春外国语学校2023-2024学年高二上学期开学考试化学试题
名校
解题方法
8 . 科学研究人员最近发现了一种“水”电池,在海水中电池总反应可表示为5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,下列有关说法正确的是
| A.正极反应式:Ag - e- + Cl- = AgCl |
| B.AgCl是还原产物 |
| C.生成1 mol Na2Mn5O10转移2 mol电子 |
| D.Na+不断向“水”电池的负极移动 |
您最近一年使用:0次
2023-04-26更新
|
132次组卷
|
94卷引用:吉林省前郭尔罗斯蒙古族自治县蒙古族中学2020-2021学年高二上学期期末考试化学试题
吉林省前郭尔罗斯蒙古族自治县蒙古族中学2020-2021学年高二上学期期末考试化学试题(已下线)2011-2012学年江西省白鹭洲中学高二上学期期中考试化学(理)试卷(已下线)2011-2012学年福建师大附中高二上学期期末考试化学试卷(已下线)2011-2012学年浙江省温州中学高二下学期期中考试化学试卷(已下线)2011-2012学年浙江东阳中学、兰溪一中高二下学期期中考试化学卷(已下线)2013-2014云南省玉溪一中高二下学期第二次月考化学试卷(已下线)2013-2014湖北省荆州中学高二上学期期末考试化学试卷2014-2015重庆市重庆一中高二上学期期中化学(理)试卷2014-2015山东省临沭二中高二1月月考化学试卷2014-2015山西省原平市一中高二上学期期末考试化学试卷2016-2017学年内蒙古鄂尔多斯一中高二上期中化学卷2016-2017学年湖南省娄底市双峰一中等五校高二上期中化学卷浙江省名校协作体2016-2017学年高二下学期考试化学试题河北省鸡泽县第一中学2017-2018学年高二上学期第一次月考化学试题陕西省西安市长安区第一中学2017-2018学年高二上学期第二次月考化学试题北京师范大学附属中学2017-2018学年高二上学期期末考试化学试题【全国校级联考】浙江省宁波市六校2017-2018学年高二下学期期末联考化学试题安徽省宣城市郎溪县郎溪中学2018-2019学年高二上学期返校考化学试题福建省莆田市第八中学2018-2019学年高二(理)上学期期中考试化学试题【校级联考】江西省赣州市南康中学、于都中学2018-2019学年高二上学期第三次月考化学试题【全国百强校】黑龙江省牡丹江市第一高级中学2018-2019学年高二上学期期末考试化学试题湖南省邵东县第一中学、娄底三中2019-2020学年高二上学期第一次月考化学试题湖南省长沙市长沙县第九中学2018-2019学年高二下学期期末考试化学试题云南省武定民族中学2019-2020学年高二上学期期末考试化学试题吉林省白城市洮南市第一中学2019-2020学年高一下学期第三次月考化学试题吉林省长春外国语学校2019-2020学年高一下学期期末考试化学(理)试题辽宁省六校协作体2020-2021学年高二上学期期初考试化学试题(已下线)第01章 化学反应与能量转化(B卷能力提升篇)-2020-2021学年高二化学选择性必修1同步单元AB卷(新教材鲁科版)山东省滕州市第一中2020-2021学年高二上学期10月月考化学试题广东省珠海市第二中学2019-2020学年高二上学期期中考试化学试题鲁科版(2019)高二选择性必修第一册第1章 化学反应与能量变化 第2节 化学能转化为电能——电池 课时2 化学电源福建省莆田第十五中学2018-2019学年高二上学期期中考试化学试题山西省运城市临猗县临晋中学2020-2021学年高二上学期12月月考化学试题福建省莆田第十五中学2019-2020学年高二上学期期中考试化学试题江西省吉安市吉安县第三中学、安福二中2021-2022学年高二入学考试化学试题安徽省淮北市第一中学 2021-2022学年高二上学期第一次月考化学试题北京市石景山区第九中学2021-2022学年高二上学期期中考试化学试题山东省实验中学2022-2023学年高二上学期10月月考化学试题山东省威海大光华学校2023-2024学年高二11月月考化学试题(已下线)2012届四川省成都外国语学校高三上学期8月月考化学试卷(已下线)2012届山东省枣庄十八中高三10月份质量检测化学试卷(已下线)2014高考名师推荐化学原电池的工作原理、电极反应式的书写2014-2015江西省白鹭洲中学高一下学期期中考试化学试卷2014-2015学年山西省孝义市高一下学期升级考试化学试卷2016届河北省唐山市迁安二中高三上学期期末化学试卷2015-2016学年北大附中河南分校高一下3月月考化学试卷2015-2016学年浙江省绍兴一中高一下期中化学试卷2015-2016学年河北省石家庄市辛集中学高一下期中理科化学试卷2015-2016学年中国石油天然气管道局中学高一下第二次月考化学试卷2015-2016学年甘肃省天水一中高一下期末理科化学试卷2015-2016学年山东省烟台市招远二中高一下3月月考化学试卷2017届四川省广元市苍溪县高三零诊理综化学试卷2017届四川省双流中学高三12月月考化学卷2016-2017学年湖北省重点高中联考协作体高一下学期期中考试化学试卷河北省定州中学2017届高三下学期第二次月考(4月)化学试题2【全国百强校】河北省定州中学2017届高三下学期第二次月考(4月)化学试题天津市南开区2017届高三高考二模化学试卷山西省怀仁县第一中学2016-2017学年高一下学期第三次(5月)月考化学试题江西省南昌市八一中学、洪都中学、麻丘中学等六校2016-2017学年高一5月联考化学试题湖北省沙市中学、恩施高中、郧阳中学2016-2017学年高一下学期阶段性联考化学试题甘肃省天水市第一中学2016-2017学年高一下学期第二次月考(B卷)化学试题湖南省衡阳市第八中学2016-2017学年高一下学期五科联赛(6月)理综化学试题浙江省金华市东阳中学2016-2017学年高一6月月考化学试题浙江省东阳中学2016-2017学年高一5月月考化学试题浙江省2018版考前特训(2017年10月)学考70快练:原电池福建省晋江市季延中学2018届高三上学期第二阶段检测化学试题【全国百强校】北京师范大学附属中学2017-2018学年高一下学期期中考试化学试题(已下线)考点09 原电池原理及其应用——备战2019年浙江新高考化学考点【全国百强校】湖南省衡阳市衡阳县第一中学2018-2019学年高一下学期第一次月考化学试题【全国百强校】广西壮族自治区桂林市第十八中学2018-2019学年高一下学期期中段考化学试题【全国百强校】江西省新余市第一中学2018-2019学年高一下学期第二次(5月)段考化学试题【校级联考】浙江省台州市联谊五校2018-2019学年高一下学期期中考试化学试题黑龙江省大庆十中2018-2019学年高一下学期第二次月考化学试题甘肃省玉门一中2018-2019学年高一下学期期末考试化学试题福建省福州市长乐高级中学2020届高三上学期第一次月考化学试题山东省济宁市鱼台县第一中学2020届高三10月月考化学试题(已下线)【新东方】高中化学5029浙江省宁波诺丁汉大学附属中学2018-2019学年高一下学期期中考试(实验班)化学试题2020春(新教材)人教化学第二册第6章 化学反应与能量练习课时2 发展中的化学电源——A学习区 夯实基础(人教版必修2)课时3 化学电源——A学习区 夯实基础(鲁科版(2019)第二册)安徽省滁州市明光市明光中学2019-2020高一下学期第二次月考化学试题安徽省淮北市第一中学2019-2020学年高一下学期期中考试化学试题河北省衡水市桃城区第十四中学2019-2020学年高一下学期第四次综合测试化学试题河南省鹤壁市外国语中学2019-2020学年高一下学期段考化学试题(已下线)专题讲座(六)新型电源及电极反应式的书写(精练)-2021年高考化学一轮复习讲练测黑龙江宾县第一中学2021届高三上学期第二次月考化学试题云南省玉溪市2020-2021学年高一下学期期末教学质量检测化学试题浙江省磐安县第二中学2019-2020学年高一下学期返校考试化学试题河北省定州中学2017届高三下学期第二次月考(4月)化学试题1(已下线)第06讲 化学电源-【寒假自学课】2022年高一化学寒假精品课(苏教版必修第二册)北京市第一七一中学2021-2022学年高一下学期期中考试化学试题北京市汇文中学2021-2022学年高一下学期期中考试化学试题北京市丰台区2022-2023学年高一下学期期中练习化学试题
名校
解题方法
9 . 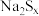 在碱性溶液中可被
在碱性溶液中可被 氧化为
氧化为 ,而
,而 被还原为
被还原为 ,若反应中
,若反应中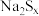 ,与
,与 的物质的量之比为
的物质的量之比为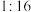 ,则x的值为
,则x的值为
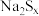 在碱性溶液中可被
在碱性溶液中可被 氧化为
氧化为 ,而
,而 被还原为
被还原为 ,若反应中
,若反应中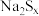 ,与
,与 的物质的量之比为
的物质的量之比为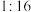 ,则x的值为
,则x的值为| A.2 | B.3 | C.4 | D.5 |
您最近一年使用:0次
2023-02-08更新
|
629次组卷
|
36卷引用:吉林省松原市乾安七中2020-2021学年高二下学期第七次质量检测化学试题
吉林省松原市乾安七中2020-2021学年高二下学期第七次质量检测化学试题吉林省吉林市第一中学2021-2022学年高二6月月考(平行班)化学试题(已下线)湖南省衡阳市第八中学2010届高三年级第五次月考化学试题(已下线)2012届高三上学期一轮复习化学单元验收试卷(4)(新人教版)(已下线)2012届黑龙江省大庆实验中学高三上学期期中考试化学试卷(已下线)2011-2012学年湖南衡阳一、八中高一下学期期中联考化学试卷(已下线)2013届河北省邯郸一中高三9月月考化学化学试卷(已下线)2014届浙江省湖州市八校高三上学期第二次联考化学试卷福建省德化一中、永安一中、漳平一中2018届高三上学期三校联考化学试题黑龙江省齐齐哈尔市实验中学2017-2018学年高一上学期期中考试化学试题安徽省六安市霍邱县第二中学2019-2020学年高一上学期段考化学试题辽宁省辽河油田第二高级中学2020届高三12月考试化学试题2019年秋高三化学复习强化练习—— 氧化还原反应(强化练)2020届高三化学二轮复习 氧化还原反应过关检测(强化训练)湖南省岳阳市岳阳楼区岳阳楼市第一中学2020届高三考前模拟理科综合化学试题(已下线)【南昌新东方】2019 南昌五中 高一上期中辽宁省丹东市2020届高三总复习阶段测试化学试题黑龙江省哈尔滨市三中2020届高三第二次月考化学试题辽宁省东北育才学校科学高中部2020-2021学年高一上学期第一学段检测化学试题河南省周口市中英文学校2020-2021学年高三上学期第一次月考化学试题甘肃省张掖市第二中学2020-2021学年高一上学期期中考试化学试题山西省临汾市县底中学校2020-2021学年高三上学期开学考试化学试题山东省济南市历城第一中学2021届高三上学期10月月考化学试题(已下线)专题05 氧化还原反应 (热点讲义)-2022届高考化学一轮复习热点题型归纳与变式训练山西省运城市稷山中学2022届高三上学期月考(一)化学试题河北省沧州市第一中学2020-2021学年高一下学期开学测试化学试题陕西省韩城市西庄中学2021-2022学年高三上学期9月月考化学试题江苏省常州市第一中学2021-2022学年高一上学期期中考试化学试题四川省成都市树德中学2021-2022学年高一上学期11月阶段性测试(期中)化学试题重庆市南开中学校2021-2022学年高一上学期阶段性测试化学试题重庆市璧山中学校2021-2022学年高一上学期期中考试化学试题陕西省宝鸡市千阳县千阳中学2020-2021学年高一上学期期中考试化学试题湖北省武汉中学2022-2023学年高一上学期期中阶段性考试化学试题第一章 化学物质及其变化 第5讲 氧化还原反应的计算与方程式的配平(已下线)题型18 氧化还原反应规律的应用(已下线)专题05 氧化还原反应方程式的配平与计算(一题多问)
名校
10 . 电石渣[主要成分为Ca(OH)2]是氯碱工业中的废料,某同学在实验室以电石渣为原料制取KClO3的工艺流程如图所示:
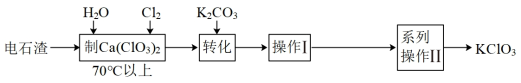
已知:Ca(ClO3)2易溶于水。
下叙述述中正确的是

已知:Ca(ClO3)2易溶于水。
下叙述述中正确的是
| A.上述流程中所用Cl2是用MnO2与浓盐酸反应制得,体现了盐酸的酸性和氧化性 |
B.工业生产电石(CaC2)的反应为CaO+3C CaC2+CO↑,该反应中氧化剂与还原剂的物质的量之比为1∶2 CaC2+CO↑,该反应中氧化剂与还原剂的物质的量之比为1∶2 |
C.“转化”发生反应的离子方程式为Ca2++ClO +K++CO +K++CO =CaCO3↓+KClO3 =CaCO3↓+KClO3 |
| D.操作I为过滤 |
您最近一年使用:0次
2022-11-11更新
|
429次组卷
|
4卷引用:吉林省长春外国语学校2022-2023学年高二下学期7月期末考试化学试题
吉林省长春外国语学校2022-2023学年高二下学期7月期末考试化学试题浙江省七彩阳光联盟2022-2023学年高一上学期期中联考化学试题(已下线)专题14 工艺流程选择题-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)【2022】【高一上】【期中考】【七彩阳光】【高中化学】【宋永洁收集】



