1 . 建筑工地常用的NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒。已知NaNO2能发生如下反应:NaNO2+HI→NO↑+I2+NaI+H2O
(1)配平上述化学方程式____
(2)上述反应的氧化剂是____ ;若有1mol的还原剂被氧化,则反应中转移电子的数目是____ 。
(3)根据上述反应,可用试纸和生活中常见的物质进行实验,以鉴别NaNO2和NaCl,可选用的物质有:①水、②淀粉碘化钾试纸、③淀粉、④白酒、⑤食醋,选取上述物质进行实验,下列组合合适的是_______ (填字母)。
A.③⑤ B.②④ C.②⑤ D.①②③⑤
(4)某厂废液中,含有2%~5%的NaNO2,直接排放会造成污染,使用NH4Cl处理,能使NaNO2转化为不引起二次污染的N2,反应的化学方程式为_____ 。
(5)请配平以下化学方程式:Al+NaNO3+NaOH=NaAlO2+N2↑+______,_____ ;若反应过程中转移5mole-则生成标准状况下N2的体积为____ L。
(1)配平上述化学方程式
(2)上述反应的氧化剂是
(3)根据上述反应,可用试纸和生活中常见的物质进行实验,以鉴别NaNO2和NaCl,可选用的物质有:①水、②淀粉碘化钾试纸、③淀粉、④白酒、⑤食醋,选取上述物质进行实验,下列组合合适的是
A.③⑤ B.②④ C.②⑤ D.①②③⑤
(4)某厂废液中,含有2%~5%的NaNO2,直接排放会造成污染,使用NH4Cl处理,能使NaNO2转化为不引起二次污染的N2,反应的化学方程式为
(5)请配平以下化学方程式:Al+NaNO3+NaOH=NaAlO2+N2↑+______,
您最近一年使用:0次
20-21高三下·山东·阶段练习
名校
2 . 已知有如下反应:①K2Cr2O7+14HCl(浓)=2KCl+2CrCl3+3Cl2↑+7H2O②Cr+2HCl(稀)=CrCl2+H2↑;③2KMnO4+16HCl(稀)=2KCl+2MnCl2+5Cl2↑+8H2O,下列说法错误的是
| A.氧化性:KMnO4>K2Cr2O7>Cl2 |
| B.反应③中氧化剂与还原剂的物质的量之比为1:5 |
C.向Cr2(SO4)3溶液中滴入酸性KMnO4溶液,可发生反应:10Cr3++6 +11H2O=5 +11H2O=5 +6Mn2++22H+ +6Mn2++22H+ |
| D.向金属Cr中滴入浓硝酸无明显变化,说明两者不能发生反应 |
您最近一年使用:0次
2021-05-28更新
|
773次组卷
|
11卷引用:吉林省长春希望高中2020-2021学年高二下学期期末考试化学试题
吉林省长春希望高中2020-2021学年高二下学期期末考试化学试题山东省莱州市第一中学2022-2023学年高二下学期6月月考化学试题(已下线)学科网2021年高三3月大联考(山东卷)河北省武邑中学2021届高三二模化学试题(已下线)专题05 氧化还原反应(限时精练)-2022届高考化学一轮复习热点题型归纳与变式训练 (已下线)课时10 氧化还原反应规律及应用-2022年高考化学一轮复习小题多维练(全国通用)(已下线)考点05 氧化还原反应-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)第5讲 氧化还原反应(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)福建省八县(市)一中2022-2023学年高三上学期11月期中联考化学试题福建省宁德福鼎市第一中学2024届高三上学期第一次考试化学试题福建省福州高新区第一中学(闽侯县第三中学)2023-20024学年高三上学期第一次月考化学试题
名校
解题方法
3 . 下列关于氧化还原反应的说法正确的是
| A.氧化还原反应中,发生氧化还原的一定是不同种元素 |
| B.氧化剂和还原剂一定是不同种物质 |
| C.还原剂失去电子总数一定等于氧化剂得到电子总数 |
D.某氧化还原反应中,还原剂共失去 ,氧化剂共得到 ,氧化剂共得到 ,所以该反应转移的电子总数为 ,所以该反应转移的电子总数为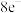 |
您最近一年使用:0次
2021·山东·模拟预测
4 . 实验室探究制备高锰酸钾的绿色化方案,其实验流程如图:

已知:在酸性、中性或弱碱性环境下, 会发生自身氧化还原(歧化)反应生成
会发生自身氧化还原(歧化)反应生成 和MnO2。
和MnO2。
下列说法正确的是

已知:在酸性、中性或弱碱性环境下,
 会发生自身氧化还原(歧化)反应生成
会发生自身氧化还原(歧化)反应生成 和MnO2。
和MnO2。下列说法正确的是
A.“共熔”时发生反应的化学方程式为3MnO2+6KOH+KClO3 3K2MnO4+KCl+3H2O 3K2MnO4+KCl+3H2O |
| B.“歧化”步骤所得的氧化产物与还原产物的物质的量之比为1∶2 |
| C.“歧化”过程中加入CH3COOH的目的是调节溶液的pH,故也可以用盐酸代替 |
| D.将滤液直接加热蒸干得到KMnO4晶体 |
您最近一年使用:0次
名校
5 . 二氧化硫制取三氧化硫的反应为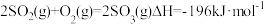 ,下列有关用二氧化硫制取三氧化硫的说法正确的是
,下列有关用二氧化硫制取三氧化硫的说法正确的是
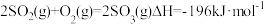 ,下列有关用二氧化硫制取三氧化硫的说法正确的是
,下列有关用二氧化硫制取三氧化硫的说法正确的是A.反应的 |
B.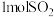 与足量 与足量 反应,放出的热量为 反应,放出的热量为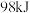 |
C.工业上用通入足量的空气来提高 的转化率 的转化率 |
D.反应中每消耗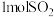 转移的电子数目约等于 转移的电子数目约等于 |
您最近一年使用:0次
2021-05-07更新
|
280次组卷
|
5卷引用:吉林省长春外国语学校2021-2022学年高二上学期期中考试化学试题
6 . 足量的铜与一定量的浓硝酸充分反应,得到4.48L(标准状况)NO2与NO的混合气体,这些气体与一定体积的O2混合后通入水中,恰好被完全吸收生成硝酸。向所得硝酸铜溶液中加入100mL4mol·L-1NaOH溶液,Cu2+恰好沉淀完全。下列说法正确的是
| A.此反应过程中转移了0.5mol的电子 | B.消耗氧气的体积为1.12L(标准状况) |
| C.参加反应的HNO3是0.4mol | D.混合气体中含2.24L(标准状况)NO |
您最近一年使用:0次
2021-04-26更新
|
1150次组卷
|
8卷引用:吉林省延边第二中学2020-2021学年高二下学期第二次考试月考化学试题
10-11高一上·宁夏银川·期中
名校
解题方法
7 . 新型陶瓷AlN可通过反应: 合成。下列叙述正确的是
合成。下列叙述正确的是
 合成。下列叙述正确的是
合成。下列叙述正确的是| A.上述反应中,N2是还原剂,Al2O3是氧化剂 |
| B.AlN中氮元素的化合价为+3 |
| C.上述反应中,每生成1molAlN需转移3mol电子 |
| D.AlN的摩尔质量为41g |
您最近一年使用:0次
2021-04-12更新
|
521次组卷
|
61卷引用:吉林省松原市乾安七中2020-2021学年高二下学期第七次质量检测化学试题
吉林省松原市乾安七中2020-2021学年高二下学期第七次质量检测化学试题(已下线)2012年人教版高中化学选修1 3.3玻璃、陶瓷和水泥练习卷(已下线)2013-2014学年上海市吴淞中学高二上学期期中考试化学试卷吉林省吉林地区普通高中友好学校联合体第三十一届2019-2020学年高一上学期期中考试化学试题吉林省公主岭市范家屯镇第一中学2019-2020学年高一上学期第二次月考化学试题内蒙古包头市包钢第四中学2018-2019学年高二下学期期末考试化学试题吉林省吉林市第二中学2022届高三上学期9月月考化学试题浙江省湖州市长兴县等三县2017-2018学年高二上学期期中考试化学试题(已下线)2010年宁夏银川一中高一上学期期中考试化学卷(已下线)2010年重庆市万州二中高一12月月考化学试卷(已下线)2010—2011年福建省厦门市杏南中学高一12月月考化学卷(已下线)2012届河北省定州二中高三第一次月考化学试卷(已下线)2011-2012学年浙江省余姚中学高一上学期期中化学(理)试卷(化学实验班)(已下线)2011-2012学年浙江省瑞安中学高一上学期期中考试化学试卷(已下线)2011-2012年江西赣州市十一县(市)高一下学期期中联考化学试卷(已下线)2012-2013学年浙江省舟山二中等三校高一上学期期末联考化学试卷(已下线)2015届北京市东城区普通校高三11月联考化学试卷2014-2015浙江省严州中学高一1月月考化学试卷2017届山东省实验中学高三第一次诊断性考试化学试卷2017届山西大学附中高三上10月模块诊断化学试卷2016-2017学年安徽省亳州市涡阳县第一中学高一3月月考化学试卷江西省上饶市上饶中学2019届高三上学期开学(实验、重点、特长班)检测化学试题【全国百强校】陕西省西安市第一中学2019届高三上学期第一次月考化学试题云南省丘北县第二中学2018-2019学年高一上学期10月月考化学试题新疆自治区北京大学附属中学新疆分校2019届高三上学期10月月考化学试题辽宁省大连市第103中学2017-2018学年高一上学期期中考试化学试题【校级联考】湖南省醴陵二中、醴陵四中2018-2019学年高一上学期期中联考化学试题新疆维吾尔自治区石河子第二中学2018-2019学年高一上学期第二次月考化学试题广东省揭阳市惠来县第一中学2018-2019学年高一上学期期中考试化学试题贵州省毕节市纳雍县第一中学2018-2019学年高一下学期期末考试化学试题鲁科版(2019)新教材化学同步2.3.2 氧化还原反应的应用 练习天津市耀华中学2019-2020学年高一上学期期中考试化学试题福建省莆田市第十一中学2019-2020学年高三上学期期中考试化学试题宁夏石嘴山市第三中学2019-2020学年高一上学期第二次(12月)月考化学试题甘肃省张掖市第二中学2019-2020学年高一上学期期中考试化学试题云南省普洱市景东彝族自治县第一中学2019-2020学年高一上学期12月月考化学试题新疆维吾尔自治区乌鲁木齐市第130中学2018-2019学年高一上学期期中考试化学试题鲁教版高中化学必修1第二章《元素与物质世界》测试卷3广西龙州县高级中学2019-2020学年高一上学期期末考试化学试题(已下线)上海建平中学2013年2月高三开学模拟考试化学试题陕西省宝鸡市金台区2019-2020学年高一上学期期中检测化学试题(已下线)衔接点08 氧化还原反应的一般规律-2020年【衔接教材·暑假作业】初高中衔接化学(已下线)2.3.2 氧化还原反应的应用 练习(1)——《高中新教材同步备课》(鲁科版 必修第一册)陕西省黄陵县中学2020-2021学年高一上学期期中考试化学试题(高新部)四川省冕宁中学2020-2021学年高一上学期期中考试化学试题福建省南平市高级中学2020-2021学年高一上学期期中考试化学试题(已下线)【浙江新东方】90河北省石家庄外国语学校2020-2021学年高一上学期第二阶段考试化学试卷浙江省嘉兴市2020-2021学年高一上学期期末测试化学试题(已下线)【浙江新东方】在线化学60高一下(已下线)【浙江新东方】在线化学52高一上(已下线)【浙江新东方】高中化学20210429—009【2021】【高一下】广东省连平县忠信中学2020-2021学年高一下学期第二次段考化学试题(已下线)衔接点08 氧化还原反应的一般规律-2021年初升高化学无忧衔接(已下线)单科化学-2021年秋季高三开学摸底考试卷01(课标全国专用)陕西省西安市第一中学2022届高三上学期期中考试化学试题(已下线)第11讲 氧化还原反应的应用和配平-【暑假自学课】2022年新高一化学暑假精品课(鲁科版2019必修第一册)云南省丽江市2021-2022学年高一上学期9月测试化学试题 天津市武清区2022-2023学年高一上学期期中考试化学试题天津市第五十五中学2023-2024学年高一上学期期中检测化学试题浙江省湖州市2023-2024学年高一上学期1月期末化学试题
解题方法
8 . NaN3是汽车安全气囊系统中普遍使用的物质之一。当汽车受到猛烈碰撞时,瞬间引发反应:2NaN3 = 2Na + 3N2↑,同时释放大量的热。NaN3为离子化合物,下列说法正确的是
| A.生成3 mol N2时,转移2 mol电子 | B.1个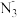 中含有21个电子 中含有21个电子 |
| C.NaN3中只含离子键 | D.N2的电子式为 N⋮⋮N |
您最近一年使用:0次
2021-04-05更新
|
325次组卷
|
4卷引用:吉林省榆树市第一高级中学校2020-2021学年高二下学期重点班测试(二)化学试题
吉林省榆树市第一高级中学校2020-2021学年高二下学期重点班测试(二)化学试题北京市石景山区2021届高三一模化学试题甘肃省天水市第五中学2020—2021学年高一下学期第一次月考化学试题(已下线)专题17 化学键(限时精炼)-2022年高三毕业班化学常考点归纳与变式演练
13-14高三·陕西西安·阶段练习
9 . Na2Sx在碱性条件下可被NaClO氧化为Na2SO4,而NaClO被还原为NaCl,若反应中Na2Sx与NaClO的个数比为1:16,则x值为
| A.2 | B.3 | C.4 | D.5 |
您最近一年使用:0次
2021-03-16更新
|
2765次组卷
|
36卷引用:吉林省扶余市第一中学2017-2018学年高二下学期期末考试化学试题
吉林省扶余市第一中学2017-2018学年高二下学期期末考试化学试题2014-2015学年河北省成安县第一中学高二6月月考化学试卷(已下线)2013-2014陕西西安铁一中、铁一中国际合作校高三五月月考化学试卷2015届陕西省西安市铁一中高三尖子班一模化学试卷河北省武邑中学2018届高三上学期第一次月考化学试题甘肃省武威市第六中学2018届高三上学期第二次阶段性过关考试化学试题江西省临川区第一中学2018届高三上学期第二次月考化学试题湖南省衡阳县第一中学2018届高三上学期第二次月考化学试题甘肃省天水一中2017-2018学年高一下学期入学考试化学试题(已下线)2019高考备考一轮复习精品资料 第二章 化学物质及其变化第3讲 氧化还原反应【教学案】山西省朔州市应县第一中学2019届高三9月月考化学试题内蒙古第一机械制造(集团)有限公司第一中学2018-2019学年高一上学期12月月考化学试题河南省濮阳市油田一中2019-2020学年高一上学期期中考试化学试题云南省曲靖市第一中学2019—2020学年高一上学期学科竞赛化学试题(已下线)考点03 氧化还原反应-2020年【衔接教材·暑假作业】新高三一轮复习化学(已下线)第4单元 氧化还原反应(B卷 滚动提升检测)-2021年高考化学一轮复习单元滚动双测卷(已下线)1.3.3 氧化还原反应的规律及应用-2020-2021学年高一化学同步课堂帮帮帮(人教版2019必修第一册)河南省驻马店新蔡高中2020-2021学年高一上学期阶段性检测(三)化学试题河南省滑县实验学校2020-2021学年高一上学期11月半月考试化学试题陕西省西安市长安区第一中学2020-2021学年高一上学期第二次月考化学试题天津市滨海新区2020-2021学年高一上学期期末考试化学试题专题4 专题强化练4硫及其化合物-高中化学苏教2019版必修第一册福建省三明市第一中学2020-2021学年高一下学期开学考试化学试题安徽省郎溪中学、泾县中学2020-2021学年高一下学期3月联考化学试题第3课时 氧化还原反应的基本规律和配平(课后)——课前、课中、课后同步专题精编(人教版2019必修第一册)(已下线)易错专题08 氧化还原反应规律的应用及相关计算-【突破易错·冲刺满分】2021-2022学年高一上学期化学期中期末易错专题(人教版2019)云南省曲靖市马龙区一中2021-2022学年高一下学期2月考试化学试题第一章 物质及其变化浙江省台州市书生中学2022-2023学年高一上学期第一次月考化学试题北京市通州区2020-2021年高一上学期期中考试化学试题浙江省宁波市五校联盟2022-2023学年高一上学期期中联考化学试题山东省淄博市桓台第二中学2021-2022学年高三上学期期中考试化学试题江苏省苏州市常熟中学2022-2023学年高一上学期末测试卷一化学试题黑龙江省哈尔滨市第三中学校 2023-2024 学年高一上学期第一次验收考试化学试题河南省遂平县第一高级中学2023-2024学年高一上学期第一次月考化学试题(已下线)专题08 氧化还原反应和离子反应-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(江苏专用)
名校
解题方法
10 . (1)水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O +O2+4OH-=Fe3O4↓+S4O
+O2+4OH-=Fe3O4↓+S4O +2H2O
+2H2O
①参加反应的氧化剂与还原剂的物质的量之比为______ 。
②若有2molFe2+被氧化,则被Fe2+还原的O2的物质的量为______ mol。
③每生成1molFe3O4,反应转移的电子为______ mol。
(2)往含Fe3+、H+、NO 的混合液中加入少量SO
的混合液中加入少量SO ,反应的离子方程式为
,反应的离子方程式为______ 。
 +O2+4OH-=Fe3O4↓+S4O
+O2+4OH-=Fe3O4↓+S4O +2H2O
+2H2O①参加反应的氧化剂与还原剂的物质的量之比为
②若有2molFe2+被氧化,则被Fe2+还原的O2的物质的量为
③每生成1molFe3O4,反应转移的电子为
(2)往含Fe3+、H+、NO
 的混合液中加入少量SO
的混合液中加入少量SO ,反应的离子方程式为
,反应的离子方程式为
您最近一年使用:0次



