名校
解题方法
1 . 已知:2H2O(l)=2H2(g)+O2(g) ΔH=+571.0 kJ/mol。以太阳能为热源分解Fe3O4,经热化学铁氧化合物循环分解水制H2的过程如下:
过程Ⅰ:2Fe3O4(s)=6FeO(s)+O2(g) ΔH=+313.2 kJ/mol
过程Ⅱ:…
过程Ⅰ:2Fe3O4(s)=6FeO(s)+O2(g) ΔH=+313.2 kJ/mol
过程Ⅱ:…
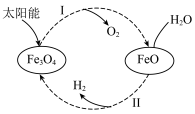
| A.过程Ⅰ中每消耗232 g Fe3O4转移2 mol电子 |
| B.过程Ⅱ的热化学方程式为3FeO(s)+H2O(l)=H2(g)+Fe3O4(s) ΔH=+128.9 kJ/mol |
| C.过程Ⅰ、Ⅱ中能量转化的形式依次是太阳能→化学能→热能 |
| D.铁氧化合物循环制H2具有成本低、产物易分离等优点 |
您最近一年使用:0次
2023-09-19更新
|
359次组卷
|
25卷引用:天津市第二中学2022-2023学年高二上学期期中检测化学试题
天津市第二中学2022-2023学年高二上学期期中检测化学试题海南省海南中学2019-2020学年高二上学期期末考试化学试题甘肃省天水市甘谷第一中学2019-2020学年高二下学期开学考试化学试题鲁科版(2019)选择性必修1第1章 化学反应与能量转化 第1节综合训练高中必刷题高二选择性必修1第一章 化学反应的热效应 第二节 反应热的计算 第二节综合训练河北省沧州市泊头市第一中学2020-2021学年高二上学期第一次月考化学试题山东省德州市夏津第一中学2020-2021学年高二上学期9月月考化学试题湖南省中方一中2020-2021学年高二上学期期中考试化学试题河北省沧州市黄骅中学2020-2021学年高二上学期第三次月考化学试题河南省鹤壁市高级中学2020-2021学年高二上学期尖子生联赛调研二化学试题(已下线)第一单元培优练-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)贵州省黔西南州赛文高级中学 2021-2022学年高二上学期期中考试化学试题河北省沧州市泊头市第一中学2021-2022学年高二上学期第一次月考化学试题【区级联考】北京市石景山区2019届高三第一学期期末考试化学试题辽宁省锦州市滨海实验中学2019-2020学年高三上学期期末考试化学试题(已下线)《2020年新高考政策解读与配套资源》模拟试题10-2020年北京新高考化学模拟试题(已下线)专题九 化学能与热能(提分特训)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训辽源市第五中学2019-2020学年高一下学期第二次月考化学试题河北省安平中学2020-2021学年高一下学期第四次月考(期末)化学试题(已下线)模块七 化学反应与能量(模块检测)-2022年高考化学一轮复习小题多维练(全国通用)(已下线)第七章 化学反应速率与化学平衡 热点强化12 化学反应历程、机理的分析应用(已下线)题型98 结合反应能量图示或物质循环图示书写热化学方程式山东省烟台市招远第一中学2022-2023学年高一下学期期中考试化学(等级考)试题(已下线)章末综合评价(六)河南省洛阳市宜阳县第一高级中学清北园2023-2024学年高一上学期第七次能力达标测试化学试卷
2 . 工业上利用电解精炼锡后的阳极泥(含 Cu、Ag、PbSO4 及少量的 Sn 等)回收金属 Cu 和Ag 的流程如图,下列说法正确的是
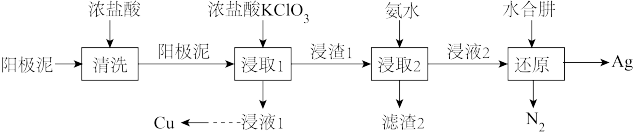

| A.“清洗”时加入浓盐酸的作用是除去 PbSO4 |
B.“浸液 2”的主要成分是[Ag(NH3)2]Cl,氨水溶解氯化银的离子方程式为: 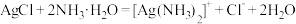 |
| C.若运用铅蓄电池来电解精炼锡,Pb 电极与粗锡相连 |
| D.若制得 2mol 银,至少需要水合肼(N2H4•H2O)12.5g |
您最近一年使用:0次
名校
解题方法
3 . 低碳经济成为人们一种新的生活理念,二氧化碳的捕捉和利用是能源领域的一个重要研究方向。结合下列有关图示和所学知识回答:
(1)用CO2催化加氢可以制取乙烯:CO2(g)+3H2(g)
 C2H4(g)+2H2O(g)。若该反应体系的能量随反应过程变化关系如图所示,则该反应的△H=
C2H4(g)+2H2O(g)。若该反应体系的能量随反应过程变化关系如图所示,则该反应的△H=____ kJ•mol-1(用含a、b的式子表示)。又知:相关化学键的键能如表所示,实验测得上述反应的△H=-152kJ•mol-1,则表中的x=____ 。

注:乙烯结构如图:
(2)用NA表示阿伏加德罗常数,在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出650kJ的热量。其燃烧热的热化学方程式为____ 。
(3)二氧化碳的捕集、利用是我国能源领域的一个重要战略方向。
①科学家提出由CO2制取C的太阳能工艺如图所示。

已知“重整系统”发生的反应中 =6,则FexOy的化学式为
=6,则FexOy的化学式为____ 。“热分解系统”中每分解1molFexOy,转移电子的物质的量为____ mol。
②工业上用CO2和H2反应合成二甲醚。已知:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H1=-53.7kJ•mol-1,CH3OCH3(g)+H2O(g)=2CH3OH(g) △H1=+23.4kJ•mol-1,则2CO2(g)+6H2(g)=CH3OCH3(g)+3H2O(g) △H3____ kJ•mol-1。
(1)用CO2催化加氢可以制取乙烯:CO2(g)+3H2(g)

 C2H4(g)+2H2O(g)。若该反应体系的能量随反应过程变化关系如图所示,则该反应的△H=
C2H4(g)+2H2O(g)。若该反应体系的能量随反应过程变化关系如图所示,则该反应的△H=
| 化学键 | C=O | H-H | C=C | C-H | H-O |
| 键能/kJ•mol-1 | 803 | 436 | x | 414 | 464 |
注:乙烯结构如图:

(2)用NA表示阿伏加德罗常数,在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出650kJ的热量。其燃烧热的热化学方程式为
(3)二氧化碳的捕集、利用是我国能源领域的一个重要战略方向。
①科学家提出由CO2制取C的太阳能工艺如图所示。

已知“重整系统”发生的反应中
 =6,则FexOy的化学式为
=6,则FexOy的化学式为②工业上用CO2和H2反应合成二甲醚。已知:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H1=-53.7kJ•mol-1,CH3OCH3(g)+H2O(g)=2CH3OH(g) △H1=+23.4kJ•mol-1,则2CO2(g)+6H2(g)=CH3OCH3(g)+3H2O(g) △H3
您最近一年使用:0次
4 . 重金属元素铬的毒性较大,含铬废水需经处理达标后才能排放。
I.某工业废水中主要含有Cr3+,同时还含有少量的Fe2+、Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强。为回收利用,通常采用如下流程处理:

注:常温下,部分用离子以氢氧化物形式完全沉淀时所需的pH,如下表:
(1)氧化过程中可代替H2O2加入的试剂是___________(填字母,下同)。
(2)加入NaOH溶液调整溶液pH=8时,除去的离子是_______ (填写下面选项字母)。已知钠离子交换树脂的原理: ,此步操作被交换除去的杂质离子是
,此步操作被交换除去的杂质离子是________ 。(填写下面选项字母)
A.Fe3+ B.Al3+ C.Ca2+ D.Mg2+
(3)还原过程在酸性条件下进行,每消耗0.8 mol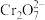 转移4.8 mole-,该反应离子方程式为
转移4.8 mole-,该反应离子方程式为___________ 。
II.酸性条件下,六价铬主要以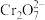 形式存在,工业上常用电解法处理含
形式存在,工业上常用电解法处理含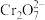 的废水,该法用Fe作电极电解含
的废水,该法用Fe作电极电解含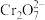 的酸性废水,随着电解进行,在阴极附近溶液pH升高,并产生Cr(OH)3。
的酸性废水,随着电解进行,在阴极附近溶液pH升高,并产生Cr(OH)3。
(4)电解时能否用Cu电极来代替Fe电极?_______ (填“能”或“不能”),理由是_______ 。
(5)在阴极附近溶液pH升高的原因是___________ 。
I.某工业废水中主要含有Cr3+,同时还含有少量的Fe2+、Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强。为回收利用,通常采用如下流程处理:

注:常温下,部分用离子以氢氧化物形式完全沉淀时所需的pH,如下表:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
| pH | 3.7 | 9.6 | 11.1 | 8 | 9 |
(1)氧化过程中可代替H2O2加入的试剂是___________(填字母,下同)。
| A.Na2O2 | B.HNO3 | C.FeCl3 | D.KMnO4 |
 ,此步操作被交换除去的杂质离子是
,此步操作被交换除去的杂质离子是A.Fe3+ B.Al3+ C.Ca2+ D.Mg2+
(3)还原过程在酸性条件下进行,每消耗0.8 mol
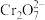 转移4.8 mole-,该反应离子方程式为
转移4.8 mole-,该反应离子方程式为II.酸性条件下,六价铬主要以
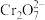 形式存在,工业上常用电解法处理含
形式存在,工业上常用电解法处理含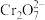 的废水,该法用Fe作电极电解含
的废水,该法用Fe作电极电解含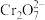 的酸性废水,随着电解进行,在阴极附近溶液pH升高,并产生Cr(OH)3。
的酸性废水,随着电解进行,在阴极附近溶液pH升高,并产生Cr(OH)3。(4)电解时能否用Cu电极来代替Fe电极?
(5)在阴极附近溶液pH升高的原因是
您最近一年使用:0次
名校
解题方法
5 . 结合所学内容,回答下列问题:
Ⅰ.某同学进行影响草酸与酸性高锰酸钾溶液反应速率因素的研究。草酸与酸性高锰酸钾的反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O。室温下,两支试管分别编号①和②,实验数据如下:
试管①中KMnO4溶液褪色的速率开始十分缓慢,一段时间后突然加快。
请回答:
(1)该实验结论是___________________________________________________________ 。
(2)实验②选用MnSO4固体而不是MnCl2固体的原因是____________________________ 。
(3)该同学为使实验更加严密,在试管③中做了如下实验,请预测褪色时间约为_____ 。
Ⅱ.滴定法是一种重要的定量分析方法,应用范围很广。某城市场上销售的一种食用精制盐包装袋上有如下部分说明:
已知:IO +5I-+6H+ = 3I2+3H2O,I2+2S2O
+5I-+6H+ = 3I2+3H2O,I2+2S2O = 2I-+S4O
= 2I-+S4O 某学生拟测定食用精制盐的碘含量,其步骤为
某学生拟测定食用精制盐的碘含量,其步骤为
a.准确称取W g食盐,加适量蒸馏水使其完全溶解
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全
c.加入指示剂,逐滴加入物质的量浓度为2.0×10-3 mol·L-1的Na2S2O3溶液10.0 mL,恰好反应完全
(4)c中加入的指示剂可选用_________ ,恰好完全反应时的现象是_______________ 。
(5)若操作b在空气中振荡时间过长,则最终测定的测定食用精制盐中的的碘含量会__________ (填“偏高”、“偏低”或“没有影响”)。
(6)根据以上实验和包装说明,算得所测食用精制盐的碘含量是(以含W的代数式表示)________ mg·kg-1(计算结果保留整数即可)。
Ⅰ.某同学进行影响草酸与酸性高锰酸钾溶液反应速率因素的研究。草酸与酸性高锰酸钾的反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O。室温下,两支试管分别编号①和②,实验数据如下:
| 实验序号 | ① | ② |
| 加入试剂 | 4 mL 0.01mol/L酸性 KMnO4溶液 2 mL 0.1mol/L H2C2O4溶液 | 4 mL 0.01mol/L酸性 KMnO4溶液 2 mL 0.1mol/L H2C2O4溶液 一粒黄豆粒大的MnSO4固体 |
| 褪色时间/s | 116 | 6 |
请回答:
(1)该实验结论是
(2)实验②选用MnSO4固体而不是MnCl2固体的原因是
(3)该同学为使实验更加严密,在试管③中做了如下实验,请预测褪色时间约为
| 实验序号 | ③ |
| 加入试剂 | 4 mL 0.01mol/L酸性 KMnO4溶液 2 mL 0.1mol/L H2C2O4溶液 一粒黄豆粒大的Na2SO4固体 |
| 褪色时间/s |
| 产品等级 | 一级 |
| 配料 | 食盐、碘酸钾(KIO3)、抗结剂 |
| 碘含量(以I计) | 20~50 mg·kg-1 |
 +5I-+6H+ = 3I2+3H2O,I2+2S2O
+5I-+6H+ = 3I2+3H2O,I2+2S2O = 2I-+S4O
= 2I-+S4O 某学生拟测定食用精制盐的碘含量,其步骤为
某学生拟测定食用精制盐的碘含量,其步骤为a.准确称取W g食盐,加适量蒸馏水使其完全溶解
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全
c.加入指示剂,逐滴加入物质的量浓度为2.0×10-3 mol·L-1的Na2S2O3溶液10.0 mL,恰好反应完全
(4)c中加入的指示剂可选用
(5)若操作b在空气中振荡时间过长,则最终测定的测定食用精制盐中的的碘含量会
(6)根据以上实验和包装说明,算得所测食用精制盐的碘含量是(以含W的代数式表示)
您最近一年使用:0次
2018-12-06更新
|
212次组卷
|
3卷引用:【校级联考】天津市七校(静海一中,杨村中学,宝坻一中,大港一中等)2018-2019学年高二上学期期中联考化学试题



