解题方法
1 . 一种制备 的工艺路线如图所示
的工艺路线如图所示
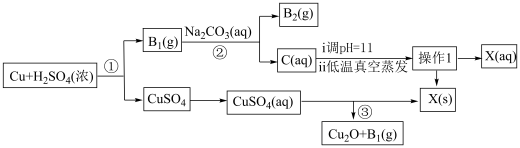
已知:ⅰ.常温下, 的电离平衡常数
的电离平衡常数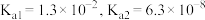
ⅱ.反应②所得C溶液 在
在 之间
之间
ⅲ.反应③需及时补加 以保持反应在
以保持反应在 条件下进行。
条件下进行。
(1)反应①中氧化剂与还原剂物质的量之比为___________ ,溶液C的溶质为___________ (填化学式)。
(2)低温真空蒸发主要目的是___________ ,操作1的名称为___________ 。
(3)写出流程中可以循环利用的物质___________ (填化学式)。
(4)写出反应③的化学反应方程式___________ 。
(5)若 产量不变,参与反应③的X与
产量不变,参与反应③的X与 物质的量之比
物质的量之比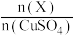 增大时,需补加
增大时,需补加 的量
的量___________ (填“减少”或“增多”或“不变”)。
 的工艺路线如图所示
的工艺路线如图所示
已知:ⅰ.常温下,
 的电离平衡常数
的电离平衡常数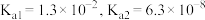
ⅱ.反应②所得C溶液
 在
在 之间
之间ⅲ.反应③需及时补加
 以保持反应在
以保持反应在 条件下进行。
条件下进行。(1)反应①中氧化剂与还原剂物质的量之比为
(2)低温真空蒸发主要目的是
(3)写出流程中可以循环利用的物质
(4)写出反应③的化学反应方程式
(5)若
 产量不变,参与反应③的X与
产量不变,参与反应③的X与 物质的量之比
物质的量之比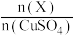 增大时,需补加
增大时,需补加 的量
的量
您最近一年使用:0次
2 . 卤族元素的化合物在生活、医药、化工中有着重要的用途。
Ⅰ.过氧化氢氧化法制备碘酸钾(KIO3)的方法如图:
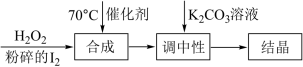
(1)合成步骤的加热方法为______ ,发生反应的化学方程式为____________________ 。
(2)当合成温度高于70℃,碘酸钾产率会降低,写出可能的两种原因:____________________ 。
Ⅱ.ClO2和Cl2都可以用于自来水消毒杀菌,可以通过下列方法制取: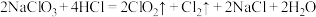
(3)该反应的氧化产物为______ ,若反应过程中有4 mol HCl参与反应,则电子转移的数目为______ 。
Ⅲ.目前从海水中提溴(Br2)大致有“浓缩”、“氧化”、“提取”等步骤。
(4)向浓缩的海水中通入Cl2,将海水中的 氧化为Br2,再用热空气将Br2从溶液中吹出,并由浓Na2CO3溶液吸收,转变为NaBr、NaBrO3和CO2,吸收反应的离子方程式为
氧化为Br2,再用热空气将Br2从溶液中吹出,并由浓Na2CO3溶液吸收,转变为NaBr、NaBrO3和CO2,吸收反应的离子方程式为____________________ 。
Ⅰ.过氧化氢氧化法制备碘酸钾(KIO3)的方法如图:

(1)合成步骤的加热方法为
(2)当合成温度高于70℃,碘酸钾产率会降低,写出可能的两种原因:
Ⅱ.ClO2和Cl2都可以用于自来水消毒杀菌,可以通过下列方法制取:
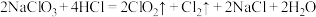
(3)该反应的氧化产物为
Ⅲ.目前从海水中提溴(Br2)大致有“浓缩”、“氧化”、“提取”等步骤。
(4)向浓缩的海水中通入Cl2,将海水中的
 氧化为Br2,再用热空气将Br2从溶液中吹出,并由浓Na2CO3溶液吸收,转变为NaBr、NaBrO3和CO2,吸收反应的离子方程式为
氧化为Br2,再用热空气将Br2从溶液中吹出,并由浓Na2CO3溶液吸收,转变为NaBr、NaBrO3和CO2,吸收反应的离子方程式为
您最近一年使用:0次
名校
3 . 下列反应中,氧化剂与还原剂化学计量数为1:2的是
| A.Fe+2HCl=FeCl2+H2↑ |
| B.2HCl+Ca(ClO)2=2HClO+CaCl2 |
| C.I2+2NaClO3=2NaIO3+Cl2↑ |
D.4HCl(浓)+MnO2 MnCl2+Cl2↑+2H2O MnCl2+Cl2↑+2H2O |
您最近一年使用:0次
解题方法
4 . 锰酸锂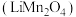 作为一种新型锂电池正极材料受到广泛关注。工业上利用
作为一种新型锂电池正极材料受到广泛关注。工业上利用 溶液多途径制备锰酸锂的流程如下,回答下列问题:
溶液多途径制备锰酸锂的流程如下,回答下列问题:

已知:①硫酸的结构为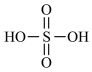
②干冰的晶胞结构见图。
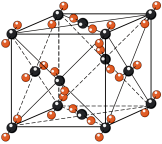
(1)将干冰晶胞沿体对角线投影,●代表 分子,则
分子,则 的投影图为______(选填序号)
的投影图为______(选填序号)
(2)工艺1中, 中S元素的化合价为
中S元素的化合价为 ,画出
,画出 的结构式
的结构式______ 。
(3)工艺2中,发生电解反应的离子方程式为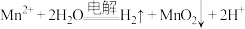 。随着电解反应进行,为保持电解液成分和浓度稳定,应不断加入
。随着电解反应进行,为保持电解液成分和浓度稳定,应不断加入______ (填化学式)。
(4)工艺3中,“沉锰、过滤”得到 和
和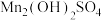 ;若“控温、氧化”时溶液的pH显著减小,此时
;若“控温、氧化”时溶液的pH显著减小,此时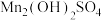 发生反应的化学方程式为
发生反应的化学方程式为______ 。
(5)为控制碳排放,用NaOH溶液吸收焙烧窑中释放的 并转化为正盐,理论上消耗的
并转化为正盐,理论上消耗的 和NaOH的物质的量之比为
和NaOH的物质的量之比为______ 。
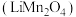 作为一种新型锂电池正极材料受到广泛关注。工业上利用
作为一种新型锂电池正极材料受到广泛关注。工业上利用 溶液多途径制备锰酸锂的流程如下,回答下列问题:
溶液多途径制备锰酸锂的流程如下,回答下列问题:
已知:①硫酸的结构为

②干冰的晶胞结构见图。

(1)将干冰晶胞沿体对角线投影,●代表
 分子,则
分子,则 的投影图为______(选填序号)
的投影图为______(选填序号)A.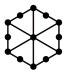 | B.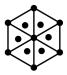 |
C.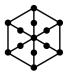 | D.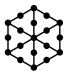 |
(2)工艺1中,
 中S元素的化合价为
中S元素的化合价为 ,画出
,画出 的结构式
的结构式(3)工艺2中,发生电解反应的离子方程式为
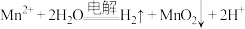 。随着电解反应进行,为保持电解液成分和浓度稳定,应不断加入
。随着电解反应进行,为保持电解液成分和浓度稳定,应不断加入(4)工艺3中,“沉锰、过滤”得到
 和
和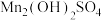 ;若“控温、氧化”时溶液的pH显著减小,此时
;若“控温、氧化”时溶液的pH显著减小,此时 发生反应的化学方程式为
发生反应的化学方程式为(5)为控制碳排放,用NaOH溶液吸收焙烧窑中释放的
 并转化为正盐,理论上消耗的
并转化为正盐,理论上消耗的 和NaOH的物质的量之比为
和NaOH的物质的量之比为
您最近一年使用:0次
名校
解题方法
5 . 铬和钒具有广泛用途。铬钒渣中铬和钒以低价态含氧酸盐形式存在,主要杂质为铁、铝、硅、磷等的化合物,从铬钒渣中分离提取铬和钒的一种流程如下图所示:
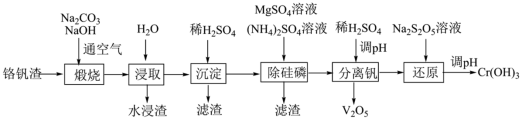
已知:最高价铬酸根在酸性介质中以 存在,在碱性介质中以
存在,在碱性介质中以 存在。
存在。
(1)煅烧过程中,钒和铬被氧化为相应的最高价含氧酸盐,其中含铬化合物主要为_______ (填化学式)。
(2)“沉淀”步骤中主要生成的滤渣为_______ (填化学式)。
(3)“除硅磷”步骤中,使硅、磷分别以 和
和 的形式沉淀,该步需要控制溶液的
的形式沉淀,该步需要控制溶液的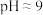 的原因为
的原因为_______ 。
(4)“分离钒”步骤中,将溶液pH调到1.8左右得到 沉淀,
沉淀, 在
在 时溶解为
时溶解为 的离子方程式为
的离子方程式为_______ 。
(5)“还原”步骤中加入焦亚硫酸钠 溶液,反应中氧化剂和还原剂的物质的量之比为
溶液,反应中氧化剂和还原剂的物质的量之比为_______ ; 的性质与
的性质与 相似,写出
相似,写出 与
与 溶液反应的离子方程式
溶液反应的离子方程式_______ 。

已知:最高价铬酸根在酸性介质中以
 存在,在碱性介质中以
存在,在碱性介质中以 存在。
存在。(1)煅烧过程中,钒和铬被氧化为相应的最高价含氧酸盐,其中含铬化合物主要为
(2)“沉淀”步骤中主要生成的滤渣为
(3)“除硅磷”步骤中,使硅、磷分别以
 和
和 的形式沉淀,该步需要控制溶液的
的形式沉淀,该步需要控制溶液的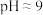 的原因为
的原因为(4)“分离钒”步骤中,将溶液pH调到1.8左右得到
 沉淀,
沉淀, 在
在 时溶解为
时溶解为 的离子方程式为
的离子方程式为(5)“还原”步骤中加入焦亚硫酸钠
 溶液,反应中氧化剂和还原剂的物质的量之比为
溶液,反应中氧化剂和还原剂的物质的量之比为 的性质与
的性质与 相似,写出
相似,写出 与
与 溶液反应的离子方程式
溶液反应的离子方程式
您最近一年使用:0次
6 . 运用化学反应原理研究硫单质及其化合物的反应,对生产、生活、环境保护等领域有着重要的意义。
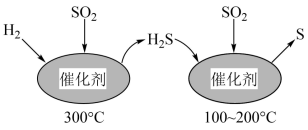
(1)工业上采用 催化还原
催化还原 ,不仅可以消除
,不仅可以消除 污染,还可得到单质S。反应分两步完成,如图所示,
污染,还可得到单质S。反应分两步完成,如图所示, 催化还原
催化还原 第一步反应的化学方程式为
第一步反应的化学方程式为___________ 。
(2)工业上常用 溶液对燃煤烟气进行脱硫、脱硝。
溶液对燃煤烟气进行脱硫、脱硝。
已知 溶液具有强氧化性,酸性条件下
溶液具有强氧化性,酸性条件下 发生歧化反应生成
发生歧化反应生成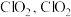 易溶于水,具有强氧化性,可氧化
易溶于水,具有强氧化性,可氧化 。
。
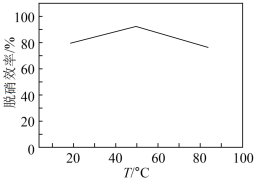
①实验室模拟脱硫过程:先加稀硫酸调节 吸收液的
吸收液的 为5,再向其中通入含
为5,再向其中通入含 的模拟烟气,测得脱硫效率(即
的模拟烟气,测得脱硫效率(即 的吸收率)随温度变化的曲线如图所示。结合已知信息分析,温度大于
的吸收率)随温度变化的曲线如图所示。结合已知信息分析,温度大于 时,随温度升高脱硫效率下降的原因是
时,随温度升高脱硫效率下降的原因是___________ 。
②煤燃烧排放的烟气含有 和
和 ,采用
,采用 溶液作为吸收剂可同时对烟气进行脱硫、脱硝。将含有
溶液作为吸收剂可同时对烟气进行脱硫、脱硝。将含有 和
和 的烟气通入盛有
的烟气通入盛有 溶液的反应器中,反应一段时间后,测得溶液中离子浓度的有关数据如表(其他离子忽略不计):
溶液的反应器中,反应一段时间后,测得溶液中离子浓度的有关数据如表(其他离子忽略不计):
表中y=_______ 。若该溶液为 (吸收前后溶液体积不变),该过程转移的电子数为
(吸收前后溶液体积不变),该过程转移的电子数为______ mol。(写出计算过程)。
(1)工业上采用
 催化还原
催化还原 ,不仅可以消除
,不仅可以消除 污染,还可得到单质S。反应分两步完成,如图所示,
污染,还可得到单质S。反应分两步完成,如图所示, 催化还原
催化还原 第一步反应的化学方程式为
第一步反应的化学方程式为
(2)工业上常用
 溶液对燃煤烟气进行脱硫、脱硝。
溶液对燃煤烟气进行脱硫、脱硝。已知
 溶液具有强氧化性,酸性条件下
溶液具有强氧化性,酸性条件下 发生歧化反应生成
发生歧化反应生成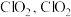 易溶于水,具有强氧化性,可氧化
易溶于水,具有强氧化性,可氧化 。
。①实验室模拟脱硫过程:先加稀硫酸调节
 吸收液的
吸收液的 为5,再向其中通入含
为5,再向其中通入含 的模拟烟气,测得脱硫效率(即
的模拟烟气,测得脱硫效率(即 的吸收率)随温度变化的曲线如图所示。结合已知信息分析,温度大于
的吸收率)随温度变化的曲线如图所示。结合已知信息分析,温度大于 时,随温度升高脱硫效率下降的原因是
时,随温度升高脱硫效率下降的原因是
②煤燃烧排放的烟气含有
 和
和 ,采用
,采用 溶液作为吸收剂可同时对烟气进行脱硫、脱硝。将含有
溶液作为吸收剂可同时对烟气进行脱硫、脱硝。将含有 和
和 的烟气通入盛有
的烟气通入盛有 溶液的反应器中,反应一段时间后,测得溶液中离子浓度的有关数据如表(其他离子忽略不计):
溶液的反应器中,反应一段时间后,测得溶液中离子浓度的有关数据如表(其他离子忽略不计):| 离子 |  |  |  |  |  |
浓度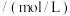 | 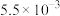 |  |  |  |  |
 (吸收前后溶液体积不变),该过程转移的电子数为
(吸收前后溶液体积不变),该过程转移的电子数为
您最近一年使用:0次
7 . Ⅰ.无水 与
与 作用会生成
作用会生成 。现有
。现有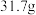 无水
无水 ,吸收
,吸收 后变成
后变成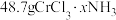 ,试回答下列问题:
,试回答下列问题:
(1) 中
中
______ 。
(2) 为配合物,其中
为配合物,其中 的配位数为6,经测定
的配位数为6,经测定 该配合物和足量
该配合物和足量 溶液反应得到
溶液反应得到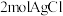 沉淀,则该配合物的化学式可表示为
沉淀,则该配合物的化学式可表示为______ 。
Ⅱ.将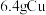 溶于
溶于 过量的硝酸溶液中,假设硝酸的还原产物只有
过量的硝酸溶液中,假设硝酸的还原产物只有 和
和 。反应结束后,将所得的溶液加水稀释至
。反应结束后,将所得的溶液加水稀释至 ,测得
,测得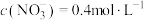 。(假设生成气体完全逸出)。请计算:
。(假设生成气体完全逸出)。请计算:
(3)稀释后溶液中 的物质的量浓度
的物质的量浓度______ 
(4)生成的气体中 物质的量
物质的量______  (用含有
(用含有 的表达式表示)
的表达式表示)
 与
与 作用会生成
作用会生成 。现有
。现有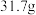 无水
无水 ,吸收
,吸收 后变成
后变成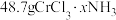 ,试回答下列问题:
,试回答下列问题:(1)
 中
中
(2)
 为配合物,其中
为配合物,其中 的配位数为6,经测定
的配位数为6,经测定 该配合物和足量
该配合物和足量 溶液反应得到
溶液反应得到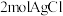 沉淀,则该配合物的化学式可表示为
沉淀,则该配合物的化学式可表示为Ⅱ.将
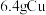 溶于
溶于 过量的硝酸溶液中,假设硝酸的还原产物只有
过量的硝酸溶液中,假设硝酸的还原产物只有 和
和 。反应结束后,将所得的溶液加水稀释至
。反应结束后,将所得的溶液加水稀释至 ,测得
,测得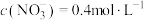 。(假设生成气体完全逸出)。请计算:
。(假设生成气体完全逸出)。请计算:(3)稀释后溶液中
 的物质的量浓度
的物质的量浓度
(4)生成的气体中
 物质的量
物质的量 (用含有
(用含有 的表达式表示)
的表达式表示)
您最近一年使用:0次
解题方法
8 . 回答下列问题。
(1)已知H2O2是二元弱酸,请写出H2O2与NaOH溶液反应生成酸式盐的化学方程式_______ 。
(2)储氢纳米碳管研究成功体现了科技的进步。但用电弧法合成的碳纳米管常伴有大量的杂质——碳纳米颗粒。这种碳纳米颗粒可用氧化气化法提纯。其反应方程式为3C+2K2Cr2O7+8H2SO4=3CO2↑+2K2SO4+2Cr2(SO4)3+8H2O。请回答下列问题:
①用双线桥法标明上述反应方程式中电子转移的方向和数目___________ 。
②上述反应中氧化剂是___________ ,每生成1molCO2,转移电子数目为___________ 。
(3)高铁酸钾K2FeO4是新型高效多功能的绿色消毒剂,湿法制备高铁酸钾的反应体系中有六种微粒:Fe(OH)3、Cl-、OH-、ClO-、H2O、 ,写出湿法制备高铁酸钾的离子方程式:
,写出湿法制备高铁酸钾的离子方程式:___________ 。
(1)已知H2O2是二元弱酸,请写出H2O2与NaOH溶液反应生成酸式盐的化学方程式
(2)储氢纳米碳管研究成功体现了科技的进步。但用电弧法合成的碳纳米管常伴有大量的杂质——碳纳米颗粒。这种碳纳米颗粒可用氧化气化法提纯。其反应方程式为3C+2K2Cr2O7+8H2SO4=3CO2↑+2K2SO4+2Cr2(SO4)3+8H2O。请回答下列问题:
①用双线桥法标明上述反应方程式中电子转移的方向和数目
②上述反应中氧化剂是
(3)高铁酸钾K2FeO4是新型高效多功能的绿色消毒剂,湿法制备高铁酸钾的反应体系中有六种微粒:Fe(OH)3、Cl-、OH-、ClO-、H2O、
 ,写出湿法制备高铁酸钾的离子方程式:
,写出湿法制备高铁酸钾的离子方程式:
您最近一年使用:0次
解题方法
9 . 请按要求回答下列问题:
(1)写出硫酸氢钠溶于水的电离方程式:___________ 。
(2)写出实验室制取氯气的离子反应方程式:___________ 。
(3)我国古代四大发明之一的黑火药是由硫黄、硝酸钾和木炭粉按一定比例混合而成,爆炸时的反应为:S+2KNO3+3C=K2S+N2↑+3CO2↑。
①该反应的氧化剂是___________ 。
②在标准状况下,若生成22.4L气体,则转移的电子数目为___________ NA。
(4)某元素G的一种含氧酸化学式为H3GO3,属于二元酸,则H3GO3与过量氢氧化钠溶液反应生成的产物Na2HGO3为___________ (填“酸式盐”或“正盐”)。
(1)写出硫酸氢钠溶于水的电离方程式:
(2)写出实验室制取氯气的离子反应方程式:
(3)我国古代四大发明之一的黑火药是由硫黄、硝酸钾和木炭粉按一定比例混合而成,爆炸时的反应为:S+2KNO3+3C=K2S+N2↑+3CO2↑。
①该反应的氧化剂是
②在标准状况下,若生成22.4L气体,则转移的电子数目为
(4)某元素G的一种含氧酸化学式为H3GO3,属于二元酸,则H3GO3与过量氢氧化钠溶液反应生成的产物Na2HGO3为
您最近一年使用:0次
10 . 钯( )是航天、航空等高科技领域以及汽车制造业不可缺少的关键材料。为节约和充分利用资源,以废钯催化剂(主要成分是钯、碳、有机物及少量
)是航天、航空等高科技领域以及汽车制造业不可缺少的关键材料。为节约和充分利用资源,以废钯催化剂(主要成分是钯、碳、有机物及少量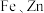 等元素)为原料通过如下工艺流程回收钯。
等元素)为原料通过如下工艺流程回收钯。
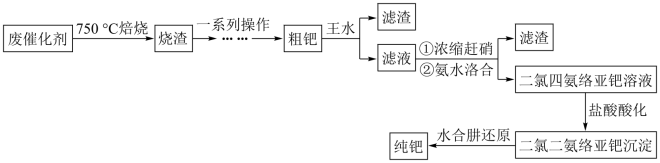
回答下列问题:
(1)“焙烧”时通入的空气一定要足量,目的是_______ 。
(2)“一系列操作”包括向烧渣中加入 ,目的是将
,目的是将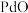 还原得到粗钯,写出反应的化学方程式:
还原得到粗钯,写出反应的化学方程式:___________ 。
(3)得到粗钯后,用王水在一定温度下充分浸取钯,得到氯亚钯酸( )和一种有毒的无色气体
)和一种有毒的无色气体 ,该气体遇空气变为红棕色,该反应中消耗的
,该气体遇空气变为红棕色,该反应中消耗的 与
与 的物质的量之比为
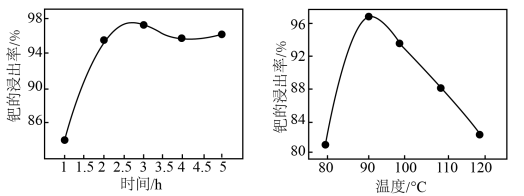
的物质的量之比为_______ 。钯的浸出率与反应的时间、温度的关系如图所示,则最佳的浸取时间和温度为_______ 。
(4)“氨水络合”时需要控制好溶液的 ,已知常温下,
,已知常温下, ,
, ,要使得溶液中的杂质金属离子沉淀完全(即金属离子浓度低于
,要使得溶液中的杂质金属离子沉淀完全(即金属离子浓度低于 ),
), 至少调节为
至少调节为______ (保留三位有效数字)。(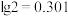 )
)
(5)海绵状金属钯密度为 ,具有优良的吸氢功能,标准状况下,其吸附的氢气是其体积的840倍,则此条件下海绵钯的吸附容量
,具有优良的吸氢功能,标准状况下,其吸附的氢气是其体积的840倍,则此条件下海绵钯的吸附容量
______ 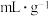 ,氢气的浓度
,氢气的浓度
______ (保留小数点后两位)。(吸附容量 即
即 钯吸附氢气的体积;氢气的浓度
钯吸附氢气的体积;氢气的浓度 为
为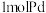 吸附标准状况下氢气的物质的量)
吸附标准状况下氢气的物质的量)
 )是航天、航空等高科技领域以及汽车制造业不可缺少的关键材料。为节约和充分利用资源,以废钯催化剂(主要成分是钯、碳、有机物及少量
)是航天、航空等高科技领域以及汽车制造业不可缺少的关键材料。为节约和充分利用资源,以废钯催化剂(主要成分是钯、碳、有机物及少量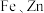 等元素)为原料通过如下工艺流程回收钯。
等元素)为原料通过如下工艺流程回收钯。
回答下列问题:
(1)“焙烧”时通入的空气一定要足量,目的是
(2)“一系列操作”包括向烧渣中加入
 ,目的是将
,目的是将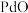 还原得到粗钯,写出反应的化学方程式:
还原得到粗钯,写出反应的化学方程式:(3)得到粗钯后,用王水在一定温度下充分浸取钯,得到氯亚钯酸(
 )和一种有毒的无色气体
)和一种有毒的无色气体 ,该气体遇空气变为红棕色,该反应中消耗的
,该气体遇空气变为红棕色,该反应中消耗的 与
与 的物质的量之比为
的物质的量之比为
(4)“氨水络合”时需要控制好溶液的
 ,已知常温下,
,已知常温下, ,
, ,要使得溶液中的杂质金属离子沉淀完全(即金属离子浓度低于
,要使得溶液中的杂质金属离子沉淀完全(即金属离子浓度低于 ),
), 至少调节为
至少调节为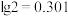 )
)(5)海绵状金属钯密度为
 ,具有优良的吸氢功能,标准状况下,其吸附的氢气是其体积的840倍,则此条件下海绵钯的吸附容量
,具有优良的吸氢功能,标准状况下,其吸附的氢气是其体积的840倍,则此条件下海绵钯的吸附容量
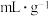 ,氢气的浓度
,氢气的浓度
 即
即 钯吸附氢气的体积;氢气的浓度
钯吸附氢气的体积;氢气的浓度 为
为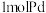 吸附标准状况下氢气的物质的量)
吸附标准状况下氢气的物质的量)
您最近一年使用:0次



