1 . 2021年诺贝尔化学奖授予两位“不对称有机催化”领域的先驱,催化剂经常用在有机化学中,例如铁的配合物离子(用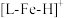 表示)催化甲酸分解的反应机理和相对能量的变化情况如图所示:
表示)催化甲酸分解的反应机理和相对能量的变化情况如图所示:

下列说法正确的是
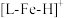 表示)催化甲酸分解的反应机理和相对能量的变化情况如图所示:
表示)催化甲酸分解的反应机理和相对能量的变化情况如图所示:
下列说法正确的是
| A.该过程的总反应为吸热反应 |
| B.该过程的总反应速率由Ⅱ→Ⅲ步骤决定 |
C.该过程中,溶液 值的大小会影响化学反应的快慢 值的大小会影响化学反应的快慢 |
D.在整个过程中,每生成标况下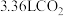 转移电子数为 转移电子数为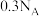 |
您最近一年使用:0次
2 . 油画创作通常需要用到多种无机颜料。研究发现,在不同的空气湿度和光照条件下,颜料雌黄( )褪色的主要原因是发生了以下两种化学反应:
)褪色的主要原因是发生了以下两种化学反应:
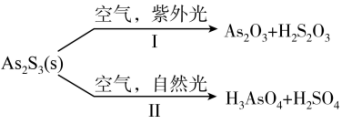
下列说法正确的是
 )褪色的主要原因是发生了以下两种化学反应:
)褪色的主要原因是发生了以下两种化学反应:
下列说法正确的是
A.反应Ⅰ和Ⅱ中,氧化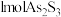 转移的电子数之比为 转移的电子数之比为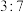 |
B. 和 和 的空间结构都是正四面体形 的空间结构都是正四面体形 |
C.元素 和 和 形成的气态氢化物,键角 形成的气态氢化物,键角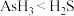 |
D.酸性: |
您最近一年使用:0次
名校
3 . NO2的储存和还原技术能有效降低柴油发动机在空气过量时排放的NO2,原理如图1所示。用H2模拟尾气中还原性气体研究了Ba(NO3)2的催化还原过程,如图2所示。
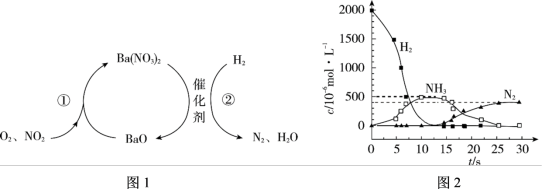
下列说法不正确 的是

下列说法
| A.反应①为4NO2 + O2 + 2BaO = 2Ba(NO3)2 |
| B.储存和还原技术也能降低尾气排放的NO |
| C.0~12.5 s内,氢气的消耗速率为v(H2) = 1.6 × 10﹣4 mol/(L·s) |
| D.反应②分两步进行, 第一步反应消耗的H2与Ba(NO3)2的物质的量之比是1∶8 |
您最近一年使用:0次
名校
解题方法
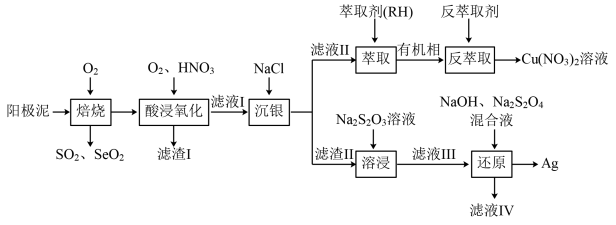
4 . 一种从阳极泥(主要成分为Cu、Ag、Pt、Au、 、
、 等)中回收Se和贵重金属的工艺流程如图所示:
等)中回收Se和贵重金属的工艺流程如图所示:
已知:①该工艺中萃取与反萃取的原理为: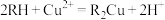 。
。
② 易与
易与 形成配离子:
形成配离子: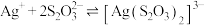 ,上述工艺条件下该反应的平衡常数为
,上述工艺条件下该反应的平衡常数为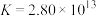 。
。
③上述工艺条件下,AgCl的溶度积常数: 。
。
(1)“焙烧”产生的; 与
与 的混合烟气可用水吸收制得单质Se,该反应的化学方程式为
的混合烟气可用水吸收制得单质Se,该反应的化学方程式为____________ 。
(2)“滤渣Ⅰ”的主要成分是______ (填化学式);“酸浸氧化”中通入氧气,体现了绿色化学的思想,其目的是____________ 。
(3)“反萃取剂”最好选用______ (填化学式)溶液。
(4)“溶浸”过程中滤渣Ⅱ被 溶液溶解,发生反应的平衡常数为
溶液溶解,发生反应的平衡常数为______ 。
(5)“还原”过程中; 没有参与氧化还原过程,“滤液Ⅳ”中还主要含有
没有参与氧化还原过程,“滤液Ⅳ”中还主要含有 。“还原”过程中氧化剂与还原剂的物质的量之比为
。“还原”过程中氧化剂与还原剂的物质的量之比为______ 。
(6)为减少工艺中试剂用量,“滤液Ⅳ”可返回______ (填工序名称)工序循环使用。
 、
、 等)中回收Se和贵重金属的工艺流程如图所示:
等)中回收Se和贵重金属的工艺流程如图所示:
已知:①该工艺中萃取与反萃取的原理为:
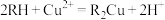 。
。②
 易与
易与 形成配离子:
形成配离子: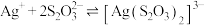 ,上述工艺条件下该反应的平衡常数为
,上述工艺条件下该反应的平衡常数为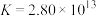 。
。③上述工艺条件下,AgCl的溶度积常数:
 。
。(1)“焙烧”产生的;
 与
与 的混合烟气可用水吸收制得单质Se,该反应的化学方程式为
的混合烟气可用水吸收制得单质Se,该反应的化学方程式为(2)“滤渣Ⅰ”的主要成分是
(3)“反萃取剂”最好选用
(4)“溶浸”过程中滤渣Ⅱ被
 溶液溶解,发生反应的平衡常数为
溶液溶解,发生反应的平衡常数为(5)“还原”过程中;
 没有参与氧化还原过程,“滤液Ⅳ”中还主要含有
没有参与氧化还原过程,“滤液Ⅳ”中还主要含有 。“还原”过程中氧化剂与还原剂的物质的量之比为
。“还原”过程中氧化剂与还原剂的物质的量之比为(6)为减少工艺中试剂用量,“滤液Ⅳ”可返回
您最近一年使用:0次
名校
5 . 部分物质的转化关系如下图所示。下列说法错误的是


| A.X是O2 | B.氧化性Na2FeO4比Z的强 |
| C.反应1中Na2O2只作氧化剂 | D.反应2中每生成1molZ转移2mole- |
您最近一年使用:0次
6 . 二氧化氯(ClO2)是高效、广谱、快速、安全的杀菌消毒剂,被认为是“第四代消毒剂”。电解法是目前最为热门的生产ClO2的方法之一。直接电解氯酸钠(NaClO3)溶液自动催化循环制备高纯ClO2的实验装置示意图如图所示。
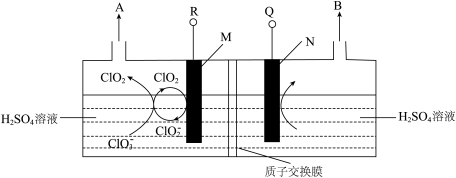
回答下列问题(不考虑H+放电):
(1)亚氯酸根离子( )中氯元素的化合价为
)中氯元素的化合价为________ 价。NaClO3在水中的电离方程式为________________ 。
(2)已知铅酸蓄电池的工作原理为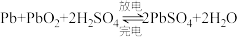
①电解氯酸钠溶液时,M电极上发生________ (填“氧化”或“还原”)反应。
②电解氯酸钠溶液时,若以铅酸蓄电池作为电源,则R应与________ (填“Pb”或“PbO2”)电极相连,N电极上的电极反应式为________________ 。
(3)亚氯酸盐具有较强氧化性。可以用ClO2与H2O2和NaOH溶液反应制备NaClO2,制备时的化学方程式为________ 。反应每消耗2.24 L标准状况下的ClO2气体,可生成气体物质的质量为________ 。若要除去水中超标的亚氯酸盐,下列物质最适宜的是________ (填标号)。
A.明矾 B.氯化钾 C.盐酸 D.硫酸亚铁
(4)由图示信息等,可以判断下列说法错误的是________(填标号)。

回答下列问题(不考虑H+放电):
(1)亚氯酸根离子(
 )中氯元素的化合价为
)中氯元素的化合价为(2)已知铅酸蓄电池的工作原理为
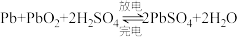
①电解氯酸钠溶液时,M电极上发生
②电解氯酸钠溶液时,若以铅酸蓄电池作为电源,则R应与
(3)亚氯酸盐具有较强氧化性。可以用ClO2与H2O2和NaOH溶液反应制备NaClO2,制备时的化学方程式为
A.明矾 B.氯化钾 C.盐酸 D.硫酸亚铁
(4)由图示信息等,可以判断下列说法错误的是________(填标号)。
| A.氯酸钠与硫酸溶液反应可以产生ClO2 | B. 促进了 促进了 ,转化成为ClO2 ,转化成为ClO2 |
| C.电解进行时,M极的电势高于N极 | D.电解时, 穿过质子交换膜移向M极 穿过质子交换膜移向M极 |
您最近一年使用:0次
7 . 稀土(RE)包括镧、钇等元素,是高科技发展的关键支撑。我国南方特有的稀土矿可用离子交换法处理,一种从该类矿(含铁、铝等元素)中提取稀土的工艺如下:
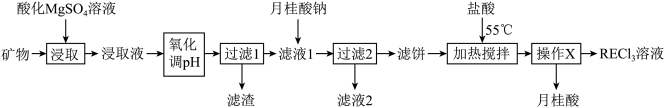
已知:月桂酸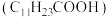 熔点为44℃;月桂酸和
熔点为44℃;月桂酸和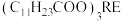 均难溶于水。该工艺条件下,稀土离子保持+3价不变;
均难溶于水。该工艺条件下,稀土离子保持+3价不变;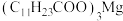 的
的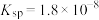 ,
, 开始溶解时的pH为8.8:有关金属离子沉淀的相关pH见下表。
开始溶解时的pH为8.8:有关金属离子沉淀的相关pH见下表。
(1)“氧化调pH”的目的是:_____ 。
(2)“过滤1”前,用NaOH溶液调pH至_____ 的范围内,该过程中发生沉淀反应的离子方程式为_____ 。
(3)“过滤2”后,滤饼中检测不到Mg元素,滤液2中 浓度为
浓度为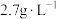 。为尽可能多地提取
。为尽可能多地提取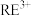 ,可提高月桂酸钠的加入量,但应确保“过滤2”前的溶液中
,可提高月桂酸钠的加入量,但应确保“过滤2”前的溶液中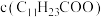 低于
低于_____  (保留两位有效数字)。
(保留两位有效数字)。
(4)①“加热搅拌”有利于加快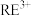 溶出、提高产率,其原因是
溶出、提高产率,其原因是_____ 。
②“操作X”的过程为:_____ 。
(5)稀土元素钇(Y)可用于制备高活性的合金类催化剂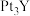 ;还原
;还原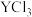 和
和 熔融盐制备
熔融盐制备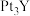 时,生成
时,生成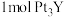 转移
转移_____  电子。
电子。

已知:月桂酸
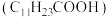 熔点为44℃;月桂酸和
熔点为44℃;月桂酸和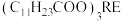 均难溶于水。该工艺条件下,稀土离子保持+3价不变;
均难溶于水。该工艺条件下,稀土离子保持+3价不变;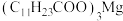 的
的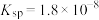 ,
, 开始溶解时的pH为8.8:有关金属离子沉淀的相关pH见下表。
开始溶解时的pH为8.8:有关金属离子沉淀的相关pH见下表。| 离子 |  |  |  | 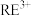 |
| 开始沉淀时的pH | 8.8 | 1.5 | 3.6 | 6.2~7.4 |
| 沉淀完全时的pH | / | 3.2 | 4.7 | / |
(1)“氧化调pH”的目的是:
(2)“过滤1”前,用NaOH溶液调pH至
(3)“过滤2”后,滤饼中检测不到Mg元素,滤液2中
 浓度为
浓度为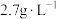 。为尽可能多地提取
。为尽可能多地提取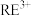 ,可提高月桂酸钠的加入量,但应确保“过滤2”前的溶液中
,可提高月桂酸钠的加入量,但应确保“过滤2”前的溶液中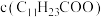 低于
低于 (保留两位有效数字)。
(保留两位有效数字)。(4)①“加热搅拌”有利于加快
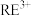 溶出、提高产率,其原因是
溶出、提高产率,其原因是②“操作X”的过程为:
(5)稀土元素钇(Y)可用于制备高活性的合金类催化剂
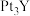 ;还原
;还原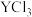 和
和 熔融盐制备
熔融盐制备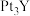 时,生成
时,生成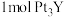 转移
转移 电子。
电子。
您最近一年使用:0次
解题方法
8 . 含氯化合物的应用越来越广泛,请完成下列有关问题:
(1)亚氯酸钠( )是一种漂白织物的漂白剂,具有较强的氧化性。亚氯酸钠中氯元素的化合价为
)是一种漂白织物的漂白剂,具有较强的氧化性。亚氯酸钠中氯元素的化合价为_______ ,其水溶液显碱性的原因为_______ ,其水溶液中离子浓度由大到小的顺序为_______ 。
(2)亚氯酸钠在碱性溶液中稳定,在酸性溶液中生成 和氯元素的另一种稳定离子,写出亚氯酸钠在酸性条件下反应的离子方程式
和氯元素的另一种稳定离子,写出亚氯酸钠在酸性条件下反应的离子方程式_______ 。
(3) 是一种新型安全多功能型杀菌剂,其制备方法有多种,其中一种为
是一种新型安全多功能型杀菌剂,其制备方法有多种,其中一种为 通入
通入 中可得
中可得 ,其氧化剂与还原剂的物质的量之比为
,其氧化剂与还原剂的物质的量之比为_______ 。
(4)一定条件下, 与硫酸酸化的草酸(
与硫酸酸化的草酸( )溶液反应可制备
)溶液反应可制备 ,该反应的离子方程式为
,该反应的离子方程式为_______ 。
(5) 溶液可以用来检验水溶液中的
溶液可以用来检验水溶液中的 或
或 。若向
。若向 悬浊液中加入
悬浊液中加入 溶液,可把
溶液,可把 转化为
转化为 ,已知
,已知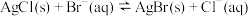 达到平衡时,
达到平衡时, ,已知
,已知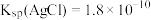 ,则
,则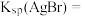
_______ 。(保留两位有效数字,不写单位)
(1)亚氯酸钠(
 )是一种漂白织物的漂白剂,具有较强的氧化性。亚氯酸钠中氯元素的化合价为
)是一种漂白织物的漂白剂,具有较强的氧化性。亚氯酸钠中氯元素的化合价为(2)亚氯酸钠在碱性溶液中稳定,在酸性溶液中生成
 和氯元素的另一种稳定离子,写出亚氯酸钠在酸性条件下反应的离子方程式
和氯元素的另一种稳定离子,写出亚氯酸钠在酸性条件下反应的离子方程式(3)
 是一种新型安全多功能型杀菌剂,其制备方法有多种,其中一种为
是一种新型安全多功能型杀菌剂,其制备方法有多种,其中一种为 通入
通入 中可得
中可得 ,其氧化剂与还原剂的物质的量之比为
,其氧化剂与还原剂的物质的量之比为(4)一定条件下,
 与硫酸酸化的草酸(
与硫酸酸化的草酸( )溶液反应可制备
)溶液反应可制备 ,该反应的离子方程式为
,该反应的离子方程式为(5)
 溶液可以用来检验水溶液中的
溶液可以用来检验水溶液中的 或
或 。若向
。若向 悬浊液中加入
悬浊液中加入 溶液,可把
溶液,可把 转化为
转化为 ,已知
,已知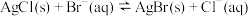 达到平衡时,
达到平衡时, ,已知
,已知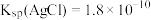 ,则
,则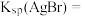
您最近一年使用:0次
9 . 已知: ,
, 晶胞如图所示,晶胞边长为a pm,设
晶胞如图所示,晶胞边长为a pm,设 为阿伏加德罗常数的值。下列叙述错误的是
为阿伏加德罗常数的值。下列叙述错误的是
 ,
, 晶胞如图所示,晶胞边长为a pm,设
晶胞如图所示,晶胞边长为a pm,设 为阿伏加德罗常数的值。下列叙述错误的是
为阿伏加德罗常数的值。下列叙述错误的是
A.该晶胞中含有4个 |
B.离 最近的 最近的 有12个 有12个 |
C.该晶体的密度为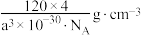 |
D.上述反应中,每生成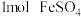 ,转移电子数为 ,转移电子数为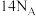 |
您最近一年使用:0次
2024-02-25更新
|
176次组卷
|
2卷引用:吉林省部分名校2023-2024学年高二下学期期中联考化学试题
名校
10 . 利用如下流程可从废光盘中回收金属层中的银(金属层中其他金属含量过低,对实验影响可忽略):
已知: 溶液在加热时易分解生成
溶液在加热时易分解生成 和
和 。下列说法不正确的是
。下列说法不正确的是
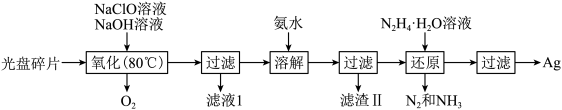
已知:
 溶液在加热时易分解生成
溶液在加热时易分解生成 和
和 。下列说法不正确的是
。下列说法不正确的是
| A.若省略第一次过滤,会使氨水的用量增加 |
B.若“还原”工序利用原电池来实现,则 是正极产物 是正极产物 |
C.“还原”时,每生成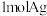 ,理论上消耗 ,理论上消耗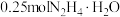 |
D.“溶解”工序发生的反应: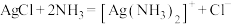 |
您最近一年使用:0次



