名校
1 .  是常见的脱硝剂。某小组探究
是常见的脱硝剂。某小组探究 的氧化还原反应,下列说法不正确的是
的氧化还原反应,下列说法不正确的是
 是常见的脱硝剂。某小组探究
是常见的脱硝剂。某小组探究 的氧化还原反应,下列说法不正确的是
的氧化还原反应,下列说法不正确的是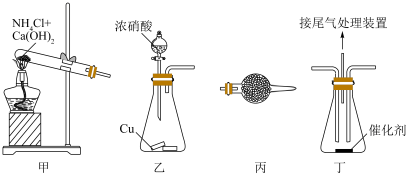
A.用甲装置制备 |
B.乙装置中用于制备 的反应中n(还原剂)∶n(氧化剂)=1∶2 的反应中n(还原剂)∶n(氧化剂)=1∶2 |
C.丙装置填充无水 可用于干燥 可用于干燥 |
D.在丁装置中为了更好地混合反应气体,应先通入 |
您最近一年使用:0次
2 . 与氮元素同主族的磷元素化合物有如下反应,其中反应物有:PH3、H2SO4、KClO3;生成物有:K2SO4、H3PO4、H2O和一种未知物质X。
(1)已知KClO3在反应中得到电子,则该反应的还原剂是___________ ,被氧化的元素是___________ 。
(2)已知0.2mol KClO3在反应中得到1mol电子生成X,则X的化学式为___________ 。
(3)完成并配平上述反应的化学方程式,标出电子转移方向和数目。___________
___________PH3+___________H2SO4+___________KClO3=___________K2SO4+___________H3PO4+___________H2O+___________
(4)根据上述反应可推知___________。
(5)在该反应中转移电子2mol时,生成H3PO4___________ mol。
(1)已知KClO3在反应中得到电子,则该反应的还原剂是
(2)已知0.2mol KClO3在反应中得到1mol电子生成X,则X的化学式为
(3)完成并配平上述反应的化学方程式,标出电子转移方向和数目。
___________PH3+___________H2SO4+___________KClO3=___________K2SO4+___________H3PO4+___________H2O+___________
(4)根据上述反应可推知___________。
| A.氧化性:KClO3 > H3PO4 | B.氧化性:KClO3 > H2O |
| C.还原性:PH3 > X | D.还原性:PH3 > K2SO4 |
您最近一年使用:0次
名校
3 . 我国古代四大发明之一的黑火药是由硫黄粉、硝酸钾和木炭混合而成,爆炸时发生反应: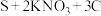
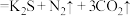 。设
。设 为阿伏加德罗常数,下列说法正确的是
为阿伏加德罗常数,下列说法正确的是
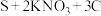
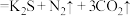 。设
。设 为阿伏加德罗常数,下列说法正确的是
为阿伏加德罗常数,下列说法正确的是A.32g 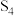 、 、 和 和 的混合物中含有的硫原子为8 的混合物中含有的硫原子为8 |
B.每生成0.1mol  转移 转移 个电子 个电子 |
C.标准状况下,22.4L  含有共用电子对数为4 含有共用电子对数为4 |
D.1L 0.1 的 的 溶液所含氧原子总数为0.3 溶液所含氧原子总数为0.3 |
您最近一年使用:0次
名校
解题方法
4 . 有机化合物A在生产生活中具有重要的价值, 研究其结构及性质具有非常重要的意义。
Ⅰ.测定分子组成
取4.6g有机化合物A在足量氧气中完全燃烧,生成0.3 mol H2O和0.2 mol CO2
(1)该有机化合物的实验式是___________ 。
Ⅱ.确定分子式
该有机化合物的质谱信息如图。___________ 。
Ⅲ.确定结构简式
有机化合物A的核磁共振氢谱有3组峰,峰面积之比为1:2:3。
(3)A的结构简式是___ 。
Ⅳ.解释性质
(4)有机化合物A能与水互溶的原因是A与水形成分子间氢键。在方框中画出1个A分子中两个不同的原子分别与H2O形成的氢键________ (氢键用“…”表示)。
① 酸性条件下,向V mL A溶液中加入 V1 mL c1 mol·L-1 K2Cr2O7溶液。A被氧化为B(B比A少2个氢原子,多1个氧原子),Cr2O 被还原为Cr3+
被还原为Cr3+
② 充分反应后,向①中加入过量KI溶液。
( )
)
③ 向②反应后的溶液中滴加c2 mol·L-1 Na2S2O3溶液,达到滴定终点时,消耗的体积为V2 mL( )。
)。
(5)①中参与反应的A与K2Cr2O7的物质的量之比是___________ 。
(6)结合实验数据,得cA =___________ mol·L-1(用代数式表示)。
Ⅰ.测定分子组成
取4.6g有机化合物A在足量氧气中完全燃烧,生成0.3 mol H2O和0.2 mol CO2
(1)该有机化合物的实验式是
Ⅱ.确定分子式
该有机化合物的质谱信息如图。
Ⅲ.确定结构简式
有机化合物A的核磁共振氢谱有3组峰,峰面积之比为1:2:3。
(3)A的结构简式是
Ⅳ.解释性质
(4)有机化合物A能与水互溶的原因是A与水形成分子间氢键。在方框中画出1个A分子中两个不同的原子分别与H2O形成的氢键

① 酸性条件下,向V mL A溶液中加入 V1 mL c1 mol·L-1 K2Cr2O7溶液。A被氧化为B(B比A少2个氢原子,多1个氧原子),Cr2O
 被还原为Cr3+
被还原为Cr3+② 充分反应后,向①中加入过量KI溶液。
(
 )
)③ 向②反应后的溶液中滴加c2 mol·L-1 Na2S2O3溶液,达到滴定终点时,消耗的体积为V2 mL(
 )。
)。(5)①中参与反应的A与K2Cr2O7的物质的量之比是
(6)结合实验数据,得cA =
您最近一年使用:0次
5 .  和亚氯酸钠
和亚氯酸钠 是广泛使用的漂白剂、消毒剂。高浓度
是广泛使用的漂白剂、消毒剂。高浓度 气体易发生爆炸,在生产时需用其他气体稀释。生产
气体易发生爆炸,在生产时需用其他气体稀释。生产 和
和 的工艺流程:
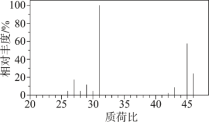
的工艺流程: 发生器中反应为
发生器中反应为 (未配平),下列有关该反应的说法中,不正确的是
(未配平),下列有关该反应的说法中,不正确的是
 和亚氯酸钠
和亚氯酸钠 是广泛使用的漂白剂、消毒剂。高浓度
是广泛使用的漂白剂、消毒剂。高浓度 气体易发生爆炸,在生产时需用其他气体稀释。生产
气体易发生爆炸,在生产时需用其他气体稀释。生产 和
和 的工艺流程:
的工艺流程: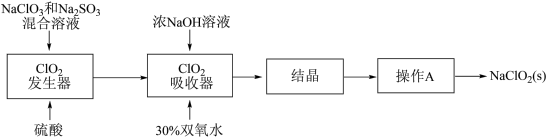
 发生器中反应为
发生器中反应为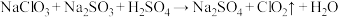 (未配平),下列有关该反应的说法中,不正确的是
(未配平),下列有关该反应的说法中,不正确的是A.反应中 是还原剂 是还原剂 |
B.反应中 是还原产物 是还原产物 |
C.每生成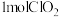 转移 转移 电子 电子 |
D.参加反应的 和 和 的物质的量之比为 的物质的量之比为 |
您最近一年使用:0次
6 . 双氧水常被称为化学反应中的“绿色试剂”。已知,在双氧水中加入少量 溶液,
溶液, 会较快分解,反应如下:
会较快分解,反应如下:
反应①: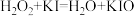 ;
;
反应②: 。
。
回答下列问题:
1.上述反应中属于强电解质的是_____。
2.下列离子在溶液中能大量共存的是_____。
3.标出反应②中的电子转移方向和数目_____ 。

4. 分解过程中,
分解过程中, 的作用是
的作用是_____ 。
5. 是一种二元弱酸,写出第一步电离的电离方程式
是一种二元弱酸,写出第一步电离的电离方程式_____ 。
6.根据反应①和反应②,请说明双氧水被称为“绿色试剂”的主要原因是_____ 。
7.油画变黑,可用一定浓度的 溶液擦洗修复,发生的反应为
溶液擦洗修复,发生的反应为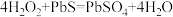 ,下列说法正确的是_____。
,下列说法正确的是_____。
8.向 溶液中通入
溶液中通入 碘单质恰好完全反应生成三种含碘盐:
碘单质恰好完全反应生成三种含碘盐: 和X。则X是_____。
和X。则X是_____。
 溶液,
溶液, 会较快分解,反应如下:
会较快分解,反应如下:反应①:
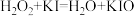 ;
;反应②:
 。
。回答下列问题:
1.上述反应中属于强电解质的是_____。
A. | B. | C.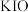 | D. |
A.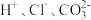 | B.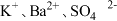 |
C. | D.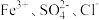 |

4.
 分解过程中,
分解过程中, 的作用是
的作用是5.
 是一种二元弱酸,写出第一步电离的电离方程式
是一种二元弱酸,写出第一步电离的电离方程式6.根据反应①和反应②,请说明双氧水被称为“绿色试剂”的主要原因是
7.油画变黑,可用一定浓度的
 溶液擦洗修复,发生的反应为
溶液擦洗修复,发生的反应为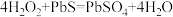 ,下列说法正确的是_____。
,下列说法正确的是_____。A. 是氧化产物 是氧化产物 | B. 被还原 被还原 |
C. 是氧化剂 是氧化剂 | D. 体现还原性 体现还原性 |
 溶液中通入
溶液中通入 碘单质恰好完全反应生成三种含碘盐:
碘单质恰好完全反应生成三种含碘盐: 和X。则X是_____。
和X。则X是_____。A.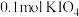 | B.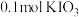 | C.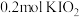 | D.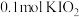 |
您最近一年使用:0次
名校
7 . 将 铜投入
铜投入 一定浓度的硝酸中发生反应,铜完全溶解,产生的NO和
一定浓度的硝酸中发生反应,铜完全溶解,产生的NO和 混合气体在标准状况下的体积为
混合气体在标准状况下的体积为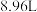 (反应前后溶液体积不变,也不考虑
(反应前后溶液体积不变,也不考虑 的存在)。待产生的气体完全释放后,向溶液中加入
的存在)。待产生的气体完全释放后,向溶液中加入 的
的 溶液
溶液 ,恰好使溶液中的
,恰好使溶液中的 全部转化为沉淀。下列说法错误的是
全部转化为沉淀。下列说法错误的是
 铜投入
铜投入 一定浓度的硝酸中发生反应,铜完全溶解,产生的NO和
一定浓度的硝酸中发生反应,铜完全溶解,产生的NO和 混合气体在标准状况下的体积为
混合气体在标准状况下的体积为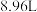 (反应前后溶液体积不变,也不考虑
(反应前后溶液体积不变,也不考虑 的存在)。待产生的气体完全释放后,向溶液中加入
的存在)。待产生的气体完全释放后,向溶液中加入 的
的 溶液
溶液 ,恰好使溶液中的
,恰好使溶液中的 全部转化为沉淀。下列说法错误的是
全部转化为沉淀。下列说法错误的是| A.铜与硝酸的反应中,硝酸表现酸性和强氧化性 |
B.产生的混合气体 和 和 的体积比 的体积比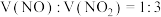 |
C.原硝酸溶液的浓度为 |
D.欲使生成的 和 和 在 在 作用下被水吸收全部转化为硝酸,至少需标准状况下 作用下被水吸收全部转化为硝酸,至少需标准状况下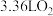 |
您最近一年使用:0次
8 . 在材料科学的广阔领域中,靶材扮演着一个关键角色。镍铂靶主要用于半导体行业中的二极管和超大规模集成电路镀膜。现利用镍铂靶材废料(主要成分为Ni、Pt以及微量Fe、Al的单质)采用选择性溶解法回收铂并制备硫酸镍晶体的一种工艺流程如下:
①溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
②王水是按浓盐酸和浓硝酸的体积比为3∶1配制而成;
③六水合硫酸镍( )在280℃时失去结晶水生成黄绿色无水物,当温度更高开始分解,释放出三氧化硫,变成氧化镍。
)在280℃时失去结晶水生成黄绿色无水物,当温度更高开始分解,释放出三氧化硫,变成氧化镍。
④室温: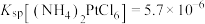 ;
;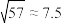
(1)铂在王水中生成二元强酸 ,该反应的离子方程式为
,该反应的离子方程式为___________ 。
(2)滤液①中金属阳离子有___________ ,调pH过程中,若 为0.01mol/L,则pH的控制范围为
为0.01mol/L,则pH的控制范围为___________ 。
(3)在“沉铂”过程中,若向 的溶液里加入等体积的
的溶液里加入等体积的 溶液,恰好使
溶液,恰好使 沉淀完全,则加入
沉淀完全,则加入 溶液的浓度为
溶液的浓度为___________ mol/L(结果保留两位小数,忽略溶液混合后体积的变化)。
(4)沉铂过程中, 的沉淀率随温度的升高而增大,结合平衡移动原理解释
的沉淀率随温度的升高而增大,结合平衡移动原理解释 沉淀率随温度变化的主要原因
沉淀率随温度变化的主要原因___________ 。
(5)隔绝空气锻烧 时有两种单质生成,分别是Pt和
时有两种单质生成,分别是Pt和 ,当制得金属铂58.5g时,理论上可收集到
,当制得金属铂58.5g时,理论上可收集到
___________ L(标准状况)。
(6)通过对滤液控制pH浓缩结晶得到 晶体,而不是蒸发结晶的原因是
晶体,而不是蒸发结晶的原因是___________ 。
①溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 |  |  |  |  |
| 开始沉淀时(c=0.01mol/L)的pH | 7.2 | 3.7 | 2.2 | 7.5 |
沉淀完全时(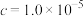 mol/L)的pH mol/L)的pH | 8.7 | 4.7 | 3.2 | 9.0 |
③六水合硫酸镍(
 )在280℃时失去结晶水生成黄绿色无水物,当温度更高开始分解,释放出三氧化硫,变成氧化镍。
)在280℃时失去结晶水生成黄绿色无水物,当温度更高开始分解,释放出三氧化硫,变成氧化镍。④室温:
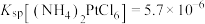 ;
;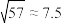
(1)铂在王水中生成二元强酸
 ,该反应的离子方程式为
,该反应的离子方程式为(2)滤液①中金属阳离子有
 为0.01mol/L,则pH的控制范围为
为0.01mol/L,则pH的控制范围为(3)在“沉铂”过程中,若向
 的溶液里加入等体积的
的溶液里加入等体积的 溶液,恰好使
溶液,恰好使 沉淀完全,则加入
沉淀完全,则加入 溶液的浓度为
溶液的浓度为(4)沉铂过程中,
 的沉淀率随温度的升高而增大,结合平衡移动原理解释
的沉淀率随温度的升高而增大,结合平衡移动原理解释 沉淀率随温度变化的主要原因
沉淀率随温度变化的主要原因(5)隔绝空气锻烧
 时有两种单质生成,分别是Pt和
时有两种单质生成,分别是Pt和 ,当制得金属铂58.5g时,理论上可收集到
,当制得金属铂58.5g时,理论上可收集到
(6)通过对滤液控制pH浓缩结晶得到
 晶体,而不是蒸发结晶的原因是
晶体,而不是蒸发结晶的原因是
您最近一年使用:0次
名校
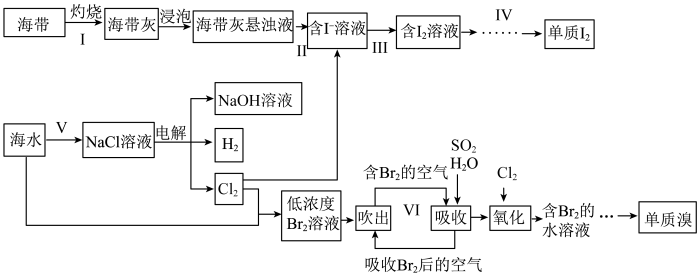
9 . 海洋是一座资源的宝库,下图是利用海洋资源生产卤素单质的工艺流程。
(1)实验室灼烧海带时使用的仪器有_______ 、泥三角、三脚架、酒精灯等,步骤Ⅱ的操作名称为_______ 。
(2)步骤Ⅲ中需要严格控制Cl2的用量,原因是_______ 。
(3)若步骤Ⅲ加H2O2的酸性溶液氧化I-,则其离子方程式为_______ 。
(4)步骤Ⅴ中,从海水提取的粗盐中主要含 、
、 、
、 等杂质离子,除去这些离子可加入的试剂有①盐酸②BaCl2溶液③Na2CO3溶液④NaOH溶液,加入试剂的正确顺序为
等杂质离子,除去这些离子可加入的试剂有①盐酸②BaCl2溶液③Na2CO3溶液④NaOH溶液,加入试剂的正确顺序为_______ (填标号)。
a.①②③④ b.②③④① c.③②④① d.②④③①
(5)步骤Ⅵ中,用SO2吸收Br2的离子方程式为_______ 。
(6)提取Br2的流程中,两次通入Cl2的目的是富集浓缩溴。若最终获得240gBr2,理论上需消耗标准状况下Cl2的体积为_______ 。

(1)实验室灼烧海带时使用的仪器有
(2)步骤Ⅲ中需要严格控制Cl2的用量,原因是
(3)若步骤Ⅲ加H2O2的酸性溶液氧化I-,则其离子方程式为
(4)步骤Ⅴ中,从海水提取的粗盐中主要含
 、
、 、
、 等杂质离子,除去这些离子可加入的试剂有①盐酸②BaCl2溶液③Na2CO3溶液④NaOH溶液,加入试剂的正确顺序为
等杂质离子,除去这些离子可加入的试剂有①盐酸②BaCl2溶液③Na2CO3溶液④NaOH溶液,加入试剂的正确顺序为a.①②③④ b.②③④① c.③②④① d.②④③①
(5)步骤Ⅵ中,用SO2吸收Br2的离子方程式为
(6)提取Br2的流程中,两次通入Cl2的目的是富集浓缩溴。若最终获得240gBr2,理论上需消耗标准状况下Cl2的体积为
您最近一年使用:0次
名校
10 . 环境保护与绿色发展是新时代人们关心的共同话题。NO、 是大气主要污染物,因此对工业烟气(主要成分为
是大气主要污染物,因此对工业烟气(主要成分为 ,
, 、
、 )脱硝是工业生产中的重要一环。脱除的方法有多种,比较常见的有水吸收法、酸吸收法、碱吸收法、氧化吸收法、还原吸收法和综合吸收法等。
)脱硝是工业生产中的重要一环。脱除的方法有多种,比较常见的有水吸收法、酸吸收法、碱吸收法、氧化吸收法、还原吸收法和综合吸收法等。
(1)碱液吸收:NaOH溶液可吸收工业烟气,获得副产品 。
。
①等物质的量的NO与 被NaOH溶液吸收,反应的离子方程式为
被NaOH溶液吸收,反应的离子方程式为____________ 。
②若吸收时NO与 的比例控制不当,则吸收液经浓缩结晶、过滤得到的
的比例控制不当,则吸收液经浓缩结晶、过滤得到的 晶体中最有可能混有的杂质是
晶体中最有可能混有的杂质是______ (填化学式)。
(2)目前常见方法是采用酸化处理的NaClO溶液液相氧化法脱除烟气中的 ,其主要过程如下:
,其主要过程如下:
Ⅰ.
 kJ/mol
kJ/mol
Ⅱ.
 kJ/mol
kJ/mol
①写出 转化为
转化为 的热化学方程式:
的热化学方程式:____________ 。
②研究不同温度下对NO脱除率的影响,结果如图所示。在60~80℃时,NO脱除率下降的原因是______ 。
(3)氨气催化吸收处理尾气法:已知6mol氨气恰好能将含NO和 共7mol的混合气体完全转化为
共7mol的混合气体完全转化为 ,则混合气体中NO和
,则混合气体中NO和 的物质的量之比为
的物质的量之比为______ 。
方法1:直接使用尿素 溶液吸收烟气中的
溶液吸收烟气中的 。
。
方法2:先用合适的氧化剂将 中的NO氧化为
中的NO氧化为 ,再用
,再用 溶液还原吸收。
溶液还原吸收。
还原吸收等量的 ,消耗尿素较少的是
,消耗尿素较少的是______ (填“方法1”或“方法2”)。工业上选择方法2处理 的原因是
的原因是____________ 。
 是大气主要污染物,因此对工业烟气(主要成分为
是大气主要污染物,因此对工业烟气(主要成分为 ,
, 、
、 )脱硝是工业生产中的重要一环。脱除的方法有多种,比较常见的有水吸收法、酸吸收法、碱吸收法、氧化吸收法、还原吸收法和综合吸收法等。
)脱硝是工业生产中的重要一环。脱除的方法有多种,比较常见的有水吸收法、酸吸收法、碱吸收法、氧化吸收法、还原吸收法和综合吸收法等。(1)碱液吸收:NaOH溶液可吸收工业烟气,获得副产品
 。
。①等物质的量的NO与
 被NaOH溶液吸收,反应的离子方程式为
被NaOH溶液吸收,反应的离子方程式为②若吸收时NO与
 的比例控制不当,则吸收液经浓缩结晶、过滤得到的
的比例控制不当,则吸收液经浓缩结晶、过滤得到的 晶体中最有可能混有的杂质是
晶体中最有可能混有的杂质是(2)目前常见方法是采用酸化处理的NaClO溶液液相氧化法脱除烟气中的
 ,其主要过程如下:
,其主要过程如下:Ⅰ.

 kJ/mol
kJ/molⅡ.

 kJ/mol
kJ/mol①写出
 转化为
转化为 的热化学方程式:
的热化学方程式:②研究不同温度下对NO脱除率的影响,结果如图所示。在60~80℃时,NO脱除率下降的原因是
(3)氨气催化吸收处理尾气法:已知6mol氨气恰好能将含NO和
 共7mol的混合气体完全转化为
共7mol的混合气体完全转化为 ,则混合气体中NO和
,则混合气体中NO和 的物质的量之比为
的物质的量之比为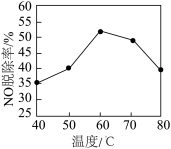
方法1:直接使用尿素
 溶液吸收烟气中的
溶液吸收烟气中的 。
。方法2:先用合适的氧化剂将
 中的NO氧化为
中的NO氧化为 ,再用
,再用 溶液还原吸收。
溶液还原吸收。还原吸收等量的
 ,消耗尿素较少的是
,消耗尿素较少的是 的原因是
的原因是
您最近一年使用:0次



