1 . 回答下列问题:
(1)①H2+CuO Cu+H2O②CaCO3+2HCl=CaCl2+CO2↑+H2O③3S+6NaOH
Cu+H2O②CaCO3+2HCl=CaCl2+CO2↑+H2O③3S+6NaOH 2Na2S+Na2SO3+3H2O④Cu2O+4HCl=2HCuCl2+H2O,上述反应中,属于氧化还原反应的有
2Na2S+Na2SO3+3H2O④Cu2O+4HCl=2HCuCl2+H2O,上述反应中,属于氧化还原反应的有______ (填序号)。
(2)用双线桥法表示下述反应的电子转移的方向和数目______ 。
MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
(3)在反应KClO3+6HCl=3Cl2+KCl+3H2O中,氧化剂与还原剂的系数之比为______ 。
(4)配平下面两个反应:
____H2O+____Cl2+____SO2=____H2SO4+____HCl,(系数是1的也请填上)______ 。
____KMnO4+____HCl=____KCl+____MnCl2+____Cl2↑+____H2O(系数是1的也请填上)______ 。
根据以上两个反应反应,写出由KMnO4、K2SO4、MnSO4、SO2、H2O、H2SO4这六种物质组成的氧化还原反应的方程式并配平。______ 。
(1)①H2+CuO
 Cu+H2O②CaCO3+2HCl=CaCl2+CO2↑+H2O③3S+6NaOH
Cu+H2O②CaCO3+2HCl=CaCl2+CO2↑+H2O③3S+6NaOH 2Na2S+Na2SO3+3H2O④Cu2O+4HCl=2HCuCl2+H2O,上述反应中,属于氧化还原反应的有
2Na2S+Na2SO3+3H2O④Cu2O+4HCl=2HCuCl2+H2O,上述反应中,属于氧化还原反应的有(2)用双线桥法表示下述反应的电子转移的方向和数目
MnO2+4HCl(浓)
 MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。(3)在反应KClO3+6HCl=3Cl2+KCl+3H2O中,氧化剂与还原剂的系数之比为
(4)配平下面两个反应:
____H2O+____Cl2+____SO2=____H2SO4+____HCl,(系数是1的也请填上)
____KMnO4+____HCl=____KCl+____MnCl2+____Cl2↑+____H2O(系数是1的也请填上)
根据以上两个反应反应,写出由KMnO4、K2SO4、MnSO4、SO2、H2O、H2SO4这六种物质组成的氧化还原反应的方程式并配平。
您最近一年使用:0次
2 . 氧化还原反应原理及物质的量的相关计算在生产、生活中应用广泛。
(1)某同学写出以下化学反应方程式(未配平):①NH3+NO→HNO2+H2O,②NO+HNO3→N2O3+H2O,③N2O4+H2O→HNO2+HNO3,其中一定不可能实现的是(填序号)_______ 。
(2)ClO2可用于污水的杀菌和饮用水的净化。KClO3与SO2在强酸性溶液中反应可制得ClO2,SO2被氧化为 ,此反应的离子方程式为
,此反应的离子方程式为_______ 。
(3)已知亚硝酸钠(NaNO2)可以与氯化铵(NH4Cl)反应生成氮气、氯化钠及其它产物,写出该反应的化学反应方程式_______ 。
(4)一定条件下,当溶液中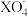 与H2O2物质的量比恰好为2:5时,溶液中
与H2O2物质的量比恰好为2:5时,溶液中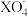 离子被还原为较低价态,则X元素的化合价变为
离子被还原为较低价态,则X元素的化合价变为_______ 。
(5)将不纯的NaOH样品2g(含少量Na2CO3和水),放入50mL2mol/L的盐酸中,充分反应后,溶液呈酸性,中和剩余的酸又用去40mLlmol/L的NaOH溶液。蒸发中和后的溶液,最终得到固体的质量为_______ 。
(6)臭氧层是地球生命的保护神,臭氧比氧气具有更强的氧化性。实验室可将氧气通过高压,放电管来制取臭氧:
①在臭氧发生装置中装入氧气100mL,经反应最后气体体积变为95mL(体积均在标准状况下测定),则混合气体的密度是_______ g/L(保留一位小数);
②实验室将氧气和臭氧的混合气体0.896L(标准状况),通入盛有20.0g铜粉的反应容器中,充分加热后,粉末的质量最终变为21.6g。则原混合气中臭氧的体积分数_______ 。
(1)某同学写出以下化学反应方程式(未配平):①NH3+NO→HNO2+H2O,②NO+HNO3→N2O3+H2O,③N2O4+H2O→HNO2+HNO3,其中一定不可能实现的是(填序号)
(2)ClO2可用于污水的杀菌和饮用水的净化。KClO3与SO2在强酸性溶液中反应可制得ClO2,SO2被氧化为
 ,此反应的离子方程式为
,此反应的离子方程式为(3)已知亚硝酸钠(NaNO2)可以与氯化铵(NH4Cl)反应生成氮气、氯化钠及其它产物,写出该反应的化学反应方程式
(4)一定条件下,当溶液中
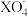 与H2O2物质的量比恰好为2:5时,溶液中
与H2O2物质的量比恰好为2:5时,溶液中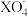 离子被还原为较低价态,则X元素的化合价变为
离子被还原为较低价态,则X元素的化合价变为(5)将不纯的NaOH样品2g(含少量Na2CO3和水),放入50mL2mol/L的盐酸中,充分反应后,溶液呈酸性,中和剩余的酸又用去40mLlmol/L的NaOH溶液。蒸发中和后的溶液,最终得到固体的质量为
(6)臭氧层是地球生命的保护神,臭氧比氧气具有更强的氧化性。实验室可将氧气通过高压,放电管来制取臭氧:
①在臭氧发生装置中装入氧气100mL,经反应最后气体体积变为95mL(体积均在标准状况下测定),则混合气体的密度是
②实验室将氧气和臭氧的混合气体0.896L(标准状况),通入盛有20.0g铜粉的反应容器中,充分加热后,粉末的质量最终变为21.6g。则原混合气中臭氧的体积分数
您最近一年使用:0次
名校
解题方法
3 . 按要求填空:
情境一:在酸性条件下,黄铁矿(FeS2,其中S为-1价)催化氧化的反应转化如图所示。
总反应:2FeS2+7O2+2H2O=2Fe2++4 +4H+
+4H+

(1)已知Ⅲ为非氧化还原反应,分别写出反应Ⅰ、Ⅱ的离子方程式:
①反应Ⅰ:___________ 。
②反应Ⅱ:___________ 。
(2)NO在总反应中的作用是___________ 。
情境二:高纯度LiMn2O4(Li元素的化合价为+1价,O元素的化合价为-2价)是锂电池重要的正极材料。
(3)工业上有一种制取高纯度LiMn2O4的方法如下:
①由硫酸锰与K2S2O8溶液常温下混合一周,慢慢得到球形二氧化锰(MnO2)、硫酸钾和硫酸,发生反应的化学方程式为:___________ 。
②过滤、干燥得到球形二氧化锰,再与氢氧化锂750℃共热5小时得到LiMn2O4、H2O和一种气体。请写出该反应的化学方程式:___________ 。
(4)氢氧化锂容易与二氧化碳反应,工业上常用碳酸锂代替。把分析纯碳酸锂与球形二氧化锰两种粉末,按个数比1:4混合均匀加热。
①升温到515℃时,开始有CO2产生,同时生成固体Li2O。
②升温到566℃时,MnO2分解产生O2,O2的个数恰好与CO2的个数相等,同时得到固体X,固体X的化学式是___________ 。
③升温到720℃时,Li2O、X参加反应,固体质量逐渐增加,当质量不再增加时,得到高纯度的LiMn2O4.,该反应中氧化剂是___________ 。
情境一:在酸性条件下,黄铁矿(FeS2,其中S为-1价)催化氧化的反应转化如图所示。
总反应:2FeS2+7O2+2H2O=2Fe2++4
 +4H+
+4H+
(1)已知Ⅲ为非氧化还原反应,分别写出反应Ⅰ、Ⅱ的离子方程式:
①反应Ⅰ:
②反应Ⅱ:
(2)NO在总反应中的作用是
情境二:高纯度LiMn2O4(Li元素的化合价为+1价,O元素的化合价为-2价)是锂电池重要的正极材料。
(3)工业上有一种制取高纯度LiMn2O4的方法如下:
①由硫酸锰与K2S2O8溶液常温下混合一周,慢慢得到球形二氧化锰(MnO2)、硫酸钾和硫酸,发生反应的化学方程式为:
②过滤、干燥得到球形二氧化锰,再与氢氧化锂750℃共热5小时得到LiMn2O4、H2O和一种气体。请写出该反应的化学方程式:
(4)氢氧化锂容易与二氧化碳反应,工业上常用碳酸锂代替。把分析纯碳酸锂与球形二氧化锰两种粉末,按个数比1:4混合均匀加热。
①升温到515℃时,开始有CO2产生,同时生成固体Li2O。
②升温到566℃时,MnO2分解产生O2,O2的个数恰好与CO2的个数相等,同时得到固体X,固体X的化学式是
③升温到720℃时,Li2O、X参加反应,固体质量逐渐增加,当质量不再增加时,得到高纯度的LiMn2O4.,该反应中氧化剂是
您最近一年使用:0次
2023-11-04更新
|
291次组卷
|
2卷引用:湖北省荆州市沙市中学2023-2024学年高一上学期11月期中考试化学试题
名校
解题方法
4 . 移取20.00 两种一元弱酸
两种一元弱酸 和
和 的混合溶液,滴加0.1
的混合溶液,滴加0.1 的
的 至反应终点,消耗25
至反应终点,消耗25 。再取相同的上述溶液,加入50
。再取相同的上述溶液,加入50 ,0.02
,0.02
 的强碱性溶液,待其反应完成后,将溶液酸化,加入30
的强碱性溶液,待其反应完成后,将溶液酸化,加入30 0.2
0.2
 溶液,将剩余的
溶液,将剩余的 和
和 歧化生成的
歧化生成的 和
和 全部还原至
全部还原至 ,剩余的
,剩余的 溶液用上述
溶液用上述 溶液在酸性条件下反应至终点消耗18.5
溶液在酸性条件下反应至终点消耗18.5 。
。
已知:
① 在强碱性条件下还原产物为
在强碱性条件下还原产物为 ;
; 在酸性条件发生歧化反应;
在酸性条件发生歧化反应;
② 具有还原性,酸性条件下被氧化为
具有还原性,酸性条件下被氧化为 ,
, 不能被酸性高锰酸钾氧化
不能被酸性高锰酸钾氧化
(1)加入 的强碱性溶液发生的有电子转移的离子反应方程式为
的强碱性溶液发生的有电子转移的离子反应方程式为_______ 。
(2)酸化后 歧化发生离子反应方程式为
歧化发生离子反应方程式为_______ 。
(3)加入 溶液后发生反应的离子方程式为
溶液后发生反应的离子方程式为_______ 。
(4)则溶液中的 的浓度为
的浓度为_______ ; 的浓度为
的浓度为_______ 。
(5)若溶液酸化后将 过滤除掉,其它操作不变,则测得的
过滤除掉,其它操作不变,则测得的 浓度将
浓度将_______ (填“偏大”、“偏小”或“不变”)。
 两种一元弱酸
两种一元弱酸 和
和 的混合溶液,滴加0.1
的混合溶液,滴加0.1 的
的 至反应终点,消耗25
至反应终点,消耗25 。再取相同的上述溶液,加入50
。再取相同的上述溶液,加入50 ,0.02
,0.02
 的强碱性溶液,待其反应完成后,将溶液酸化,加入30
的强碱性溶液,待其反应完成后,将溶液酸化,加入30 0.2
0.2
 溶液,将剩余的
溶液,将剩余的 和
和 歧化生成的
歧化生成的 和
和 全部还原至
全部还原至 ,剩余的
,剩余的 溶液用上述
溶液用上述 溶液在酸性条件下反应至终点消耗18.5
溶液在酸性条件下反应至终点消耗18.5 。
。已知:
①
 在强碱性条件下还原产物为
在强碱性条件下还原产物为 ;
; 在酸性条件发生歧化反应;
在酸性条件发生歧化反应;②
 具有还原性,酸性条件下被氧化为
具有还原性,酸性条件下被氧化为 ,
, 不能被酸性高锰酸钾氧化
不能被酸性高锰酸钾氧化(1)加入
 的强碱性溶液发生的有电子转移的离子反应方程式为
的强碱性溶液发生的有电子转移的离子反应方程式为(2)酸化后
 歧化发生离子反应方程式为
歧化发生离子反应方程式为(3)加入
 溶液后发生反应的离子方程式为
溶液后发生反应的离子方程式为(4)则溶液中的
 的浓度为
的浓度为 的浓度为
的浓度为(5)若溶液酸化后将
 过滤除掉,其它操作不变,则测得的
过滤除掉,其它操作不变,则测得的 浓度将
浓度将
您最近一年使用:0次
名校
解题方法
5 . 按要求回答问题。
(1)NaH能与水剧烈反应生成氢气,生成的 标准状况下体积为2.24L时,转移电子的数目
标准状况下体积为2.24L时,转移电子的数目___________ 。
(2)AlN用于电子仪器。AlN中常混有少量碳,将一定量含杂质碳的AlN样品置于密闭反应器中,通入0.18mol的 ,在高温下充分反应后测得气体的密度为
,在高温下充分反应后测得气体的密度为 (已折算成标准状况,AlN不跟
(已折算成标准状况,AlN不跟 反应),则所得气体的摩尔质量为
反应),则所得气体的摩尔质量为___________  ,该样品中含杂质碳
,该样品中含杂质碳___________ g。
(3)取x g铜镁合金完全溶于10mol/L100mL的浓硝酸中,反应过程中硝酸被还原产生6720mL的 气体和896mL的
气体和896mL的 气体(都已折算到标准状态),在反应后的溶液中加入1mol/L氢氧化钠溶液,生成沉淀质量为18.80g,则x等于
气体(都已折算到标准状态),在反应后的溶液中加入1mol/L氢氧化钠溶液,生成沉淀质量为18.80g,则x等于___________ g,消耗NaOH溶液的体积是___________ mL。
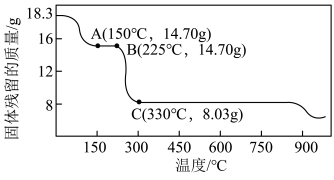
(4)钴及其化合物广泛应用于磁性材料、电池材料及超硬材料等领域。草酸钴是制备钴的氧化物的重要原料,如图为二水合草酸钴( )(M=183g/mol)在空气中受热的质量变化曲线,曲线中300℃及以上所得固体均为钴氧化物,通过计算确定B点剩余固体的化学成分为
)(M=183g/mol)在空气中受热的质量变化曲线,曲线中300℃及以上所得固体均为钴氧化物,通过计算确定B点剩余固体的化学成分为___________ (填化学式),取C点固体用足量的浓盐酸完全溶解可得到黄绿色气体,写出以上反应的离子反应方程式___________ 。
(1)NaH能与水剧烈反应生成氢气,生成的
 标准状况下体积为2.24L时,转移电子的数目
标准状况下体积为2.24L时,转移电子的数目(2)AlN用于电子仪器。AlN中常混有少量碳,将一定量含杂质碳的AlN样品置于密闭反应器中,通入0.18mol的
 ,在高温下充分反应后测得气体的密度为
,在高温下充分反应后测得气体的密度为 (已折算成标准状况,AlN不跟
(已折算成标准状况,AlN不跟 反应),则所得气体的摩尔质量为
反应),则所得气体的摩尔质量为 ,该样品中含杂质碳
,该样品中含杂质碳(3)取x g铜镁合金完全溶于10mol/L100mL的浓硝酸中,反应过程中硝酸被还原产生6720mL的
 气体和896mL的
气体和896mL的 气体(都已折算到标准状态),在反应后的溶液中加入1mol/L氢氧化钠溶液,生成沉淀质量为18.80g,则x等于
气体(都已折算到标准状态),在反应后的溶液中加入1mol/L氢氧化钠溶液,生成沉淀质量为18.80g,则x等于(4)钴及其化合物广泛应用于磁性材料、电池材料及超硬材料等领域。草酸钴是制备钴的氧化物的重要原料,如图为二水合草酸钴(
 )(M=183g/mol)在空气中受热的质量变化曲线,曲线中300℃及以上所得固体均为钴氧化物,通过计算确定B点剩余固体的化学成分为
)(M=183g/mol)在空气中受热的质量变化曲线,曲线中300℃及以上所得固体均为钴氧化物,通过计算确定B点剩余固体的化学成分为
您最近一年使用:0次
名校
解题方法
6 . 在标准状况下,将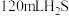 和
和 的混合气体点燃,若原混合气体中
的混合气体点燃,若原混合气体中 为
为 ,反应后得到的气体总体积为
,反应后得到的气体总体积为 ,求:
,求:
(1)当x在不同范围内时,y与x的函数关系是___________ 。
(2)当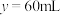 时,原气体中
时,原气体中 可能是
可能是___________ 。
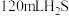 和
和 的混合气体点燃,若原混合气体中
的混合气体点燃,若原混合气体中 为
为 ,反应后得到的气体总体积为
,反应后得到的气体总体积为 ,求:
,求:(1)当x在不同范围内时,y与x的函数关系是
(2)当
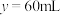 时,原气体中
时,原气体中 可能是
可能是
您最近一年使用:0次
名校
解题方法
7 . 将3.2g铜溶于 过量的硝酸溶液中,假设硝酸的还原产物只有
过量的硝酸溶液中,假设硝酸的还原产物只有 和NO。反应结束后,将所得的溶液加水稀释至1L,测得
和NO。反应结束后,将所得的溶液加水稀释至1L,测得 。
。
(1)求稀释以后溶液中 的物质的量浓度
的物质的量浓度___________
(2)列式计算生成的气体中NO物质的量___________ (可用含有B的表达式表示)
 过量的硝酸溶液中,假设硝酸的还原产物只有
过量的硝酸溶液中,假设硝酸的还原产物只有 和NO。反应结束后,将所得的溶液加水稀释至1L,测得
和NO。反应结束后,将所得的溶液加水稀释至1L,测得 。
。(1)求稀释以后溶液中
 的物质的量浓度
的物质的量浓度(2)列式计算生成的气体中NO物质的量
您最近一年使用:0次
2023高一下·浙江·期中
解题方法
8 . 向27.2 gCu和Cu2O的混合物中加入某浓度稀硝酸0.5 L,固体完全反应,生成NO和Cu(NO3)2,在所得溶液中加入1.0 mol/L的NaOH溶液1.0L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为39.2g。请回答:
(1)原固体温合物中Cu与Cu2O物质的量之比为___________ 。
(2)硝酸的物质的量浓度为___________ mol/L。
(1)原固体温合物中Cu与Cu2O物质的量之比为
(2)硝酸的物质的量浓度为
您最近一年使用:0次
2023高三·全国·专题练习
解题方法
9 . 铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成的两种气体均由表中所示两种元素组成,气体的相对分子质量都小于50,为防止污染,将产生的气体完全转化为最高价含氧酸盐,消耗 溶液和
溶液和 ,则两种气体的分子式及物质的量分别为
,则两种气体的分子式及物质的量分别为_______ ,生成的硫酸铜的物质的量为_______ 。
 溶液和
溶液和 ,则两种气体的分子式及物质的量分别为
,则两种气体的分子式及物质的量分别为| 碳 | 氮 | 氧 | |
| 硅 | 硫 | 氯 |
您最近一年使用:0次
名校
解题方法
10 . 一定量氢气在氯气中燃烧,所得混合物用100 mL3. 00 mol/L的NaOH溶液恰好完全吸收,检测到反应后溶液中有NaCl、NaClO和NaClO3。测得溶液中含有NaCl的物质的量0.250 mol,NaClO的物质的量为0.0300 mol。
(1)所得溶液中NaClO3的物质的量为_______ 。
(2)所得混合物中氯气与NaOH溶液反应的总离子方程式_______ 。
(3)所用氯气和参加反应的氢气的物质的量之比n(Cl2) : n(H2) =_______ 。
(1)所得溶液中NaClO3的物质的量为
(2)所得混合物中氯气与NaOH溶液反应的总离子方程式
(3)所用氯气和参加反应的氢气的物质的量之比n(Cl2) : n(H2) =
您最近一年使用:0次



