名校
解题方法
1 . 氮的氧化物( )是大气污染物之一,含有氮氧化物的尾气需处理后才能排放。回答下列问题:
)是大气污染物之一,含有氮氧化物的尾气需处理后才能排放。回答下列问题:
(1)工业上在一定温度和催化剂条件下用 将
将 还原生成
还原生成 。
。
①如果选择图中A作为氨气的发生装置,对应反应的化学方程式为:_______ 。_______ :a→d→c→_______→_______→d→c→i。(按气流方向,用小写字母表示),F中倒置漏斗的作用是_______ 。
③若用通式 表示氮氧化物,则
表示氮氧化物,则_______ mol氨气(用含x表示)可将1mol的 转化为
转化为 。
。
(2)NO和 可用NaOH溶液吸收,主要反应:
可用NaOH溶液吸收,主要反应: ,
,

①下列措施能提高尾气中NO和 去除率的有
去除率的有_______ (填标号)。
A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量NaOH溶液
②将NO、 通入石灰乳中可制备重要的工业原料
通入石灰乳中可制备重要的工业原料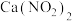 。该工艺需控制NO和
。该工艺需控制NO和 物质的量之比接近1:1,每生成
物质的量之比接近1:1,每生成 ,该反应转移的电子数为
,该反应转移的电子数为_______ (NA表示阿伏伽德罗常数)。若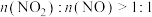 ,则会导致
,则会导致_______ 。
 )是大气污染物之一,含有氮氧化物的尾气需处理后才能排放。回答下列问题:
)是大气污染物之一,含有氮氧化物的尾气需处理后才能排放。回答下列问题:(1)工业上在一定温度和催化剂条件下用
 将
将 还原生成
还原生成 。
。①如果选择图中A作为氨气的发生装置,对应反应的化学方程式为:

③若用通式
 表示氮氧化物,则
表示氮氧化物,则 转化为
转化为 。
。(2)NO和
 可用NaOH溶液吸收,主要反应:
可用NaOH溶液吸收,主要反应: ,
,
①下列措施能提高尾气中NO和
 去除率的有
去除率的有A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量NaOH溶液
②将NO、
 通入石灰乳中可制备重要的工业原料
通入石灰乳中可制备重要的工业原料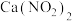 。该工艺需控制NO和
。该工艺需控制NO和 物质的量之比接近1:1,每生成
物质的量之比接近1:1,每生成 ,该反应转移的电子数为
,该反应转移的电子数为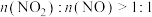 ,则会导致
,则会导致
您最近一年使用:0次
解题方法
2 . 氮氧化物(NOx)是大气污染物之一,处理工业废气中的NOx对于环境保护具有重要的意义。
(1)在一定条件下NH3可将NO2还原。甲同学在实验室对该反应进行了探究。实验设计如图(部分夹持装置省略)。_______ ;装置B内的试剂是______ 。
②装置D中发生反应的离子方程式是_______ ,铜丝可抽动的优点是________ 。
③在装置M中NH3和NO2充分反应,生成两种对环境友好的物质,该反应中NH3和NO2的物质的量之比为______ 。
(2)用NaOH溶液吸收法处理NOx(仅含NO、NO2)。已知过程中发生的反应有:2NaOH+NO+NO2=2NaNO2+H2O;2NaOH+2NO2=NaNO3+NaNO2+H2O。
用不同浓度的NaOH溶液吸收NO2含量不同的尾气,关系如图(α表示NOx中NO2的含量):_____ ,c(NaOH)=_____ 。
(1)在一定条件下NH3可将NO2还原。甲同学在实验室对该反应进行了探究。实验设计如图(部分夹持装置省略)。

②装置D中发生反应的离子方程式是
③在装置M中NH3和NO2充分反应,生成两种对环境友好的物质,该反应中NH3和NO2的物质的量之比为
(2)用NaOH溶液吸收法处理NOx(仅含NO、NO2)。已知过程中发生的反应有:2NaOH+NO+NO2=2NaNO2+H2O;2NaOH+2NO2=NaNO3+NaNO2+H2O。
用不同浓度的NaOH溶液吸收NO2含量不同的尾气,关系如图(α表示NOx中NO2的含量):

您最近一年使用:0次
3 . 三盐基硫酸铅简称“三盐”,是一种重要的工业原料,其化学式为 (相对分子质量为990)。以
(相对分子质量为990)。以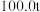 铅泥(主要成分为
铅泥(主要成分为 、
、 及
及 等,
等, 、
、 不与
不与 溶液反应)为原料制备三盐的工艺流程如图所示。
溶液反应)为原料制备三盐的工艺流程如图所示。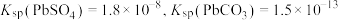 。
。
回答下列问题:
(1)“转化”时 发生反应的离子方程式为
发生反应的离子方程式为_______ ,反应达到平衡时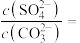
_______ 。
(2)“酸溶”时若有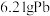 发生反应,则生成
发生反应,则生成 的体积(标准状况)为
的体积(标准状况)为_______  ,为提高“酸溶”速率,可采取的措施是
,为提高“酸溶”速率,可采取的措施是_______ (任意写出一条)。
(3)“滤液2”中溶质的主要成分的化学式为_______ 。
(4)“合成”时主要反应的化学方程式为_______ 。
(5)若得到纯净干燥的三盐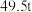 ,假设铅泥中的铅元素有
,假设铅泥中的铅元素有 转化为三盐,则铅泥中央铅元素的质量分数为
转化为三盐,则铅泥中央铅元素的质量分数为_______  。
。
 (相对分子质量为990)。以
(相对分子质量为990)。以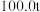 铅泥(主要成分为
铅泥(主要成分为 、
、 及
及 等,
等, 、
、 不与
不与 溶液反应)为原料制备三盐的工艺流程如图所示。
溶液反应)为原料制备三盐的工艺流程如图所示。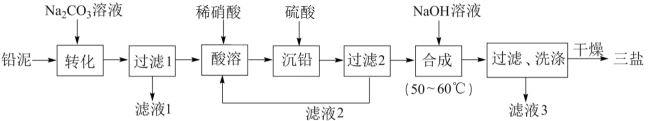
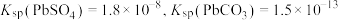 。
。回答下列问题:
(1)“转化”时
 发生反应的离子方程式为
发生反应的离子方程式为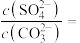
(2)“酸溶”时若有
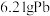 发生反应,则生成
发生反应,则生成 的体积(标准状况)为
的体积(标准状况)为 ,为提高“酸溶”速率,可采取的措施是
,为提高“酸溶”速率,可采取的措施是(3)“滤液2”中溶质的主要成分的化学式为
(4)“合成”时主要反应的化学方程式为
(5)若得到纯净干燥的三盐
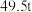 ,假设铅泥中的铅元素有
,假设铅泥中的铅元素有 转化为三盐,则铅泥中央铅元素的质量分数为
转化为三盐,则铅泥中央铅元素的质量分数为 。
。
您最近一年使用:0次
名校
4 . “以废治废”是基于“绿色化学”观念治理污染的思路。用工业废碱渣(主要成分为 )吸收烟气中的
)吸收烟气中的 ,得到亚硫酸钠
,得到亚硫酸钠 粗品。其流程如下。
粗品。其流程如下。 的溶解,可采取的措施是
的溶解,可采取的措施是_______ (写出一种即可)。
(2)过程①进行的操作是_______ 。
(3)上述流程中;通入“含 的烟气”,发生反应的化学方程式为
的烟气”,发生反应的化学方程式为_______ 。
(4)上述流程中,加入NaOH后,发生反应的离子方程式为_______ 。
(5)设计实验证明亚硫酸钠粗品含有少量 的方案是:在一支试管中,加入少量亚硫酸钠粗品,用适量蒸馏水溶解,
的方案是:在一支试管中,加入少量亚硫酸钠粗品,用适量蒸馏水溶解,_______ ,出现白色沉淀,则证明含有 。
。
(6) 可用于处理酸性废水中的
可用于处理酸性废水中的 (转化为
(转化为 ),发生反应的离子方程式为
),发生反应的离子方程式为_______ 。
(7)某化工厂用如图所示工艺流程吸收烟气中的 。在标准状况下,当除去
。在标准状况下,当除去 时,消耗
时,消耗 的物质的量为
的物质的量为_______ mol。
 )吸收烟气中的
)吸收烟气中的 ,得到亚硫酸钠
,得到亚硫酸钠 粗品。其流程如下。
粗品。其流程如下。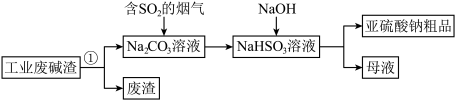
 的溶解,可采取的措施是
的溶解,可采取的措施是(2)过程①进行的操作是
(3)上述流程中;通入“含
 的烟气”,发生反应的化学方程式为
的烟气”,发生反应的化学方程式为(4)上述流程中,加入NaOH后,发生反应的离子方程式为
(5)设计实验证明亚硫酸钠粗品含有少量
 的方案是:在一支试管中,加入少量亚硫酸钠粗品,用适量蒸馏水溶解,
的方案是:在一支试管中,加入少量亚硫酸钠粗品,用适量蒸馏水溶解, 。
。(6)
 可用于处理酸性废水中的
可用于处理酸性废水中的 (转化为
(转化为 ),发生反应的离子方程式为
),发生反应的离子方程式为(7)某化工厂用如图所示工艺流程吸收烟气中的
 。在标准状况下,当除去
。在标准状况下,当除去 时,消耗
时,消耗 的物质的量为
的物质的量为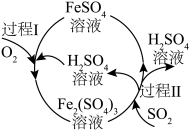
您最近一年使用:0次
名校
5 .  可用于玻璃和陶瓷的着色剂。由含钴可矿(
可用于玻璃和陶瓷的着色剂。由含钴可矿( 元素主要以
元素主要以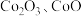 的形式存在,还含有
的形式存在,还含有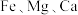 元素,碳及有机物等)制取氯化钴晶体的一种工艺流程如图所示:
元素,碳及有机物等)制取氯化钴晶体的一种工艺流程如图所示: 常用作食品抗氧化剂。
常用作食品抗氧化剂。
②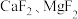 难溶于水。
难溶于水。
③部分金属阳离子形成氢氧化物沉淀的 如表所示:
如表所示:
回答下列问题:
(1)“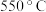 焙烧”的目的是
焙烧”的目的是__________________ 。
(2)“浸取”的过程中, 的主要作用是
的主要作用是__________________ (用离子方程式表示)。若用盐酸代替 和
和 的混合液也能达到目的,从环保角度分析不采用盐酸的原因
的混合液也能达到目的,从环保角度分析不采用盐酸的原因__________________ 。
(3)“滤液1”中加入 溶液,反应过程中氧化剂与还原剂的物质的量之比为
溶液,反应过程中氧化剂与还原剂的物质的量之比为_________ 。
(4)“滤渣2”的主要成分为_________ (填化学式)。
(5)已知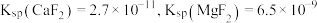 ,当
,当 恰好沉淀完全时(浓度为
恰好沉淀完全时(浓度为 ),溶液中
),溶液中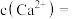
_________ (保留3位有效数字)。
(6)钴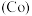 的合金材料广泛应用于航空航天、机械制造等领域。用乙醇燃料电池作为电源电解含
的合金材料广泛应用于航空航天、机械制造等领域。用乙醇燃料电池作为电源电解含 的水溶液制备金属钴的装置如图2、3所示。
的水溶液制备金属钴的装置如图2、3所示。 电极应连接乙醇燃料电池的
电极应连接乙醇燃料电池的_________ 极(填“a”或“b”)。
②电解过程中Ⅱ室溶液 变小,则离子交换膜2为
变小,则离子交换膜2为_________ (填“阴”或“阳”)离子交换膜。
 可用于玻璃和陶瓷的着色剂。由含钴可矿(
可用于玻璃和陶瓷的着色剂。由含钴可矿( 元素主要以
元素主要以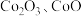 的形式存在,还含有
的形式存在,还含有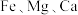 元素,碳及有机物等)制取氯化钴晶体的一种工艺流程如图所示:
元素,碳及有机物等)制取氯化钴晶体的一种工艺流程如图所示: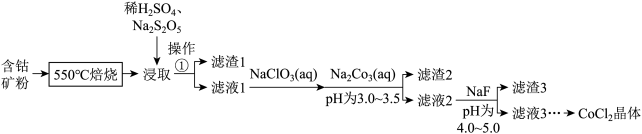
 常用作食品抗氧化剂。
常用作食品抗氧化剂。②
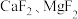 难溶于水。
难溶于水。③部分金属阳离子形成氢氧化物沉淀的
 如表所示:
如表所示:
|
|
|
|
| |
开始沉淀 | 0.3 | 2.7 | 7.2 | 7.6 | 9.6 |
完全沉淀 | 1.1 | 3.2 | 9.2 | 9.6 | 11.1 |
(1)“
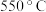 焙烧”的目的是
焙烧”的目的是(2)“浸取”的过程中,
 的主要作用是
的主要作用是 和
和 的混合液也能达到目的,从环保角度分析不采用盐酸的原因
的混合液也能达到目的,从环保角度分析不采用盐酸的原因(3)“滤液1”中加入
 溶液,反应过程中氧化剂与还原剂的物质的量之比为
溶液,反应过程中氧化剂与还原剂的物质的量之比为(4)“滤渣2”的主要成分为
(5)已知
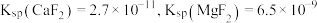 ,当
,当 恰好沉淀完全时(浓度为
恰好沉淀完全时(浓度为 ),溶液中
),溶液中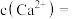
(6)钴
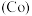 的合金材料广泛应用于航空航天、机械制造等领域。用乙醇燃料电池作为电源电解含
的合金材料广泛应用于航空航天、机械制造等领域。用乙醇燃料电池作为电源电解含 的水溶液制备金属钴的装置如图2、3所示。
的水溶液制备金属钴的装置如图2、3所示。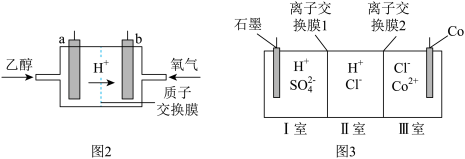
 电极应连接乙醇燃料电池的
电极应连接乙醇燃料电池的②电解过程中Ⅱ室溶液
 变小,则离子交换膜2为
变小,则离子交换膜2为
您最近一年使用:0次
名校
解题方法
6 . 高纯 在电子工业中有重要的应用,工业上利用软锰矿(主要成分是
在电子工业中有重要的应用,工业上利用软锰矿(主要成分是 ,还含有
,还含有 、
、 、
、 等杂质)制取碳酸锰的流程如图所示:
等杂质)制取碳酸锰的流程如图所示: 。
。
可能用到的数据如下:
根据要求回答下列问题:
(1)步骤C中的滤渣为___________ 。
(2)步骤D中氧化剂与还原剂的物质的量之比为___________ 。
(3)步骤E中调节pH的范围为___________ ,其目的是___________ 。
(4)步骤G,温度控制在35℃以下的原因是___________ ,若 恰好沉淀完全时测得溶液中
恰好沉淀完全时测得溶液中 的浓度为
的浓度为 ,则
,则
___________ 。
(5)生成的 沉淀需经充分洗涤,检验洗涤是否干净的方法是
沉淀需经充分洗涤,检验洗涤是否干净的方法是___________ 。
 在电子工业中有重要的应用,工业上利用软锰矿(主要成分是
在电子工业中有重要的应用,工业上利用软锰矿(主要成分是 ,还含有
,还含有 、
、 、
、 等杂质)制取碳酸锰的流程如图所示:
等杂质)制取碳酸锰的流程如图所示:
 。
。可能用到的数据如下:
| 氢氧化物 |  |  |  |  |
| 开始沉淀pH | 1.5 | 6.5 | 4.2 | 8.1 |
| 沉淀完全pH | 3.7 | 9.7 | 7.4 | 10.1 |
(1)步骤C中的滤渣为
(2)步骤D中氧化剂与还原剂的物质的量之比为
(3)步骤E中调节pH的范围为
(4)步骤G,温度控制在35℃以下的原因是
 恰好沉淀完全时测得溶液中
恰好沉淀完全时测得溶液中 的浓度为
的浓度为 ,则
,则
(5)生成的
 沉淀需经充分洗涤,检验洗涤是否干净的方法是
沉淀需经充分洗涤,检验洗涤是否干净的方法是
您最近一年使用:0次
解题方法
7 . 高锰酸钾在化工生产、医药、水处理等诸多领域有重要应用。某学习小组在实验室中制备少量 的步骤如下:
的步骤如下:
①向图1铁坩埚中加入KOH和 ,不断搅拌下小火加热至熔融;
,不断搅拌下小火加热至熔融; ,并不断搅拌、加热充分反应,制得墨绿色固体
,并不断搅拌、加热充分反应,制得墨绿色固体 ;
;
③坩埚冷却至室温后,将所得固体研细、移至烧杯,依次用适量蒸馏水、KOH稀溶液浸取,合并浸取液;
④将浸取液移至图2装置B中,通入 至溶液pH为10~11之间时停止实验;
至溶液pH为10~11之间时停止实验;
⑤将装置B中所得悬浊液过滤、洗涤沉淀,将滤液和洗涤液合并后蒸发浓缩、降温结晶、抽滤、洗涤、干燥,制得产品。
已知:相同温度下, 的溶解度大于
的溶解度大于 的溶解度。
的溶解度。
回答下列问题,
(1)步骤①中用铁坩埚和粗铁丝代替陶瓷和玻璃仪器的原因为_______ 。
(2)步骤②制备 反应中的还原产物为KCl,则该反应中氧化剂与还原剂的物质的量之比为
反应中的还原产物为KCl,则该反应中氧化剂与还原剂的物质的量之比为_______ 。
(3)步骤④中,测定溶液的pH时,用洁净的玻璃棒蘸取待测液并滴到pH试纸中央,一段时间后应观察pH试纸湿润环的_______ (填“中央”或“边缘”)颜色并与标准比色卡对比; 发生反应同时生成
发生反应同时生成 和
和 的离子方程式为
的离子方程式为_______ ;该步骤中,不宜通入足量 将
将 转化为
转化为 的原因为
的原因为_______ 。
(4)步骤⑤蒸发浓缩至_______ (填现象)时再降温结晶。
(5)测定产品纯度:准确称量m g产品(混有少量 ),溶于水配成溶液、酸化,用c
),溶于水配成溶液、酸化,用c 
 标准溶液滴定,达到滴定终点时,消耗标准溶液的体积为V mL。标准溶液应盛放在(填“酸式”或“碱式”)
标准溶液滴定,达到滴定终点时,消耗标准溶液的体积为V mL。标准溶液应盛放在(填“酸式”或“碱式”)_______ 滴定管中;产品中 的质量分数为
的质量分数为_______ (用含c、V、m的代数式表示),若达到滴定终点时俯视读数,会导致所测结果_______ (填“偏高”“偏低”或“无影响”)。
 的步骤如下:
的步骤如下:①向图1铁坩埚中加入KOH和
 ,不断搅拌下小火加热至熔融;
,不断搅拌下小火加热至熔融;
 ,并不断搅拌、加热充分反应,制得墨绿色固体
,并不断搅拌、加热充分反应,制得墨绿色固体 ;
;③坩埚冷却至室温后,将所得固体研细、移至烧杯,依次用适量蒸馏水、KOH稀溶液浸取,合并浸取液;
④将浸取液移至图2装置B中,通入
 至溶液pH为10~11之间时停止实验;
至溶液pH为10~11之间时停止实验;⑤将装置B中所得悬浊液过滤、洗涤沉淀,将滤液和洗涤液合并后蒸发浓缩、降温结晶、抽滤、洗涤、干燥,制得产品。
已知:相同温度下,
 的溶解度大于
的溶解度大于 的溶解度。
的溶解度。回答下列问题,
(1)步骤①中用铁坩埚和粗铁丝代替陶瓷和玻璃仪器的原因为
(2)步骤②制备
 反应中的还原产物为KCl,则该反应中氧化剂与还原剂的物质的量之比为
反应中的还原产物为KCl,则该反应中氧化剂与还原剂的物质的量之比为(3)步骤④中,测定溶液的pH时,用洁净的玻璃棒蘸取待测液并滴到pH试纸中央,一段时间后应观察pH试纸湿润环的
 发生反应同时生成
发生反应同时生成 和
和 的离子方程式为
的离子方程式为 将
将 转化为
转化为 的原因为
的原因为(4)步骤⑤蒸发浓缩至
(5)测定产品纯度:准确称量m g产品(混有少量
 ),溶于水配成溶液、酸化,用c
),溶于水配成溶液、酸化,用c 
 标准溶液滴定,达到滴定终点时,消耗标准溶液的体积为V mL。标准溶液应盛放在(填“酸式”或“碱式”)
标准溶液滴定,达到滴定终点时,消耗标准溶液的体积为V mL。标准溶液应盛放在(填“酸式”或“碱式”) 的质量分数为
的质量分数为
您最近一年使用:0次
8 . 铬酸铅 又称铬黄,是一种重要的黄色颜料,常用作橡胶、水彩、色纸的着色剂。以含铅废渣(主要成分是
又称铬黄,是一种重要的黄色颜料,常用作橡胶、水彩、色纸的着色剂。以含铅废渣(主要成分是 和
和 ,还含
,还含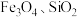 等)为原料制备铬酸铅的流程如下:
等)为原料制备铬酸铅的流程如下: 不溶于稀硝酸。
不溶于稀硝酸。
②常温下,几种难溶电解质的溶度积如下:
回答下列问题:
(1)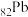 位于周期表第
位于周期表第___________ 周期___________ 族,气体R为___________ (填化学式)。
(2)“碱浸”中 转化反应的离子方程式为
转化反应的离子方程式为___________ 。
(3)已知:“酸浸”中 作氧化剂时转移
作氧化剂时转移 电子。气体R在空气中的颜色变化为
电子。气体R在空气中的颜色变化为___________ 。
(4)“酸浸”中铅元素浸出率与温度、硝酸浓度的关系如图所示。“酸浸”最佳条件为___________ 。 ,“除铁”中控制
,“除铁”中控制 范围为
范围为___________ 。c(Fe3+)≤1×10-5mol/L,则表明 已完全沉淀。
已完全沉淀。
(6)“沉铬”中生成 反应的离子方程式为
反应的离子方程式为___________ 。
 又称铬黄,是一种重要的黄色颜料,常用作橡胶、水彩、色纸的着色剂。以含铅废渣(主要成分是
又称铬黄,是一种重要的黄色颜料,常用作橡胶、水彩、色纸的着色剂。以含铅废渣(主要成分是 和
和 ,还含
,还含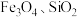 等)为原料制备铬酸铅的流程如下:
等)为原料制备铬酸铅的流程如下:
 不溶于稀硝酸。
不溶于稀硝酸。②常温下,几种难溶电解质的溶度积如下:
| 电解质 |  |  |  |  |  |
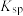 | 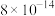 |  | 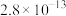 | 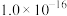 | 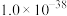 |
(1)
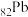 位于周期表第
位于周期表第(2)“碱浸”中
 转化反应的离子方程式为
转化反应的离子方程式为(3)已知:“酸浸”中
 作氧化剂时转移
作氧化剂时转移 电子。气体R在空气中的颜色变化为
电子。气体R在空气中的颜色变化为(4)“酸浸”中铅元素浸出率与温度、硝酸浓度的关系如图所示。“酸浸”最佳条件为

 ,“除铁”中控制
,“除铁”中控制 范围为
范围为 已完全沉淀。
已完全沉淀。(6)“沉铬”中生成
 反应的离子方程式为
反应的离子方程式为
您最近一年使用:0次
解题方法
9 . 以大洋锰结核(主要由 和铁氧化物组成,还含有
和铁氧化物组成,还含有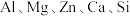 等元素)为原料制备
等元素)为原料制备 及
及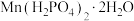 的工艺流程如下:
的工艺流程如下: 范围如下:
范围如下:
② 时,
时,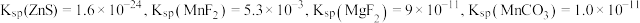 。
。
回答下列问题:
(1)锰元素在元素周期表中的位置为___________ 。
(2)“浸取”时,有副产物 生成。该副反应过程中氧化剂与还原剂的物质的量之比为
生成。该副反应过程中氧化剂与还原剂的物质的量之比为___________ 。温度对锰的浸出率、 生成率的影响如图所示,为了减少副产物的生成并降低能耗,最适宜的温度为
生成率的影响如图所示,为了减少副产物的生成并降低能耗,最适宜的温度为___________ 左右(填标号)。 B.
B. C.
C. D.
D.
(3)加氨水“调 ”时,应控制的
”时,应控制的 范围是
范围是___________ 。
(4)“净化”后,过滤出“滤渣3”,所得滤液中 的最低浓度为
的最低浓度为___________  。
。
(5)“沉锰”时,加入过量的 溶液与溶液中的
溶液与溶液中的 作用,反应的化学方程式为
作用,反应的化学方程式为___________ 。若改用加入 溶液,还会产生
溶液,还会产生 沉淀,可能的原因是:
沉淀,可能的原因是: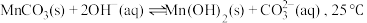 时,该反应的平衡常数的对数值
时,该反应的平衡常数的对数值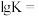
___________ (保留1位小数)。
(6)要将“溶解”后的溶液制得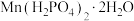 晶体,操作X为
晶体,操作X为___________ 、___________ 、过滤、洗涤、干燥。
 和铁氧化物组成,还含有
和铁氧化物组成,还含有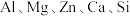 等元素)为原料制备
等元素)为原料制备 及
及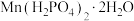 的工艺流程如下:
的工艺流程如下: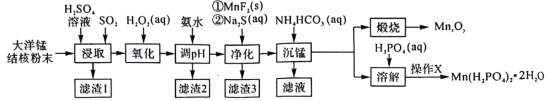
 范围如下:
范围如下:| 金属离子 |  |  |  |  |  |  |
开始沉淀的 | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 |
完全沉淀的 | 10.2 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 |
 时,
时,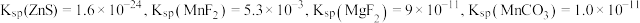 。
。回答下列问题:
(1)锰元素在元素周期表中的位置为
(2)“浸取”时,有副产物
 生成。该副反应过程中氧化剂与还原剂的物质的量之比为
生成。该副反应过程中氧化剂与还原剂的物质的量之比为 生成率的影响如图所示,为了减少副产物的生成并降低能耗,最适宜的温度为
生成率的影响如图所示,为了减少副产物的生成并降低能耗,最适宜的温度为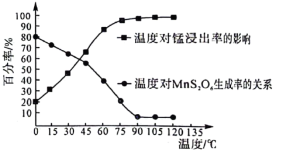
 B.
B. C.
C. D.
D.
(3)加氨水“调
 ”时,应控制的
”时,应控制的 范围是
范围是(4)“净化”后,过滤出“滤渣3”,所得滤液中
 的最低浓度为
的最低浓度为 。
。(5)“沉锰”时,加入过量的
 溶液与溶液中的
溶液与溶液中的 作用,反应的化学方程式为
作用,反应的化学方程式为 溶液,还会产生
溶液,还会产生 沉淀,可能的原因是:
沉淀,可能的原因是: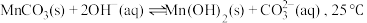 时,该反应的平衡常数的对数值
时,该反应的平衡常数的对数值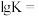
(6)要将“溶解”后的溶液制得
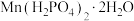 晶体,操作X为
晶体,操作X为
您最近一年使用:0次
名校
10 . “环境就是民生,青山就是美丽,蓝天也是幸福。”拥有天蓝、地绿、水净的美好家园,是每个中国人的梦想。回答下列问题:
(1)汽车尾气(含CO、N2、SO2和NO等)是城市空气污染源之一,治理的方法之一是在汽车的排气管上装一个“催化转化器”,它能使一氧化碳跟一氧化氮反应生成可参与大气生态循环的无毒气体。写出在催化剂的作用下CO跟NO反应的化学方程式___________ 。
(2)化肥、炼油、稀土、钢铁等工业都会排放出高浓度的氨氮废水。氨氮废水是造成河流及湖泊富营养化的主要因素。某氮肥厂产生的氨氮废水中的氮元素多以 和NH3·H2O形式存在,为达到变废为宝回收利用的目的某团队设计处理流程如下:
和NH3·H2O形式存在,为达到变废为宝回收利用的目的某团队设计处理流程如下:___________ 。
②过程Ⅱ为硝化过程,在微生物的作用下实现 →
→ →
→ 的转化,在碱性条件下,
的转化,在碱性条件下, 被氧气氧化成
被氧气氧化成 的总反应的离子方程式为
的总反应的离子方程式为___________ 。
③过程Ⅲ为反硝化过程,向一定条件下的废水中加入甲醇(CH3OH)实现HNO3→ →N2的转化,将0.5mol
→N2的转化,将0.5mol 完全转化为N2,转移电子的物质的量为
完全转化为N2,转移电子的物质的量为___________ 。
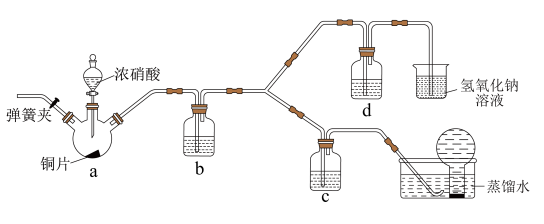
(3)按如图所示装置探究浓、稀硝酸氧化性的相对强弱(夹持仪器已略去)。实验表明浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO。由此得出的结论是浓硝酸的氧化性强于稀硝酸。
①装置b、c、d中盛放的药品依次是___________ 、___________ 、___________ 。其中装置a中发生反应的化学方程式是___________ 。
②实验结束后,同学们发现装置a中溶液呈绿色,而不显蓝色。针对溶液呈绿色的原因,提出以下假设:
假设1:Cu2+的浓度较大所致;
假设2:溶解了生成的NO2。
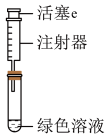
探究如下:取装置a中绿色溶液,分为两等份。
取一份于如图所示装置中,___________ (填“操作”和“现象”),证实装置a中溶解了NO2。___________ (填化学试剂),溶液变为蓝色。证实假设1不成立,假设2成立。
(1)汽车尾气(含CO、N2、SO2和NO等)是城市空气污染源之一,治理的方法之一是在汽车的排气管上装一个“催化转化器”,它能使一氧化碳跟一氧化氮反应生成可参与大气生态循环的无毒气体。写出在催化剂的作用下CO跟NO反应的化学方程式
(2)化肥、炼油、稀土、钢铁等工业都会排放出高浓度的氨氮废水。氨氮废水是造成河流及湖泊富营养化的主要因素。某氮肥厂产生的氨氮废水中的氮元素多以
 和NH3·H2O形式存在,为达到变废为宝回收利用的目的某团队设计处理流程如下:
和NH3·H2O形式存在,为达到变废为宝回收利用的目的某团队设计处理流程如下: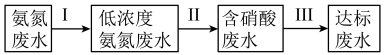
②过程Ⅱ为硝化过程,在微生物的作用下实现
 →
→ →
→ 的转化,在碱性条件下,
的转化,在碱性条件下, 被氧气氧化成
被氧气氧化成 的总反应的离子方程式为
的总反应的离子方程式为③过程Ⅲ为反硝化过程,向一定条件下的废水中加入甲醇(CH3OH)实现HNO3→
 →N2的转化,将0.5mol
→N2的转化,将0.5mol 完全转化为N2,转移电子的物质的量为
完全转化为N2,转移电子的物质的量为(3)按如图所示装置探究浓、稀硝酸氧化性的相对强弱(夹持仪器已略去)。实验表明浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO。由此得出的结论是浓硝酸的氧化性强于稀硝酸。
①装置b、c、d中盛放的药品依次是
②实验结束后,同学们发现装置a中溶液呈绿色,而不显蓝色。针对溶液呈绿色的原因,提出以下假设:
假设1:Cu2+的浓度较大所致;
假设2:溶解了生成的NO2。
探究如下:取装置a中绿色溶液,分为两等份。
取一份于如图所示装置中,
您最近一年使用:0次




