1 . N元素的单质及其化合物之间的转化关系如图所示:NH3←N2→NO→NO2→HNO3
回答下列问题:
(1)N元素在元素周期表中的位置为第___ 周期,第___ 族;画出N原子结构示意图___ 。
(2)工业上用氮气和氢气合成氨气,请写出NH3的电子式___ 。
(3)实验室可以利用氢氧化钙固体和氯化铵固体制备氨气,请写出该反应的化学反应方程式___ ;并写出实验室检验氨气的具体操作___ 。
(4)NO是治疗心血管疾病的信使分子,NO与空气接触的反应现象是___ ,写出该反应的化学方程式___ ,若该反应转移0.4mole-,则消耗的NO分子数是___ (用NA表示阿伏加 德罗常数)。
(5)浓硝酸具有不稳定性,实验室应该将浓硝酸保存在带玻璃塞的___ (填“无色”或“棕色”)试剂瓶中。
回答下列问题:
(1)N元素在元素周期表中的位置为第
(2)工业上用氮气和氢气合成氨气,请写出NH3的电子式
(3)实验室可以利用氢氧化钙固体和氯化铵固体制备氨气,请写出该反应的化学反应方程式
(4)NO是治疗心血管疾病的信使分子,NO与空气接触的反应现象是
(5)浓硝酸具有不稳定性,实验室应该将浓硝酸保存在带玻璃塞的
您最近一年使用:0次
名校
解题方法
2 . 元素X、Y、Z、M、N均为原子序数依次增大的短周期主族元素;R在地壳金属元素中的含量仅次于Z。已知Y原子最外层电子数与核外电子总数之比为3:4,M原子的最外层电子数与次外层电子数之比为3:4;N-、Z3+、X+离子半径逐渐减小;化合物XN常温下为气体,请回答下列问题:
(1)R在元素周期表中的位置是____________ ;Z3+的离子结构示意图是____________ 。
(2)写出X、Y、N按原子个数之比1:1:1:形成的化合物的电子式__________ ;M和N气态氢化物的稳定性大小比较为________ (用化学式和“>”“<”或“=”表示)。
(3)X与Y可分别形成10电子和18电子的分子,写出该18电子分子转化成10电子分子的化学方程式__________________________________ .
(4)Z元素的单质能与Y和R形成的化合物在一定条件下发生反应,同时放出大量的热,其反应的化学方程式为_____________________________ 。
(5)下图表示由上述元素中的某两种元素组成的气体分子在一定条件下的密闭容器中充分反应前后的转化关系,在该转化关系中还原剂是__________ (填化学式),示意图中转移电子的数目为______ 。
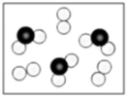


(6)由X、Y、M三种元素组成的离子,在水溶液中与H+和OH-均不能大量共存,还能和氯水反应,写出其与新制氯水反应的离子方程式_______________________ 。
(1)R在元素周期表中的位置是
(2)写出X、Y、N按原子个数之比1:1:1:形成的化合物的电子式
(3)X与Y可分别形成10电子和18电子的分子,写出该18电子分子转化成10电子分子的化学方程式
(4)Z元素的单质能与Y和R形成的化合物在一定条件下发生反应,同时放出大量的热,其反应的化学方程式为
(5)下图表示由上述元素中的某两种元素组成的气体分子在一定条件下的密闭容器中充分反应前后的转化关系,在该转化关系中还原剂是



(6)由X、Y、M三种元素组成的离子,在水溶液中与H+和OH-均不能大量共存,还能和氯水反应,写出其与新制氯水反应的离子方程式
您最近一年使用:0次
2017-12-08更新
|
235次组卷
|
3卷引用:山东省烟台市2018届高三上学期期中考试化学试题
名校
解题方法
3 . I.氧化还原反应原理在研究物质性质及物质转化方面具有重要的价值。
(1)生活中常用的“84”消毒液与洁厕净(主要成分是盐酸)混合时会产生大量的有毒气体,写出该反应的离子方程式___________ 。
(2)火药是中国的四大发明之一,永远值得中华儿女骄傲。黑火药在发生爆炸时,发生如下反应2KNO3+3C+S=K2S+N2↑+3CO2↑,则生成1molN2反应过程中转移电子的数目为___________ 。
(3)中国古代著作中有“银针验毒”的记录,其原理为4Ag+2H2S+O2=2X+2H2O,则X的化学式是___________ ,其中 H2S在该反应中___________ (填序号)。
A.作氧化剂 B.作还原剂 C.既是氧化剂又是还原剂 D.既不是氧化剂又不是还原剂
(4)砒霜(As2O3)与Zn可以发生如下反应As2O3+6Zn+6H2SO4=2AsH3+6ZnSO4+3H2O,其中氢元素的化合价未发生改变。在上述反应中As2O3,显示出来的性质是___________ (填“还原性”或“氧化性”)。
II.元素周期表对化学的发展有很大影响,在材料、能源、环境和生命科学研究上发挥着越来越重要的作用。下表是元素周期表的一部分,数字①~⑨代表九种常见的短周期元素,请按题目要求回答下列问题:___________ 。
(6)在①~⑨元素中,原子半径最大的元素,其某种氧化物可用于呼吸面具中氧气来源,请写出该物质与二氧化碳反应化学方程式___________ 。
(7)写出⑤、⑦两种元素所形成的最高价氧化物对应的水化物反应的离子方程式是___________ 。
(8)比较④与⑨的简单气态氢化物的稳定性___________ >___________ (填化学式)。
(9)由下列元素形成的化合物中含有离子键的是___________。
(10)写出⑤在空气中燃烧产物的电子式:___________ 。
(1)生活中常用的“84”消毒液与洁厕净(主要成分是盐酸)混合时会产生大量的有毒气体,写出该反应的离子方程式
(2)火药是中国的四大发明之一,永远值得中华儿女骄傲。黑火药在发生爆炸时,发生如下反应2KNO3+3C+S=K2S+N2↑+3CO2↑,则生成1molN2反应过程中转移电子的数目为
(3)中国古代著作中有“银针验毒”的记录,其原理为4Ag+2H2S+O2=2X+2H2O,则X的化学式是
A.作氧化剂 B.作还原剂 C.既是氧化剂又是还原剂 D.既不是氧化剂又不是还原剂
(4)砒霜(As2O3)与Zn可以发生如下反应As2O3+6Zn+6H2SO4=2AsH3+6ZnSO4+3H2O,其中氢元素的化合价未发生改变。在上述反应中As2O3,显示出来的性质是
II.元素周期表对化学的发展有很大影响,在材料、能源、环境和生命科学研究上发挥着越来越重要的作用。下表是元素周期表的一部分,数字①~⑨代表九种常见的短周期元素,请按题目要求回答下列问题:

(6)在①~⑨元素中,原子半径最大的元素,其某种氧化物可用于呼吸面具中氧气来源,请写出该物质与二氧化碳反应化学方程式
(7)写出⑤、⑦两种元素所形成的最高价氧化物对应的水化物反应的离子方程式是
(8)比较④与⑨的简单气态氢化物的稳定性
(9)由下列元素形成的化合物中含有离子键的是___________。
| A.①③ | B.②③ | C.①④ | D.⑥⑨ |
您最近一年使用:0次
4 . 化合物M由两种短周期主族元素组成,在一定条件下可以发生下列转化:
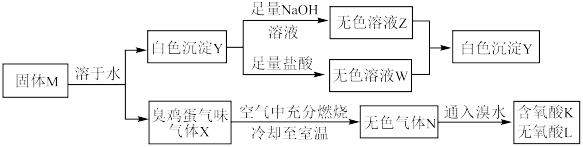
请回答下列问题:
(1)固体M的化学式为___________ 。
(2)无氧酸L中阴离子对应元素在元素周期表中的位置为___________ ,其基态原子中电子的空间运动状态有___________ 种。
(3)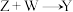 的化学方程式为
的化学方程式为___________ 。
(4)上述流程的反应中涉及的短周期非金属元素的电负性由大到小的顺序为___________ 。
(5)如图所示,在室温下向甲、乙两相同密闭容器中,分别充入等物质的量气体X和气体N。
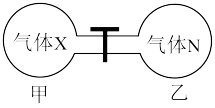
①反应前两容器中的气体密度: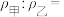
___________ 。
②打开活塞,使气体充分反应,则反应前后的压强: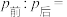
___________ 。
(6)将无色气体N通入到浓硝酸中,有红棕色气体冒出,在反应中n(氧化剂):n(还原剂)=___________ 。

请回答下列问题:
(1)固体M的化学式为
(2)无氧酸L中阴离子对应元素在元素周期表中的位置为
(3)
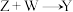 的化学方程式为
的化学方程式为(4)上述流程的反应中涉及的短周期非金属元素的电负性由大到小的顺序为
(5)如图所示,在室温下向甲、乙两相同密闭容器中,分别充入等物质的量气体X和气体N。

①反应前两容器中的气体密度:
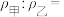
②打开活塞,使气体充分反应,则反应前后的压强:
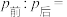
(6)将无色气体N通入到浓硝酸中,有红棕色气体冒出,在反应中n(氧化剂):n(还原剂)=
您最近一年使用:0次
2023-11-22更新
|
86次组卷
|
2卷引用:江西省2024届高三上学期11 月一轮总复习调研测试化学试题
名校
5 . 部分短周期主族元素原子半径与原子序数的关系如图,根据所学知识回答下列问题。

(1)c、d、e、i四种元素的最简单氢化物中,最稳定的是___________ (填化学式)。
(2)d与f能形成一种淡黄色的物质,其电子式为___________ 。
(3)g的最高价氧化物对应的水化物与f的最高价氧化物对应的水化物反应的离子方程式为___________ 。
(4)由a的单质制成的电池需要注意防水,其原因为___________ (用化学方程式表示)。
(5)门捷列夫在研究元素周期表时,科学地预言了11种当时尚未发现的元素,他认为g的下一周期存在一种“类g”元素,该元素多年后被法国化学家发现,命名为镓(Ga),镓在元素周期表中的位置为___________ 。预测g与Ga的最高价氧化物对应水化物的碱性较强的是___________ (填最高价氧化物对应水化物的化学式)。
(6)使用下列装置再添加合适的药品,可以证明b和h两种元素的非金属性强弱顺序,可供选择的药品为:①浓硫酸②稀硫酸③盐酸④ 固体⑤
固体⑤ ⑥澄清石灰水⑦NaOH溶液
⑥澄清石灰水⑦NaOH溶液

请选择装置丙、丁两处应该加入的药品代号:丙___________ 、丁___________ 。
(7)某实验小组向100mL 溶液中通入气体单质
溶液中通入气体单质 ,溶液中
,溶液中 、
、 的物质的量随通入的
的物质的量随通入的 的物质的量变化如图所示(不考虑与水的反应)。
的物质的量变化如图所示(不考虑与水的反应)。

从开始通入 到
到 时,溶液中
时,溶液中
___________ 。

(1)c、d、e、i四种元素的最简单氢化物中,最稳定的是
(2)d与f能形成一种淡黄色的物质,其电子式为
(3)g的最高价氧化物对应的水化物与f的最高价氧化物对应的水化物反应的离子方程式为
(4)由a的单质制成的电池需要注意防水,其原因为
(5)门捷列夫在研究元素周期表时,科学地预言了11种当时尚未发现的元素,他认为g的下一周期存在一种“类g”元素,该元素多年后被法国化学家发现,命名为镓(Ga),镓在元素周期表中的位置为
(6)使用下列装置再添加合适的药品,可以证明b和h两种元素的非金属性强弱顺序,可供选择的药品为:①浓硫酸②稀硫酸③盐酸④
 固体⑤
固体⑤ ⑥澄清石灰水⑦NaOH溶液
⑥澄清石灰水⑦NaOH溶液
请选择装置丙、丁两处应该加入的药品代号:丙
(7)某实验小组向100mL
 溶液中通入气体单质
溶液中通入气体单质 ,溶液中
,溶液中 、
、 的物质的量随通入的
的物质的量随通入的 的物质的量变化如图所示(不考虑与水的反应)。
的物质的量变化如图所示(不考虑与水的反应)。
从开始通入
 到
到 时,溶液中
时,溶液中
您最近一年使用:0次
2024-01-15更新
|
134次组卷
|
2卷引用:四川省成都市第七中学2023-2024学年高一上学期12月月考化学试题
6 . 工业上湿法合成硼氢化钠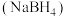 路线如下:
路线如下:

已知:硼酸的结构为: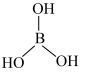
请回答下列问题:
(1)“合成”步骤中常将 分散到矿物油中,再与硼酸三甲酯反应,其中矿物油的作用是
分散到矿物油中,再与硼酸三甲酯反应,其中矿物油的作用是___________ 。
(2)“合成”反应的化学方程式为___________ 。
(3)“合成”反应也可以利用KH,其还原能力比 更强,请说明原因
更强,请说明原因___________ 。
(4)硼氢化钠在催化剂钌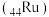 表面与水反应的历程如图所示,下列说法正确的是___________。
表面与水反应的历程如图所示,下列说法正确的是___________。

(5)已知氢化铝钾能与水发生剧烈反应,请设计实验证明其反应后的溶液中存在铝元素___________ 。并写出检验过程中涉及的离子方程式___________ 。
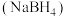 路线如下:
路线如下:
已知:硼酸的结构为:

请回答下列问题:
(1)“合成”步骤中常将
 分散到矿物油中,再与硼酸三甲酯反应,其中矿物油的作用是
分散到矿物油中,再与硼酸三甲酯反应,其中矿物油的作用是(2)“合成”反应的化学方程式为
(3)“合成”反应也可以利用KH,其还原能力比
 更强,请说明原因
更强,请说明原因(4)硼氢化钠在催化剂钌
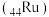 表面与水反应的历程如图所示,下列说法正确的是___________。
表面与水反应的历程如图所示,下列说法正确的是___________。
A.元素钌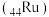 在元素周期表中位于第五周期Ⅷ族 在元素周期表中位于第五周期Ⅷ族 |
B. 分子中B原子为 分子中B原子为 杂化且不含孤对电子 杂化且不含孤对电子 |
C.过程④中产生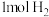 ,转移电子的物质的量为 ,转移电子的物质的量为 |
D.硼氢化钠中硼元素的化合价为 价,反应过程中硼元素的化合价始终保持不变 价,反应过程中硼元素的化合价始终保持不变 |
(5)已知氢化铝钾能与水发生剧烈反应,请设计实验证明其反应后的溶液中存在铝元素
您最近一年使用:0次
名校
解题方法
7 . 以天然气为原料经由合成气(CO、 )制化学品是目前天然气转化利用的主导技术路线。制备
)制化学品是目前天然气转化利用的主导技术路线。制备 的反应转化关系如图所示。设
的反应转化关系如图所示。设 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
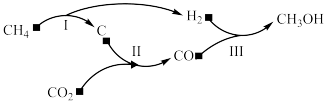
 )制化学品是目前天然气转化利用的主导技术路线。制备
)制化学品是目前天然气转化利用的主导技术路线。制备 的反应转化关系如图所示。设
的反应转化关系如图所示。设 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
A.用1 mol  理论上能生产标准状况下 理论上能生产标准状况下 |
B.等物质的量的 和 和 , , 的质子数比 的质子数比 多 多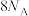 |
C.44 g  气体和44 g 气体和44 g  与CO的混合气体,所含C原子数均为 与CO的混合气体,所含C原子数均为 |
D.用 制备合成气的反应中,若生成1 mol CO,反应转移电子数为 制备合成气的反应中,若生成1 mol CO,反应转移电子数为 |
您最近一年使用:0次
解题方法
8 . 元素W、X、Y、Z的原子序数依次增加,p、q、r是由这些元素组成的二元化合物;m、n分别是元素Y、Z的单质,n通常为深红棕色液体,p为最简单的芳香烃,s通常是难溶于水、密度比水大的油状液体。上述物质的转化关系如图所示:
(1)q的溶液显______ 性(填“酸”“碱”或“中”),理由是:_________ (用离子方程式说明)。
(2)s的化学式为______ ,Z在周期表中的位置为_____________ 。
(3)X、Y两种元素组成的化合物能溶于足量的浓硝酸,产生无色气体与红棕色气体的体积比为1:13,则该化合物的化学式为____________ 。

(1)q的溶液显
(2)s的化学式为
(3)X、Y两种元素组成的化合物能溶于足量的浓硝酸,产生无色气体与红棕色气体的体积比为1:13,则该化合物的化学式为
您最近一年使用:0次
名校
解题方法
9 . 硝酸是用途广泛的重要化工原料,自然乳和化工生产中合成硝酸各物质转化关系如下图所示,请结合你所学的知识回答以下问题:
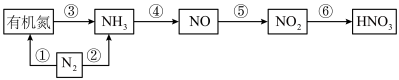
(1)上图①~⑥各步转化中,属于氮的固定的是_______ (填序号);
(2)氨的催化氧化是工业合成硝酸的重要步骤,其化学方程式为_______ 其中氧化剂与还原剂物质的量之比为_______ ;
(3)为提高NO→ 的转化率,可采取的措施是
的转化率,可采取的措施是_______ ;
(4)工业制硝酸时含有NO、 等大气污染物,可用尿素[CO(NH2)2]水溶液吸收氮氧化物,用尿素[CO(NH2)2]水溶液吸收体积比为1∶1的NO和
等大气污染物,可用尿素[CO(NH2)2]水溶液吸收氮氧化物,用尿素[CO(NH2)2]水溶液吸收体积比为1∶1的NO和 混合气,可将N元素转变为对环境无害的气体。该反应的化学方程式为
混合气,可将N元素转变为对环境无害的气体。该反应的化学方程式为_______ ;

(1)上图①~⑥各步转化中,属于氮的固定的是
(2)氨的催化氧化是工业合成硝酸的重要步骤,其化学方程式为
(3)为提高NO→
 的转化率,可采取的措施是
的转化率,可采取的措施是(4)工业制硝酸时含有NO、
 等大气污染物,可用尿素[CO(NH2)2]水溶液吸收氮氧化物,用尿素[CO(NH2)2]水溶液吸收体积比为1∶1的NO和
等大气污染物,可用尿素[CO(NH2)2]水溶液吸收氮氧化物,用尿素[CO(NH2)2]水溶液吸收体积比为1∶1的NO和 混合气,可将N元素转变为对环境无害的气体。该反应的化学方程式为
混合气,可将N元素转变为对环境无害的气体。该反应的化学方程式为
您最近一年使用:0次
名校
10 . 近几年来关于氮污染的治理倍受关注。
(1)三效催化剂是最为常见的汽车尾气催化剂,能同时实现汽车尾气中的CO、CxHy、NOx三种成分的净化,其催化剂表面物质转化的关系如图1所示,化合物X可借助傅里叶红外光谱图(如图2所示)确定。

①在图示的转化中,被还原的元素是_______________ ,X的化学式为__________________ 。
②钡元素在周期表中的位置是___________________________ 。
(2)SCR技术可使NOx与NH3直接反应,实现无害转化。当NO与NO2的物质的最之比为2:1时,写出发生反应的化学方程式:____________________________ 。
(3)利用ClO2氧化氮氧化物反应过程如下:NO NO2
NO2 N2反应I的化学方程式是2NO+ ClO2+H2O==NO2+HNO3+ 2HCl,反应II的离子方程式是
N2反应I的化学方程式是2NO+ ClO2+H2O==NO2+HNO3+ 2HCl,反应II的离子方程式是__________________ 。
(4)加入过量次氯酸钠可使废水中NH4+完全转化为N2,而本身被还原为NaCl。
①检验废水中是否存在NH4+的方法是_______________________________________________ 。
②若处理废水产生了0.448LN2(标准状况),则需消耗浓度为2mol/L的次氯酸钠的体积为____ mL。
(1)三效催化剂是最为常见的汽车尾气催化剂,能同时实现汽车尾气中的CO、CxHy、NOx三种成分的净化,其催化剂表面物质转化的关系如图1所示,化合物X可借助傅里叶红外光谱图(如图2所示)确定。

①在图示的转化中,被还原的元素是
②钡元素在周期表中的位置是
(2)SCR技术可使NOx与NH3直接反应,实现无害转化。当NO与NO2的物质的最之比为2:1时,写出发生反应的化学方程式:
(3)利用ClO2氧化氮氧化物反应过程如下:NO
 NO2
NO2 N2反应I的化学方程式是2NO+ ClO2+H2O==NO2+HNO3+ 2HCl,反应II的离子方程式是
N2反应I的化学方程式是2NO+ ClO2+H2O==NO2+HNO3+ 2HCl,反应II的离子方程式是(4)加入过量次氯酸钠可使废水中NH4+完全转化为N2,而本身被还原为NaCl。
①检验废水中是否存在NH4+的方法是
②若处理废水产生了0.448LN2(标准状况),则需消耗浓度为2mol/L的次氯酸钠的体积为
您最近一年使用:0次
2018-05-24更新
|
377次组卷
|
2卷引用:【全国百强】河南省南阳市第一中学2018届高三第十六次考试理综化学试题



