名校
1 . i. 、
、 的资源化利用既能解决环保问题,又能提供化工原料,解决能源紧张,具有重要的现实意义和广阔的应用前景。
的资源化利用既能解决环保问题,又能提供化工原料,解决能源紧张,具有重要的现实意义和广阔的应用前景。
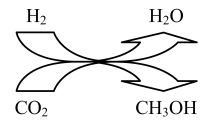
(1)利用 可合成多种化工产品。2021年9月24日我国科学家首次报告了
可合成多种化工产品。2021年9月24日我国科学家首次报告了 到淀粉的人工合成路线,其中第一步转化如图所示,该反应的化学方程式为
到淀粉的人工合成路线,其中第一步转化如图所示,该反应的化学方程式为_______ 。
(2) 是一种酸性氧化物,可用氨水吸收烟气中的
是一种酸性氧化物,可用氨水吸收烟气中的 。
。
① 属于
属于_______ (填“电解质”或“非电解质”)。
②氨水吸收少量 ,可生成
,可生成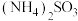 ,反应的离子方程式为
,反应的离子方程式为_______ 。
(3)所得溶液再用 氧化,可制得化肥
氧化,可制得化肥 ,反应的化学方程式为
,反应的化学方程式为_______ 。
ii. 具有强氧化性,是常见的消毒剂。以
具有强氧化性,是常见的消毒剂。以 为原料之一制备亚氯酸钠
为原料之一制备亚氯酸钠 的流程如下图:
的流程如下图:
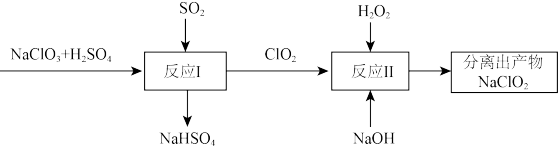
(4)反应I中氧化剂与还原剂的个数之比为_______ 。
(5)写出反应II的化学方程式_______ 。
(6)与传统消毒剂 比较,
比较, 消毒效率是
消毒效率是 的
的_______ 倍。(以单位质量得到的电子数表示,结果精确到0.01)
 、
、 的资源化利用既能解决环保问题,又能提供化工原料,解决能源紧张,具有重要的现实意义和广阔的应用前景。
的资源化利用既能解决环保问题,又能提供化工原料,解决能源紧张,具有重要的现实意义和广阔的应用前景。(1)利用
 可合成多种化工产品。2021年9月24日我国科学家首次报告了
可合成多种化工产品。2021年9月24日我国科学家首次报告了 到淀粉的人工合成路线,其中第一步转化如图所示,该反应的化学方程式为
到淀粉的人工合成路线,其中第一步转化如图所示,该反应的化学方程式为
(2)
 是一种酸性氧化物,可用氨水吸收烟气中的
是一种酸性氧化物,可用氨水吸收烟气中的 。
。①
 属于
属于②氨水吸收少量
 ,可生成
,可生成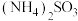 ,反应的离子方程式为
,反应的离子方程式为(3)所得溶液再用
 氧化,可制得化肥
氧化,可制得化肥 ,反应的化学方程式为
,反应的化学方程式为ii.
 具有强氧化性,是常见的消毒剂。以
具有强氧化性,是常见的消毒剂。以 为原料之一制备亚氯酸钠
为原料之一制备亚氯酸钠 的流程如下图:
的流程如下图:
(4)反应I中氧化剂与还原剂的个数之比为
(5)写出反应II的化学方程式
(6)与传统消毒剂
 比较,
比较, 消毒效率是
消毒效率是 的
的
您最近一年使用:0次
2022-10-12更新
|
521次组卷
|
3卷引用:辽宁省实验中学2022-2023学年高一上学期10月月考化学试题
名校
解题方法
2 . 硫酸的工业制备是一个重要的化工生产过程,但在生产过程中会产生大量污染,需要在生产工艺中考虑到绿色工艺.以硫酸工业产生的二氧化硫尾气、氨水、石灰石、焦炭、碳酸氢铵为原料可以合成硫化钙、硫酸铵、亚硫酸铵等物质.合成路线如下:
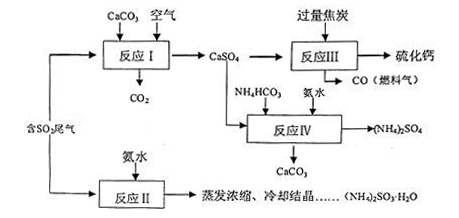
(1)写出反应Ⅰ的化学方程式________________________ .
(2)反应Ⅲ中每生成lmol硫化钙理论上转移电子数________ ;为充分利用副产品CO,有人提出以熔融的K2C03为电解质,设计燃料电池,请写出此电池的负极反应_____________ .
(3)为检验反应Ⅱ得到的产品是否因部分被氧化而变质,需选择的化学试剂有__________________ .
(4)根据合成流程,可以循环利用的是____________ .
(5)(NH4)2SO3溶液可用于电厂产生的烟道气的脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,形成共生系统.写出二氧化氮与亚硫酸铵反应的离子方程式___________________ .

(1)写出反应Ⅰ的化学方程式
(2)反应Ⅲ中每生成lmol硫化钙理论上转移电子数
(3)为检验反应Ⅱ得到的产品是否因部分被氧化而变质,需选择的化学试剂有
(4)根据合成流程,可以循环利用的是
(5)(NH4)2SO3溶液可用于电厂产生的烟道气的脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,形成共生系统.写出二氧化氮与亚硫酸铵反应的离子方程式
您最近一年使用:0次
2017-02-28更新
|
302次组卷
|
4卷引用:河南省南阳市2020届高三上学期期中质量评估化学试题
河南省南阳市2020届高三上学期期中质量评估化学试题(已下线)专题七 工艺流程题(提分特训)-2020年高考二轮模块化复习之《元素化合物》名师讲案与提分特训陕西省西安市第一中学2021届高三上学期第五次模拟考试化学试题2016-2017学年辽宁省六校协作体高二下学期期初化学试卷
名校
解题方法
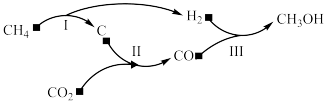
3 . 以天然气为原料经由合成气(CO、 )制化学品是目前天然气转化利用的主导技术路线。制备
)制化学品是目前天然气转化利用的主导技术路线。制备 的反应转化关系如图所示。设
的反应转化关系如图所示。设 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
 )制化学品是目前天然气转化利用的主导技术路线。制备
)制化学品是目前天然气转化利用的主导技术路线。制备 的反应转化关系如图所示。设
的反应转化关系如图所示。设 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
A.用1 mol  理论上能生产标准状况下 理论上能生产标准状况下 |
B.等物质的量的 和 和 , , 的质子数比 的质子数比 多 多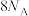 |
C.44 g  气体和44 g 气体和44 g  与CO的混合气体,所含C原子数均为 与CO的混合气体,所含C原子数均为 |
D.用 制备合成气的反应中,若生成1 mol CO,反应转移电子数为 制备合成气的反应中,若生成1 mol CO,反应转移电子数为 |
您最近一年使用:0次
名校
解题方法
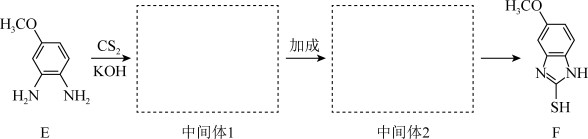
4 . 抗溃疡药奥美拉唑合成路线如下:
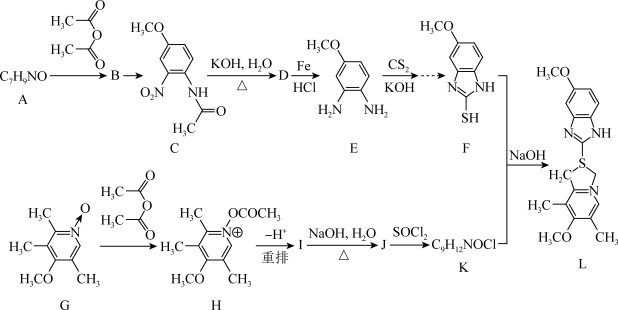
已知: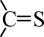 的某些性质和
的某些性质和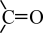 相似,都能与
相似,都能与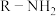 发生加成。
发生加成。
(1)请写出A的结构简式为_______ 。
(2)写出符合下列条件的A的同分异构体M的结构简式:_______ 。
①遇氯化铁溶液显紫色
②1mol M最多能与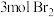 发生取代反应产生白色沉淀
发生取代反应产生白色沉淀
③核磁共振氢谱有6组峰,峰面积之比为1∶1∶2∶1∶3∶1
(3)B→C的反应试剂及条件是_______ 。
(4)C→D的化学方程式是_______ 。
(5)D→E过程中,氧化剂与还原剂的物质的量之比为_______ 。
(6)J的分子式为 ,则I的结构简式是
,则I的结构简式是_______ 。
(7)E经三步反应形成F,请写出中间体1和中间体2的结构简式_______ 、_______ 。

已知:
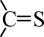 的某些性质和
的某些性质和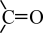 相似,都能与
相似,都能与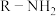 发生加成。
发生加成。(1)请写出A的结构简式为
(2)写出符合下列条件的A的同分异构体M的结构简式:
①遇氯化铁溶液显紫色
②1mol M最多能与
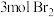 发生取代反应产生白色沉淀
发生取代反应产生白色沉淀③核磁共振氢谱有6组峰,峰面积之比为1∶1∶2∶1∶3∶1
(3)B→C的反应试剂及条件是
(4)C→D的化学方程式是
(5)D→E过程中,氧化剂与还原剂的物质的量之比为
(6)J的分子式为
 ,则I的结构简式是
,则I的结构简式是(7)E经三步反应形成F,请写出中间体1和中间体2的结构简式

您最近一年使用:0次
名校
5 . 纳米氧化亚铜(Cu2O,颗粒直径1~100nm)具有特殊的光学、光电和催化性能,采用化学沉淀法制备晶型结构完整、粒度分布均匀的纳米Cu2O(在潮湿空气中会慢慢氧化生成CuO)的合成路线如图所示。下列说法正确的是
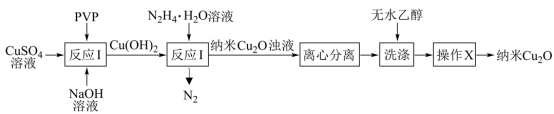

| A.反应Ⅰ为化合反应 |
| B.操作X为过滤 |
| C.反应Ⅱ中,每生成22.4L(标准状况)N2,转移4mol电子 |
| D.“洗涤”时,无水乙醇可用蒸馏水代替 |
您最近一年使用:0次
2021-10-09更新
|
412次组卷
|
3卷引用:重庆市西南大学附属中学2022届高三上学期第二次月考化学试题
名校
解题方法
6 . 纳米氧化亚铜(Cu2O,颗粒直径1~100nm)具有特殊的光学、光电和催化性能,采用化学沉淀法制备晶型结构完整、粒度分布均匀的纳米Cu2O(在潮湿空气中会慢慢氧化生成CuO)的合成路线如图所示。下列说法不正确的是
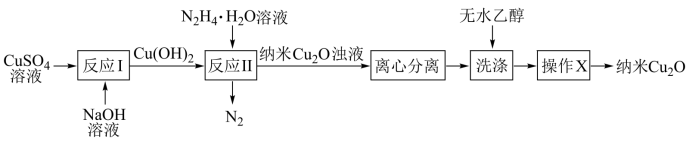

| A.纳米Cu2O颗粒分散在水中形成的分散系能产生丁达尔效应 |
| B.操作X为真空干燥 |
| C.用无水乙醇洗涤,有利于快速干燥,减少氧化 |
| D.反应Ⅱ中,每消耗0.1mol N2H4·H2O,转移0.2mol电子 |
您最近一年使用:0次
名校
7 . 硼氢化钠(NaBH4)和氨硼烷(BNH6)是优良的储氢材料,合成路线如图所示,下列叙述错误的是


| A.硼氢化钠中阴离子的VSEPR模型为正四面体形 |
| B.反应①中氧化剂与还原剂物质的量之比为1∶2 |
| C.SiO2是反应①的催化剂 |
| D.将氨硼烷移出体系有利于提高反应②转化率 |
您最近一年使用:0次
名校
8 . 我国科学家首次在实验室实现 到淀粉的合成,其路线如下,设
到淀粉的合成,其路线如下,设 为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是
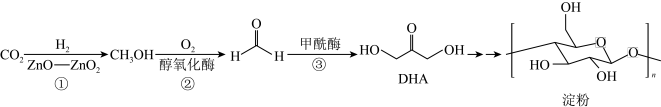
 到淀粉的合成,其路线如下,设
到淀粉的合成,其路线如下,设 为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是
A.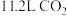 含有的π键数目为 含有的π键数目为 |
B. 含有的极性键数目为 含有的极性键数目为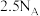 |
C.由 生成1mol HCHO转移电子数为 生成1mol HCHO转移电子数为 |
D.1mol DHA中 杂化的原子数为 杂化的原子数为 |
您最近一年使用:0次
2024-01-09更新
|
911次组卷
|
2卷引用:2024届广东东莞中学、广州二中、惠州一中、深圳实验、珠海一中、中山纪念中学六校高三上学期第三次联考化学
9 . 工业上湿法合成硼氢化钠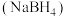 路线如下:
路线如下:

已知:硼酸的结构为: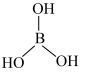
请回答下列问题:
(1)“合成”步骤中常将 分散到矿物油中,再与硼酸三甲酯反应,其中矿物油的作用是
分散到矿物油中,再与硼酸三甲酯反应,其中矿物油的作用是___________ 。
(2)“合成”反应的化学方程式为___________ 。
(3)“合成”反应也可以利用KH,其还原能力比 更强,请说明原因
更强,请说明原因___________ 。
(4)硼氢化钠在催化剂钌 表面与水反应的历程如图所示,下列说法正确的是___________。
表面与水反应的历程如图所示,下列说法正确的是___________。

(5)已知氢化铝钾能与水发生剧烈反应,请设计实验证明其反应后的溶液中存在铝元素___________ 。并写出检验过程中涉及的离子方程式___________ 。
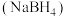 路线如下:
路线如下:
已知:硼酸的结构为:

请回答下列问题:
(1)“合成”步骤中常将
 分散到矿物油中,再与硼酸三甲酯反应,其中矿物油的作用是
分散到矿物油中,再与硼酸三甲酯反应,其中矿物油的作用是(2)“合成”反应的化学方程式为
(3)“合成”反应也可以利用KH,其还原能力比
 更强,请说明原因
更强,请说明原因(4)硼氢化钠在催化剂钌
 表面与水反应的历程如图所示,下列说法正确的是___________。
表面与水反应的历程如图所示,下列说法正确的是___________。
A.元素钌 在元素周期表中位于第五周期Ⅷ族 在元素周期表中位于第五周期Ⅷ族 |
B. 分子中B原子为 分子中B原子为 杂化且不含孤对电子 杂化且不含孤对电子 |
C.过程④中产生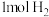 ,转移电子的物质的量为 ,转移电子的物质的量为 |
D.硼氢化钠中硼元素的化合价为 价,反应过程中硼元素的化合价始终保持不变 价,反应过程中硼元素的化合价始终保持不变 |
(5)已知氢化铝钾能与水发生剧烈反应,请设计实验证明其反应后的溶液中存在铝元素
您最近一年使用:0次
10 . 氢化铝锂(LiAlH4)、硼氢化钠(NaBH4)在有机合成中应用广泛。回答下列问题:
(1)工业上制备氢化铝锂方法是:首先高温高压合成氢化铝钠,然后与氯化锂反应,相关化学方程式为Na+Al+2H2 NaAlH4;NaAlH4+LiCl
NaAlH4;NaAlH4+LiCl LiAlH4+NaCl。上述反应涉及的基本反应类型分别为
LiAlH4+NaCl。上述反应涉及的基本反应类型分别为_______ 、_______ 。
(2)NaBH4的电子式为_______ ,其与水反应生成NaBO2,该反应的化学方程式为_______ 。
(3)还原能力(单位质量转移电子数):LiAlH4_______ (填“>”“=”或“<")NaBH4。
(4)工业上湿法合成NaBH4路线如下:

①"合成”步骤中常将NaH分散到矿物油中再与硼酸三甲酯[化学式:B(OCH3)3,易溶于矿物油中]反应,其目的是_______ 。
②“合成”反应的化学方程式为_______ 。
(1)工业上制备氢化铝锂方法是:首先高温高压合成氢化铝钠,然后与氯化锂反应,相关化学方程式为Na+Al+2H2
 NaAlH4;NaAlH4+LiCl
NaAlH4;NaAlH4+LiCl LiAlH4+NaCl。上述反应涉及的基本反应类型分别为
LiAlH4+NaCl。上述反应涉及的基本反应类型分别为(2)NaBH4的电子式为
(3)还原能力(单位质量转移电子数):LiAlH4
(4)工业上湿法合成NaBH4路线如下:

①"合成”步骤中常将NaH分散到矿物油中再与硼酸三甲酯[化学式:B(OCH3)3,易溶于矿物油中]反应,其目的是
②“合成”反应的化学方程式为
您最近一年使用:0次



