1 . 某温度下将氯气通入过量KOH溶液中,反应后得到KCl、KClO和KClO3的混合溶液,若所得溶液中ClO-和ClO 的物质的量之比为2:1,则该反应中被氧化和被还原氯元素的质量比为
的物质的量之比为2:1,则该反应中被氧化和被还原氯元素的质量比为
 的物质的量之比为2:1,则该反应中被氧化和被还原氯元素的质量比为
的物质的量之比为2:1,则该反应中被氧化和被还原氯元素的质量比为| A.3:7 | B.7:3 | C.1:1 | D.3:11 |
您最近一年使用:0次
解题方法
2 . 根据所学知识,回答下列问题:
(1)K2FeO4是常见的水处理剂,净水原理如图所示。请回答下列问题:___________ 。
②过程a中K2FeO4体现___________ (填“氧化”或“还原”)性,反应过程中转移5.418×1022个电子,需要___________ mol K2FeO4。
(2)碱性条件下用Fe(OH)3和KClO反应制备K2FeO4。配平其反应的化学方程式:___________ 。
___________Fe(OH)3+___________KOH+___________KClO=___________K2FeO4+___________KCl+___________H2O
(3)干法制备高铁酸钠的主要反应为2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应中的还原剂是___________ ,生产1mol的高铁酸钠,需要转移电子的物质的量是___________ mol。
(4)将铝箔放入NaOH稀溶液中,开始时无气体生成,写出反应的离子方程式:___________ ;反应片刻后,可观察到有气体产生。
(1)K2FeO4是常见的水处理剂,净水原理如图所示。请回答下列问题:
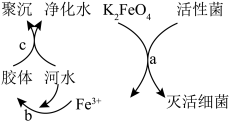
②过程a中K2FeO4体现
(2)碱性条件下用Fe(OH)3和KClO反应制备K2FeO4。配平其反应的化学方程式:
___________Fe(OH)3+___________KOH+___________KClO=___________K2FeO4+___________KCl+___________H2O
(3)干法制备高铁酸钠的主要反应为2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应中的还原剂是
(4)将铝箔放入NaOH稀溶液中,开始时无气体生成,写出反应的离子方程式:
您最近一年使用:0次
解题方法
3 . 废弃物的综合利用有利于节约资源、保护环境。实验室利用废旧电池的铜帽(Cu、Zn总含量约为99%)制备 和
和 的部分实验步骤如下:
的部分实验步骤如下: ”步骤中,为加快溶解速率,可采取的措施是
”步骤中,为加快溶解速率,可采取的措施是___________ 。(任写一种方法)。
(2)从“滤液 ”中提取
”中提取 的实验步骤依次为
的实验步骤依次为___________ 、过滤、冰水洗涤、低温干燥,其中冰水洗涤晶体的目的是___________ 。
(3)在“溶解 ”步骤中,发生反应的化学方程式为
”步骤中,发生反应的化学方程式为___________ 。
(4)为测定产品中 的纯度,称取1.270g样品,溶于稀硫酸并稀释至250mL,取出25.00mL溶液于锥形瓶中,加入过量的KI溶液充分反应,再向其中逐滴加入0.02000
的纯度,称取1.270g样品,溶于稀硫酸并稀释至250mL,取出25.00mL溶液于锥形瓶中,加入过量的KI溶液充分反应,再向其中逐滴加入0.02000
 溶液至刚好完全反应,消耗
溶液至刚好完全反应,消耗 溶液25.00mL。
溶液25.00mL。
已知: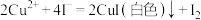 ,
, 。请依据实验数据计算样品中
。请依据实验数据计算样品中 的质量分数
的质量分数___________ (写出计算过程,结果保留2位小数)。
 和
和 的部分实验步骤如下:
的部分实验步骤如下: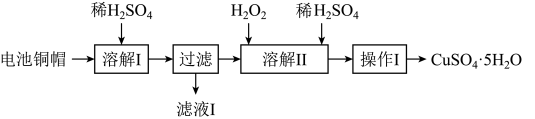
 ”步骤中,为加快溶解速率,可采取的措施是
”步骤中,为加快溶解速率,可采取的措施是(2)从“滤液
 ”中提取
”中提取 的实验步骤依次为
的实验步骤依次为(3)在“溶解
 ”步骤中,发生反应的化学方程式为
”步骤中,发生反应的化学方程式为(4)为测定产品中
 的纯度,称取1.270g样品,溶于稀硫酸并稀释至250mL,取出25.00mL溶液于锥形瓶中,加入过量的KI溶液充分反应,再向其中逐滴加入0.02000
的纯度,称取1.270g样品,溶于稀硫酸并稀释至250mL,取出25.00mL溶液于锥形瓶中,加入过量的KI溶液充分反应,再向其中逐滴加入0.02000
 溶液至刚好完全反应,消耗
溶液至刚好完全反应,消耗 溶液25.00mL。
溶液25.00mL。已知:
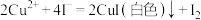 ,
, 。请依据实验数据计算样品中
。请依据实验数据计算样品中 的质量分数
的质量分数
您最近一年使用:0次
4 . 研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,下列“水”电池在海水中放电时的有关说法正确的是
| A.正极反应式:Ag+Cl--e-=AgCl |
| B.每生成1mol Na2Mn5O10转移2 mol电子 |
| C.Na+不断向“水”电池的负极移动 |
| D.AgCl是还原产物 |
您最近一年使用:0次
5 . 根据金属钠与水(滴有酚酞)反应的现象,下列有关说法错误的是
| A.钠熔化成闪亮的小球,说明钠的熔点低且反应放热 |
| B.反应后溶液的颜色逐渐变红,说明反应生成了碱 |
| C.该反应中每1mol的Na得到1mol的电子 |
| D.当火灾现场存放有大量金属钠时不能用水来灭火 |
您最近一年使用:0次
6 . Ⅰ.下表是生活生产中常见的物质,表中列出了它们的一种主要成分(其中加碘盐是氯化钠中添加适量的 ,其他成分未列出)
,其他成分未列出)
(1)请你对表中①~⑦的主要成分进行分类,是电解质的是______ ,是非电解质的是______ 。(填序号)
(2)写出④在水中的电离方程式____________ 。
(3)写出用④治疗胃酸(主要成分为盐酸)过多涉及的化学方程式:______________ 。
Ⅱ.铁的化学性质比较活泼,常温下铁可以与稀硝酸发生反应,反应的化学方程式为
(4)反应中氧化剂与还原剂的个数之比为______ ,其中 反应中显出来的性质是
反应中显出来的性质是______ 。
(5)该反应中的氧化产物为______ ,每生成11.2L(标准状况下)的NO,转移的电子个数为______ 。
 ,其他成分未列出)
,其他成分未列出)名称 | 天然气 | 白酒 | 醋酸 | 小苏打 |
主要成分 | ① | ② | ③ | ④ |
名称 | 熟石灰 | 铜线 | 加碘盐 | |
主要成分 | ⑤ | ⑥Cu | ⑦NaCl和 |
(2)写出④在水中的电离方程式
(3)写出用④治疗胃酸(主要成分为盐酸)过多涉及的化学方程式:
Ⅱ.铁的化学性质比较活泼,常温下铁可以与稀硝酸发生反应,反应的化学方程式为

(4)反应中氧化剂与还原剂的个数之比为
 反应中显出来的性质是
反应中显出来的性质是(5)该反应中的氧化产物为
您最近一年使用:0次
7 . 实验室利用Bi(OH)3制取高锰酸钠的相关反应的离子方程式如下:
I.ClO +6H++5Cl-=3Cl2+3H2O;
+6H++5Cl-=3Cl2+3H2O;
II.Bi(OH)3+3OH-+Cl2+Na+=NaBiO3↓+2Cl-+3H2O;
III.5NaBiO3+2Mn2++14H+=2MnO +5Bi3++5Na++7H2O。
+5Bi3++5Na++7H2O。
下列说法正确的是
A.反应I中氧化产物和还原产物的物质的量比为1∶5
B.酸性条件下的氧化性:ClO > Cl2 > NaBiO3 > MnO
> Cl2 > NaBiO3 > MnO
C.NaBiO3可与盐酸发生反应:NaBiO3+6H++2Cl-=Bi3++Cl2↑+3H2O+Na+
D.制得142g高锰酸钠时,理论上消耗氯酸钠的物质的量为1mol
I.ClO
 +6H++5Cl-=3Cl2+3H2O;
+6H++5Cl-=3Cl2+3H2O;II.Bi(OH)3+3OH-+Cl2+Na+=NaBiO3↓+2Cl-+3H2O;
III.5NaBiO3+2Mn2++14H+=2MnO
 +5Bi3++5Na++7H2O。
+5Bi3++5Na++7H2O。下列说法正确的是
A.反应I中氧化产物和还原产物的物质的量比为1∶5
B.酸性条件下的氧化性:ClO
 > Cl2 > NaBiO3 > MnO
> Cl2 > NaBiO3 > MnO
C.NaBiO3可与盐酸发生反应:NaBiO3+6H++2Cl-=Bi3++Cl2↑+3H2O+Na+
D.制得142g高锰酸钠时,理论上消耗氯酸钠的物质的量为1mol
您最近一年使用:0次
名校
8 . I.神舟十七号载人航天飞船于2023年10月26日成功发射,飞船搭载的是中国研制的长征二号F遥十七运载火箭,采用四氧化二氮(N2O4)和偏二甲肼(C2H8N2)作为推进剂,二者反应生成二氧化碳、水蒸气和氮气。
(1)偏二甲肼的摩尔质量为___________ 。
(2)四氧化二氮能与水反应生成亚硝酸和___________ (写化学式)。
(3)四氧化二氮和偏二甲肼反应的化学方程式为:2N2O4+C2H8N2 2CO2+3N2+4H2O,若反应生成3mol N2,则转移的电子的物质的量是
2CO2+3N2+4H2O,若反应生成3mol N2,则转移的电子的物质的量是___________ 。
(4)已知N2、CO2混合气体的质量共10.0g,在标准状况下的体积为6.72L,则混合气体中CO2的质量为___________ 。
II.二氧化氯(ClO2)是一种黄绿色到橙黄色的气体,是国际上公认的安全、无毒的绿色消毒剂。已知:工业上制备二氧化氯的方法之一是用甲醇在酸性介质中与氯酸钠反应。二氧化氯能与许多化学物质发生爆炸性反应,遇水则生成次氯酸、氯气和氧气。
(5)将二氧化氯通入紫色石蕊试液中,溶液褪色的理由是___________ 。
(6)设NA为阿伏加德罗常数的值,现有10g质量分数为64%的甲醇(CH3OH)水溶液,则该溶液所含氢原子数目为___________ 。
(7)假设CO2和ClO2在标准状况下均为气体,则反应CH3OH+NaClO3+H2SO4 → CO2↑+ClO2↑+Na2SO4 +H2O(未配平)中转移的电子数目为0.6NA时,该反应产生标准状况下气体的体积为___________ 。
(1)偏二甲肼的摩尔质量为
(2)四氧化二氮能与水反应生成亚硝酸和
(3)四氧化二氮和偏二甲肼反应的化学方程式为:2N2O4+C2H8N2
 2CO2+3N2+4H2O,若反应生成3mol N2,则转移的电子的物质的量是
2CO2+3N2+4H2O,若反应生成3mol N2,则转移的电子的物质的量是(4)已知N2、CO2混合气体的质量共10.0g,在标准状况下的体积为6.72L,则混合气体中CO2的质量为
II.二氧化氯(ClO2)是一种黄绿色到橙黄色的气体,是国际上公认的安全、无毒的绿色消毒剂。已知:工业上制备二氧化氯的方法之一是用甲醇在酸性介质中与氯酸钠反应。二氧化氯能与许多化学物质发生爆炸性反应,遇水则生成次氯酸、氯气和氧气。
(5)将二氧化氯通入紫色石蕊试液中,溶液褪色的理由是
(6)设NA为阿伏加德罗常数的值,现有10g质量分数为64%的甲醇(CH3OH)水溶液,则该溶液所含氢原子数目为
(7)假设CO2和ClO2在标准状况下均为气体,则反应CH3OH+NaClO3+H2SO4 → CO2↑+ClO2↑+Na2SO4 +H2O(未配平)中转移的电子数目为0.6NA时,该反应产生标准状况下气体的体积为
您最近一年使用:0次
名校
9 . 设NA为阿伏加德罗常数的值,下列说法正确的是
| A.1 mol·L-1 Na2SO4溶液中含钠离子的数目为2NA |
| B.标准状况下,22.4 L盐酸中含有NA个HCl分子 |
| C.1 mol Na被完全氧化生成Na2O2,失去2NA个电子 |
| D.常温常压下,8 g O2含有4NA个电子 |
您最近一年使用:0次
解题方法
10 . 已知30mL浓度为0.5 的Na2SO3溶液恰好与50mL浓度为0.1
的Na2SO3溶液恰好与50mL浓度为0.1 的KRO4溶液完全反应转化为
的KRO4溶液完全反应转化为 ,则R元素在产物中的化合价是
,则R元素在产物中的化合价是
 的Na2SO3溶液恰好与50mL浓度为0.1
的Na2SO3溶液恰好与50mL浓度为0.1 的KRO4溶液完全反应转化为
的KRO4溶液完全反应转化为 ,则R元素在产物中的化合价是
,则R元素在产物中的化合价是| A.-1 | B.0 | C.+1 | D.+2 |
您最近一年使用:0次








