名校
解题方法
1 . 硫元素的几种化合物及其单质存在下列转化关系(反应条件省略)。

下列判断不正确的是

下列判断不正确的是
A.反应①中氧化剂与还原剂物质的量之比为 |
B.反应②表明 具有酸性氧化物的性质 具有酸性氧化物的性质 |
| C.反应③的原子利用率是100% |
D.反应④中稀 是氧化剂 是氧化剂 |
您最近一年使用:0次
2023-12-27更新
|
225次组卷
|
9卷引用:第五章 化工生产中的重要非金属元素(A卷·知识通关练)-【单元测试】2022-2023学年高一化学分层训练AB卷(人教版2019必修第二册)
第五章 化工生产中的重要非金属元素(A卷·知识通关练)-【单元测试】2022-2023学年高一化学分层训练AB卷(人教版2019必修第二册)(已下线)第01练 硫及其化合物-2023年【暑假分层作业】高一化学(人教版2019必修第二册)第3课时 不同价态含硫物质的转化山东省菏泽市第一中学2023-2024学年高一上学期第三次月考化学试题辽宁省锦州市2019-2020学年高一下学期期末考试化学试题(已下线)5.1.3 不同价态含硫物质的转化-2021-2022学年高一化学课后培优练(人教版2019必修第二册)湖北省竹山县第二中学2021-2022学年高一下学期第一次月考化学试题浙江省玉环市玉城中学2021-2022学年高一下学期开学考试化学试题山东省菏泽市曹县第一中学2023-2024学年高一上学期 月考化学试题
2 . 铁是人类较早使用的金属之一。运用铁及其化合物的知识,完成下列问题。
(1)所含铁元素既有氧化性又有还原性的物质是_______(填字母,下同)。
(2)血红蛋白(Hb)中的铁元素呈正二价,能与O2分子结合成氧合血红蛋白(HbO)从而有输送氧的能力。NaNO2因具有氧化性能使血红蛋白丧失与O2结合的能力,药品美蓝是其有效的解毒剂,下列说法中正确的是_______。
(3)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔来制造印刷电路板。写出FeCl3溶液与铜发生反应的离子方程式:_______ 。
高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(4)干法制备高铁酸钠的主要反应为:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应中Na2O2是_______ (填“氧化剂”或“还原剂”)。
(5)湿法制备高铁酸钾的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、FeO 、Cl-、H2O。
、Cl-、H2O。
①碱性条件下,氧化剂和还原剂的物质的量的比为3∶2发生反应,写出并配平湿法制高铁酸钾的离子方程式:_______ 。
②若反应过程中转移了0.3mol电子,则还原产物的物质的量为_______ mol。
(6)①某反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O,写出该反应的化学方程式:_______ 。
②根据反应8NH3+3Cl2=6NH4Cl+N2,当生成28gN2时,被氧化的物质为_______ g。
(1)所含铁元素既有氧化性又有还原性的物质是_______(填字母,下同)。
| A.Fe | B.FeCl3 | C.FeSO4 | D.Fe2O3 |
| A.NaNO2被氧化 | B.药品美蓝是还原剂 | C.NaNO2是还原剂 | D.药品美蓝被还原 |
高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(4)干法制备高铁酸钠的主要反应为:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应中Na2O2是
(5)湿法制备高铁酸钾的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、FeO
 、Cl-、H2O。
、Cl-、H2O。①碱性条件下,氧化剂和还原剂的物质的量的比为3∶2发生反应,写出并配平湿法制高铁酸钾的离子方程式:
②若反应过程中转移了0.3mol电子,则还原产物的物质的量为
(6)①某反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O,写出该反应的化学方程式:
②根据反应8NH3+3Cl2=6NH4Cl+N2,当生成28gN2时,被氧化的物质为
您最近一年使用:0次
2023-01-17更新
|
356次组卷
|
2卷引用:章末检测卷(三) 物质的性质与转化
名校
3 . 研究氮及其化合物的性质,可以有效改善人类的生存环境。氮元素化合价—物质类别关系如图,以下说法正确的是


| A.物质A转化为NO是发生氧化还原反应 |
| B.标准状况下,3.36L物质B与水完全反应,电子转移0.1mol |
C.物质C的浓溶液与Cu反应的离子方程式为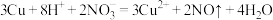 |
D. 的检验方法是取少量溶液于试管中,加热,生成气体能使湿润的红色石蕊试纸变蓝 的检验方法是取少量溶液于试管中,加热,生成气体能使湿润的红色石蕊试纸变蓝 |
您最近一年使用:0次
2023-01-11更新
|
370次组卷
|
3卷引用:章末检测卷(三) 物质的性质与转化
名校
解题方法
4 . 元素的“价—类”二维图是我们学习元素及其化合物相关知识的重要模型和工具,它指的是以元素的化合价为纵坐标,以物质的类别为横坐标所绘制的二维平面图像。下图为铁元素的“价—类”二维图,图中甲~己均含铁元素。回答下列问题:

(1)下列说法正确的是____
(2)高铁酸盐( )是一种高效净水剂,请结合图像推测其净水原理
)是一种高效净水剂,请结合图像推测其净水原理_______ 。
(3)在戊的溶液中滴加烧碱溶液并放置一段时间的现象是_______ ,在放置过程时的反应化学方程式为_______ 。
(4)已知甲与稀硝酸反应的化学方程式为: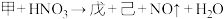 (未配平)。若产物中戊和己的物质的量之比为3:1,还原剂与氧化剂分别为
(未配平)。若产物中戊和己的物质的量之比为3:1,还原剂与氧化剂分别为_______ 和_______ ,二者的物质的量之比为_______ ,该反应的化学方程式_______ 。

(1)下列说法正确的是____
| A.铁与高温水蒸气的反应可实现上述甲到乙的转化 |
B. 是一种黑色粉末,不稳定,在空气中受热时迅速转化为红棕色粉末 是一种黑色粉末,不稳定,在空气中受热时迅速转化为红棕色粉末 |
| C.向戊的水溶液中滴加硫氰化钾溶液后溶液会变成血红色 |
| D.在空气中加热丙会生成红棕色固体 |
 )是一种高效净水剂,请结合图像推测其净水原理
)是一种高效净水剂,请结合图像推测其净水原理(3)在戊的溶液中滴加烧碱溶液并放置一段时间的现象是
(4)已知甲与稀硝酸反应的化学方程式为:
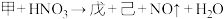 (未配平)。若产物中戊和己的物质的量之比为3:1,还原剂与氧化剂分别为
(未配平)。若产物中戊和己的物质的量之比为3:1,还原剂与氧化剂分别为
您最近一年使用:0次
2023-01-10更新
|
177次组卷
|
3卷引用:章末检测卷(三) 物质的性质与转化
名校
解题方法
5 . 氧化亚铜(Cu2O)主要用于制造杀虫剂、分析试剂和红色玻璃等,在潮湿的空气中会被逐渐氧化为黑色的氧化铜。以肼(N2H4)为原料与醋酸铜反应制取Cu2O的反应为4Cu(CH3COO)2+N2H4+2H2O=2Cu2O↓+N2+8CH3COOH。生成的沉淀需先用水洗涤,再用乙醇洗涤。下列说法错误的是
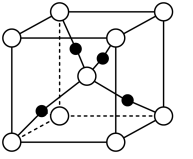

| A.N2H4能与水分子形成分子间氢键 |
| B.如图所示的Cu2O的晶胞中,与Cu+距离最近且等距离的O2-的个数是4 |
| C.每生成标准状况下2.24 LN2,反应转移电子数为0.4×6.02×1023 |
| D.沉淀用水洗后,再用乙醇洗可以除去Cu2O表面的水,从而快速得到较干燥的产品 |
您最近一年使用:0次
2022-12-16更新
|
609次组卷
|
4卷引用:第三章 晶体结构与性质(B卷·能力提升练)-2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修2)
解题方法
6 . 利用氯元素价类二维图可以从不同角度研究含氯物质的性质及其转化关系。图中①~⑩均含氯元素。回答下列问题:

(1)④的化学式为_______ ,⑦的电离方程式为_______ 。
(2)⑤与⑨混合可产生①,反应的离子方程式为_______ 。若将①通入热的烧碱溶液中,可以得到NaC1、NaClO和 的混合液。当混合液中
的混合液。当混合液中 和
和 的个数比为15∶2时,混合液中
的个数比为15∶2时,混合液中 和
和 的个数比为
的个数比为_______ 。
(3)含⑨的溶液可作为水处理剂除去水中的杂质离子。例如它可使酸性废水中的 时转化为
时转化为 ,反应的离子方程式为
,反应的离子方程式为_______ 。
(4)⑨的溶液在空气中放置一段时间后漂白效果更好,结合离子方程式解释原因:_______ 。(已知酸性: )
)
(5)一种有效成分为 、
、 、
、 的“二氧化氯泡腾片”。能快速溶于水,溢出大量气泡,同时得到
的“二氧化氯泡腾片”。能快速溶于水,溢出大量气泡,同时得到 溶液。上述过程,生成1 mol
溶液。上述过程,生成1 mol 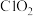 的反应中氧化剂与还原剂物质的量之比为
的反应中氧化剂与还原剂物质的量之比为_______ ,写出产生“气泡”的离子方程式_______ 。

(1)④的化学式为
(2)⑤与⑨混合可产生①,反应的离子方程式为
 的混合液。当混合液中
的混合液。当混合液中 和
和 的个数比为15∶2时,混合液中
的个数比为15∶2时,混合液中 和
和 的个数比为
的个数比为(3)含⑨的溶液可作为水处理剂除去水中的杂质离子。例如它可使酸性废水中的
 时转化为
时转化为 ,反应的离子方程式为
,反应的离子方程式为(4)⑨的溶液在空气中放置一段时间后漂白效果更好,结合离子方程式解释原因:
 )
)(5)一种有效成分为
 、
、 、
、 的“二氧化氯泡腾片”。能快速溶于水,溢出大量气泡,同时得到
的“二氧化氯泡腾片”。能快速溶于水,溢出大量气泡,同时得到 溶液。上述过程,生成1 mol
溶液。上述过程,生成1 mol 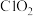 的反应中氧化剂与还原剂物质的量之比为
的反应中氧化剂与还原剂物质的量之比为
您最近一年使用:0次
2022-11-19更新
|
241次组卷
|
3卷引用:章末检测卷(二) 元素与物质世界
名校
解题方法
7 . 氧化还原反应在生产生活中有广泛的应用,中国传统文化中有广泛记载。
(1)“熬胆矾铁釜,久之亦化为铜”涉及到的化学反应为:CuSO4+Fe=FeSO4+Cu,该反应中CuSO4的摩尔质量是___________ 。28 g铁粉完全反应,析出Cu单质的物质的量为___________ 。
(2)宋代《洗冤集录》中记载有“银针探毒”,其原理是:4Ag+2H2S+O2=2Ag2S+2H2O,在相同条件下体积相同的H2S和O2两种气体原子数之比为___________ ,质量比为___________ 。标准状况下22.4 mL O2中氧原子的物质的量n(O)=___________ mol,当发生上述反应时氧气完全反应,消耗的标准状况下H2S的体积是___________ mL。
(3)我国古代四大发明之一的黑火药是由硫磺粉、硝酸钾和木炭按一定比例混合而成的,爆炸时发生的反应为: ,在此反应中,被还原的元素为
,在此反应中,被还原的元素为___________ (填元素符号),氧化产物是___________ (填化学式),6.4gS参加反应时,产生气体的体积为___________ L(标况下),反应中被S氧化的C的物质的量为___________ mol。
(1)“熬胆矾铁釜,久之亦化为铜”涉及到的化学反应为:CuSO4+Fe=FeSO4+Cu,该反应中CuSO4的摩尔质量是
(2)宋代《洗冤集录》中记载有“银针探毒”,其原理是:4Ag+2H2S+O2=2Ag2S+2H2O,在相同条件下体积相同的H2S和O2两种气体原子数之比为
(3)我国古代四大发明之一的黑火药是由硫磺粉、硝酸钾和木炭按一定比例混合而成的,爆炸时发生的反应为:
 ,在此反应中,被还原的元素为
,在此反应中,被还原的元素为
您最近一年使用:0次
2022-11-14更新
|
295次组卷
|
2卷引用:章末检测卷(二) 元素与物质世界
8 . 下列反应中电子转移的方向和数目表示正确的是
A.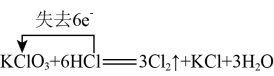 | B.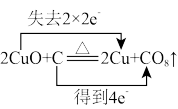 |
C. | D.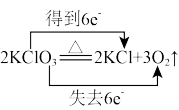 |
您最近一年使用:0次
2022-11-12更新
|
505次组卷
|
5卷引用:章末检测卷(二) 元素与物质世界
2022高三·全国·专题练习
9 . 在2.8gFe中加入100mL3mol/LHCl,Fe完全溶解。NA代表阿伏加德罗常数的值,下列说法正确的是
| A.反应转移电子为0.1mol | B.HCl溶液中 数为3NA 数为3NA |
C.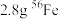 含有的中子数为1.3NA 含有的中子数为1.3NA | D.反应生成标准状况下气体3.36L |
您最近一年使用:0次
2022-07-04更新
|
7991次组卷
|
18卷引用:【知识图鉴】单元讲练测必修第一册第三单元03巩固练
(已下线)【知识图鉴】单元讲练测必修第一册第三单元03巩固练(已下线)第一部分 二轮专题突破 专题2 “阿伏加德罗常数”的应用(已下线)回归教材重难点03 “NA”应用再思考-【查漏补缺】2023年高考化学三轮冲刺过关(新高考专用)(已下线)题型4 阿伏伽德罗常数的综合应用-高考必备50个题型(已下线)考点08 物质的量在化学方程式计算中的应用(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)考点03 物质的量浓度及溶液配制(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)专题03 化学计量-2023年高考化学真题题源解密(全国通用)(已下线)专题03 阿伏加德罗常数与化学计算 -2023年高考化学真题题源解密(新高考专用)江西省宜春市百树学校2023-2024学年高三上学期11月期中考试化学试卷(已下线)专题02 化学计量与化学计算-2022年高考真题模拟题分项汇编2022年海南省高考真题化学试题(已下线)2022年海南省高考真题变式题1-14(已下线)第04讲 物质的量 气体摩尔体积 (讲)-2023年高考化学一轮复习讲练测(新教材新高考)湖北省华中师范大学第一附属中学2022-2023学年高一上学期新生入学测试化学试题(已下线)易错点04 氧化还原反应-备战2023年高考化学考试易错题(已下线)专题02 阿伏加德罗常数及其化学计算 (讲)-2023年高考化学二轮复习讲练测(新高考专用)河北省保定市2022-2023学年高一上学期期末调研考试化学试题(已下线)题型02 阿伏加德罗常数的判断-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)
21-22高一下·山东日照·期中
10 . 碘是人体生长发育不可缺少的微量元素,海带中富含碘元素,从海带中提取碘的工艺流程如下。回答下列问题:

(1)步骤①中发生反应的离子方程式为_______ ,当生成0.3molI2时,转移电子的物质的量为_______ mol。
(2)向含有I2的水溶液中加入CCl4振荡静置后的实验现象为_______ 。
(3)步骤③中发生反应的化学方程式为_______ 。
(4)步骤⑤的实验操作名称为_______ 。
(5)步骤③④是利用化学转化法将富集在四氯化碳中的碘单质重新富集在水中,该方法称为_______ 法。

(1)步骤①中发生反应的离子方程式为
(2)向含有I2的水溶液中加入CCl4振荡静置后的实验现象为
(3)步骤③中发生反应的化学方程式为
(4)步骤⑤的实验操作名称为
(5)步骤③④是利用化学转化法将富集在四氯化碳中的碘单质重新富集在水中,该方法称为
您最近一年使用:0次



