20-21高一下·广东潮州·阶段练习
名校
解题方法
1 . 利用物质类别及核心元素的化合价推测物质的性质是化学研究的重要手段。如图是硫元素的常见化合价与部分物质类别的对应关系。回答下列问题:
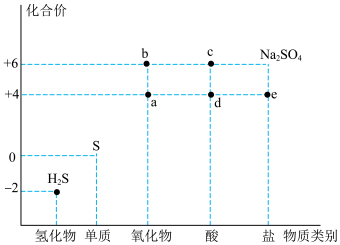
(1)质量相同的a和b,物质的量之比为_______ 。
(2)c的浓溶液能与S反应产生一种气体,该气体的化学式为_______ 。
(3)将足量的a通入 溶液中,下列说法正确的是
溶液中,下列说法正确的是_______ (填标号)。
A.溶液中出现白色沉淀
B.溶液没有明显变化
C.若再通入 或
或 ,则溶液中均会出现白色沉淀
,则溶液中均会出现白色沉淀
(4)根据“价类二维图”,下列能与a反应且使a表现还原性的物质是_______ (填序号)。
①NaOH溶液 ② 溶液 ③
溶液 ③ 溶液 ④酸性
溶液 ④酸性 溶液
溶液
(5)宋代著名法医学家宋慈的《洗冤集录》中有“银针验毒”的记载,“银针验毒”的原理是: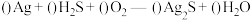 。配平该反应方程式并用单线桥法表示该反应电子转移情况
。配平该反应方程式并用单线桥法表示该反应电子转移情况_______ 。
(6)已知e为正盐,且能被酸性 氧化为
氧化为 ,
, 被还原为
被还原为 ,写出此反应的离子方程式:
,写出此反应的离子方程式:_______ 。

(1)质量相同的a和b,物质的量之比为
(2)c的浓溶液能与S反应产生一种气体,该气体的化学式为
(3)将足量的a通入
 溶液中,下列说法正确的是
溶液中,下列说法正确的是A.溶液中出现白色沉淀
B.溶液没有明显变化
C.若再通入
 或
或 ,则溶液中均会出现白色沉淀
,则溶液中均会出现白色沉淀(4)根据“价类二维图”,下列能与a反应且使a表现还原性的物质是
①NaOH溶液 ②
 溶液 ③
溶液 ③ 溶液 ④酸性
溶液 ④酸性 溶液
溶液(5)宋代著名法医学家宋慈的《洗冤集录》中有“银针验毒”的记载,“银针验毒”的原理是:
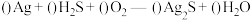 。配平该反应方程式并用单线桥法表示该反应电子转移情况
。配平该反应方程式并用单线桥法表示该反应电子转移情况(6)已知e为正盐,且能被酸性
 氧化为
氧化为 ,
, 被还原为
被还原为 ,写出此反应的离子方程式:
,写出此反应的离子方程式:
您最近一年使用:0次
名校
解题方法
2 . 高铼酸铵( )是一种重要的化工原料,能用于制各石化工业炼油厂的重整催化剂。以钼精矿(主要成分有
)是一种重要的化工原料,能用于制各石化工业炼油厂的重整催化剂。以钼精矿(主要成分有 、
、 ,还含有
,还含有 、
、 、
、 、
、 等杂质)为原料制各
等杂质)为原料制各 的工艺流程图如下。
的工艺流程图如下。
①“氧压碱浸”的主要产物有 、
、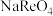 、
、 ;
;
②“水相1”中的阴离子主要是 和
和 ;
;
③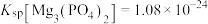 。
。
回答下列问题:
(1)Mo位于元素周期表的第五周期第ⅥB族,其价层电子排布为_______ ; 的主要用途有(写一点)
的主要用途有(写一点)______________ 。
(2)“氧压碱浸”在高温条件下进行,写出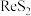 转化为
转化为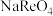 的化学方程式:
的化学方程式:______________ 。
(3)“调酸”的pH大约为5,则“滤渣2”的主要成分为_______ (填化学式)。
(4)若“萃取”发生的反应为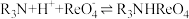 ,则“反萃取”的化学方程式为
,则“反萃取”的化学方程式为______________ 。
(5)“除磷”过程中按物质的量之比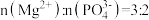 加入
加入 ,充分反应后,
,充分反应后,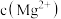 =
=_______  。
。
(6)“操作X”的具体操作为_______ ,过滤、洗涤、干燥,即可得到 晶体。
晶体。
 )是一种重要的化工原料,能用于制各石化工业炼油厂的重整催化剂。以钼精矿(主要成分有
)是一种重要的化工原料,能用于制各石化工业炼油厂的重整催化剂。以钼精矿(主要成分有 、
、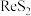 ,还含有
,还含有 、
、 、
、 、
、 等杂质)为原料制各
等杂质)为原料制各 的工艺流程图如下。
的工艺流程图如下。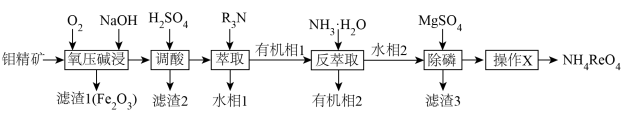
①“氧压碱浸”的主要产物有
 、
、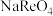 、
、 ;
;②“水相1”中的阴离子主要是
 和
和 ;
;③
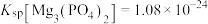 。
。回答下列问题:
(1)Mo位于元素周期表的第五周期第ⅥB族,其价层电子排布为
 的主要用途有(写一点)
的主要用途有(写一点)(2)“氧压碱浸”在高温条件下进行,写出
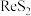 转化为
转化为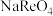 的化学方程式:
的化学方程式:(3)“调酸”的pH大约为5,则“滤渣2”的主要成分为
(4)若“萃取”发生的反应为
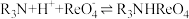 ,则“反萃取”的化学方程式为
,则“反萃取”的化学方程式为(5)“除磷”过程中按物质的量之比
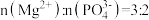 加入
加入 ,充分反应后,
,充分反应后,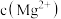 =
= 。
。(6)“操作X”的具体操作为
 晶体。
晶体。
您最近一年使用:0次
2024·重庆·模拟预测
3 . 叠氮化钠(NaN3)在防腐、有机合成和汽车行业有着广泛的用途。用氨基钠(NaNH2)制取叠氮化钠的方程式为: 实验室用下列装置制取叠氮化钠。
实验室用下列装置制取叠氮化钠。
(1)仪器a的名称是_______ 。
(2)装置B、D的主要作用分别是_______ 。
(3)检查装置A的气密性的操作是_______ 。
(4)装置A中反应除生成装置C中需要的物质外,还生成SnCl4等。其反应的化学方程式为_______ 。
(5)装置C处充分反应后,应先停止加热,再关闭分液漏斗活塞,原因是_______ 。
(6)取mg反应后装置C中所得固体,用下图所示装置测定产品的纯度(原理为:加入ClO将N1氧化成N2,测定N2的体积,从而计算产品纯度)。_______ 。
②若G的初始读数为V1mL、末读数为V2mL,本实验条件下气体摩尔体积为VL·mol-1,则产品中NaN3的质量分数为_______ 。
 实验室用下列装置制取叠氮化钠。
实验室用下列装置制取叠氮化钠。
(1)仪器a的名称是
(2)装置B、D的主要作用分别是
(3)检查装置A的气密性的操作是
(4)装置A中反应除生成装置C中需要的物质外,还生成SnCl4等。其反应的化学方程式为
(5)装置C处充分反应后,应先停止加热,再关闭分液漏斗活塞,原因是
(6)取mg反应后装置C中所得固体,用下图所示装置测定产品的纯度(原理为:加入ClO将N1氧化成N2,测定N2的体积,从而计算产品纯度)。
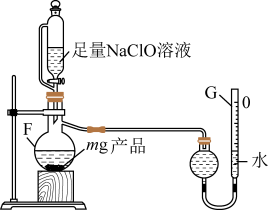
②若G的初始读数为V1mL、末读数为V2mL,本实验条件下气体摩尔体积为VL·mol-1,则产品中NaN3的质量分数为
您最近一年使用:0次
2024高三下·全国·专题练习
解题方法
4 . 磷及其化合物在工农业生产中具有重要用途。回答下列问题:
(1)提纯白磷样品(含惰性杂质)的工艺流程如图所示。过程I中,被还原的元素是___________ (填元素符号),过程III的化学方程式为___________ 。

(2)磷酸钒锂/碳复合材料[Li3V2(PO4)3/C]是常用的电极材料,其制备流程如下:

V2O5与H2C2O4反应生成V2(C2O4)3的化学方程式为___________ 。
(1)提纯白磷样品(含惰性杂质)的工艺流程如图所示。过程I中,被还原的元素是

(2)磷酸钒锂/碳复合材料[Li3V2(PO4)3/C]是常用的电极材料,其制备流程如下:

V2O5与H2C2O4反应生成V2(C2O4)3的化学方程式为
您最近一年使用:0次
23-24高三上·江苏盐城·期中
名校
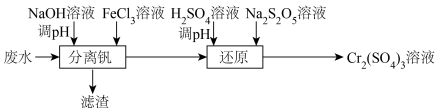
5 . 铬和钒具有广泛用途。从含高价钒(Ⅴ)、铬(Ⅵ)废水中提取铬和钒的一种流程如下图所示: 存在,再用
存在,再用 溶液沉钒得到钒铁共沉淀物。
溶液沉钒得到钒铁共沉淀物。
①如果用 调节溶液pH,调节pH时就开始发生“沉钒”的原因是
调节溶液pH,调节pH时就开始发生“沉钒”的原因是___________ 。
②下图表示pH=4时不同铁钒摩尔比条件下对钒去除率的影响。当铁钒摩尔比大于2时,钒去除率会再次增大、但增加幅度趋缓,其原因是___________ 。 ,
, 可作为二氧化硫被氧气氧化的催化剂。反应机理如下:
可作为二氧化硫被氧气氧化的催化剂。反应机理如下:
第一步: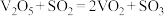 ;
;
第二步:___________ (写化学方程式)。
(2)还原。用 调节溶液pH=2~3,
调节溶液pH=2~3, 以
以 存在,再加入
存在,再加入 溶液还原。
溶液还原。
①写出 还原
还原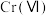 的离子方程式
的离子方程式___________ 。
②若用过氧化氢还原 ,过程中还会生成较稳定的蓝色的过氧化铬(
,过程中还会生成较稳定的蓝色的过氧化铬(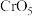 ,Cr为+6价)。
,Cr为+6价)。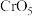 分子中存在过氧键,其结构式可表示为
分子中存在过氧键,其结构式可表示为___________ 。
(3) 的存在形态的物质的量分数随溶液pH的分布如图所示。请补充完整由
的存在形态的物质的量分数随溶液pH的分布如图所示。请补充完整由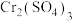 溶液制得
溶液制得 的实验方案:取分离、提纯得到的
的实验方案:取分离、提纯得到的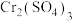 溶液,
溶液,___________ ,低温烘干,得到高纯 晶体。
晶体。须使用 的试剂:蒸馏水、2 NaOH溶液、1.0
NaOH溶液、1.0 HCl溶液、1.0
HCl溶液、1.0
 溶液
溶液
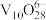 存在,再用
存在,再用 溶液沉钒得到钒铁共沉淀物。
溶液沉钒得到钒铁共沉淀物。①如果用
 调节溶液pH,调节pH时就开始发生“沉钒”的原因是
调节溶液pH,调节pH时就开始发生“沉钒”的原因是②下图表示pH=4时不同铁钒摩尔比条件下对钒去除率的影响。当铁钒摩尔比大于2时,钒去除率会再次增大、但增加幅度趋缓,其原因是

 ,
, 可作为二氧化硫被氧气氧化的催化剂。反应机理如下:
可作为二氧化硫被氧气氧化的催化剂。反应机理如下:第一步:
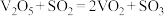 ;
;第二步:
(2)还原。用
 调节溶液pH=2~3,
调节溶液pH=2~3,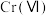 以
以 存在,再加入
存在,再加入 溶液还原。
溶液还原。①写出
 还原
还原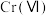 的离子方程式
的离子方程式②若用过氧化氢还原
 ,过程中还会生成较稳定的蓝色的过氧化铬(
,过程中还会生成较稳定的蓝色的过氧化铬(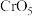 ,Cr为+6价)。
,Cr为+6价)。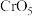 分子中存在过氧键,其结构式可表示为
分子中存在过氧键,其结构式可表示为(3)
 的存在形态的物质的量分数随溶液pH的分布如图所示。请补充完整由
的存在形态的物质的量分数随溶液pH的分布如图所示。请补充完整由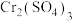 溶液制得
溶液制得 的实验方案:取分离、提纯得到的
的实验方案:取分离、提纯得到的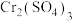 溶液,
溶液, 晶体。
晶体。
 NaOH溶液、1.0
NaOH溶液、1.0 HCl溶液、1.0
HCl溶液、1.0
 溶液
溶液
您最近一年使用:0次
2024高三下·全国·专题练习
6 . 铬和钒具有广泛用途。铬钒渣中铬和钒以低价态含氧酸盐形式存在,主要杂质为铁、铝、硅、磷等的化合物,从铬钒渣中分离提取铬和钒的一种流程如图所示: 形式存在,在碱性介质中以
形式存在,在碱性介质中以 形式存在。
形式存在。
若铬钒渣中铬的含氧酸盐为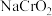 ,则“煅烧”过程中
,则“煅烧”过程中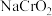 发生反应的化学方程式为
发生反应的化学方程式为___________ 。若在实验室中进行煅烧铬钒渣,___________ (填“能”或“不能”)用陶瓷坩埚,理由是___________ 。

 形式存在,在碱性介质中以
形式存在,在碱性介质中以 形式存在。
形式存在。若铬钒渣中铬的含氧酸盐为
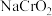 ,则“煅烧”过程中
,则“煅烧”过程中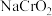 发生反应的化学方程式为
发生反应的化学方程式为
您最近一年使用:0次
7 . 氧化还原反应在工业生产、环保及科研中有广泛的应用。请根据以下信息,结合所掌握的化学知识,回答下列问题:
Ⅰ.可以用智利硝石提取硝酸钠后的母液为原料,加入亚硫酸氢钠制取琪,相关反应如下:___________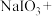 ___________
___________ ___________
___________ ___________
___________ ___________
___________ (未配平)
(未配平)
(1)配平上述化学方程式,用单线桥标出电子转移的方向和数目。___________
Ⅱ.钒性能优良,用途广泛,有金属“维生素”之称。
(2) 能与盐酸反应生成
能与盐酸反应生成 和一种黄绿色气体,该黄绿色气体能与
和一种黄绿色气体,该黄绿色气体能与 溶液反应而被吸收,则
溶液反应而被吸收,则 、
、 、
、 的还原性由强到弱的顺序是
的还原性由强到弱的顺序是___________ 。
(3) 在碳高温还原时,在氮气气氛下氮化还原制备VN,还生成一种具有还原性的气体,则该反应的化学方程式为
在碳高温还原时,在氮气气氛下氮化还原制备VN,还生成一种具有还原性的气体,则该反应的化学方程式为___________ 。
Ⅰ.可以用智利硝石提取硝酸钠后的母液为原料,加入亚硫酸氢钠制取琪,相关反应如下:___________
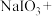 ___________
___________ ___________
___________ ___________
___________ ___________
___________ (未配平)
(未配平)(1)配平上述化学方程式,用单线桥标出电子转移的方向和数目。
Ⅱ.钒性能优良,用途广泛,有金属“维生素”之称。
(2)
 能与盐酸反应生成
能与盐酸反应生成 和一种黄绿色气体,该黄绿色气体能与
和一种黄绿色气体,该黄绿色气体能与 溶液反应而被吸收,则
溶液反应而被吸收,则 、
、 、
、 的还原性由强到弱的顺序是
的还原性由强到弱的顺序是(3)
 在碳高温还原时,在氮气气氛下氮化还原制备VN,还生成一种具有还原性的气体,则该反应的化学方程式为
在碳高温还原时,在氮气气氛下氮化还原制备VN,还生成一种具有还原性的气体,则该反应的化学方程式为
您最近一年使用:0次
2024高三下·全国·专题练习
解题方法
8 . 偏钒酸镁在化工“新型材料”光电领域有着重要的用途。以硼泥[主要成分是MgO(52.12%)还有Fe2O3、FeO、Al2O3、SiO2等杂质]为原料设计制备偏钒酸镁的生产工艺如图所示:

“除杂”过程加入双氧水的目的是___________ (用离子方程式表示)。此过程中使Fe3+、Al3+浓度均小于1×10-6 mol·L-1,在室温下需调节pH的范围是:___________ (已知:Ksp[Fe(OH)3]=1×10-39,Ksp[Al(OH)3]=1×10-33,pH=9.3时,Mg2+开始沉淀)。

“除杂”过程加入双氧水的目的是
您最近一年使用:0次
2024高三下·全国·专题练习
解题方法
9 . 氧化亚铜(Cu2O)用途广泛,干法生产Cu2O粉末的主要工艺流程如下:

(1)粉碎机中,发生的变化属于___________ (填“物理变化”或“化学变化”)。
(2)800~900℃时,煅烧炉中发生化合反应,该反应的化学方程式为___________ 。

(1)粉碎机中,发生的变化属于
(2)800~900℃时,煅烧炉中发生化合反应,该反应的化学方程式为
您最近一年使用:0次
23-24高三上·广东深圳·期末
名校
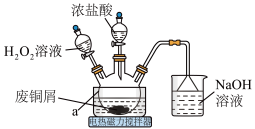
10 . CuCl2是常见的化学试剂,某小组利用废铜屑“湿法”制备CuCl2·2H2O并开展相关探究。
回答下列问题:
(1)仪器a的名称为___________ 。
(2)上述方法制备CuCl2的离子方程式为___________ 。
(3)为得到纯净的CuCl2·2H2O晶体,反应完全后要进行的操作是:除去其他可能的金属离子后,过滤,向滤液中持续通入 气体,加热蒸发浓缩,
气体,加热蒸发浓缩,___________ ,过滤,洗涤,低温干燥。持续通入 气体的目的是
气体的目的是___________ 。
(4)实验中,H2O2的实际用量要大于理论用量,可能因素为:原因1:___________ ;原因2:生成的CuCl2催化了H2O2的分解。
(5)该小组对“原因2”进行拓展探究。为验证CuCl2对H2O2分解的催化作用,该小组向5支盛有10mL5%H2O2的试管中滴加不同溶液,实验记录如下表(忽略溶液体积的微小变化;已知一定条件下,还原产物的浓度越小,氧化剂的氧化性越强):
①实验Ⅳ过程中观察到有白色沉淀(经检验为CuCl)生成,反应的机理表示为
第一步:H2O2+2Cu2++2Cl-=O2↑+2CuCl+2H+;
第二步:___________ (写离子方程式)。
②已知化学反应速率第一步<第二步,则气泡产生速率实验Ⅳ比实验Ⅲ加快的原因:___________ 。
③分析上述实验,下列说法正确的是___________ (填字母)。
A.实验Ⅰ的目的是证明仅有NaCl对H2O2分解没有催化作用
B. 对H2O2分解有显著催化作用
对H2O2分解有显著催化作用
C.Cl-增强了Cu2+对H2O2分解的催化效果,且Cl-浓度越大催化效果越强
④写出一种H2O2的用途___________ 。
| 温度 | 15℃以下 | 15~25.7℃ | 26~42℃ | 42℃以上 |
| 结晶水合物 | CuCl2·4H2O | CuCl2·3H2O | CuCl2·2H2O | CuCl2·H2O |
(1)仪器a的名称为
(2)上述方法制备CuCl2的离子方程式为
(3)为得到纯净的CuCl2·2H2O晶体,反应完全后要进行的操作是:除去其他可能的金属离子后,过滤,向滤液中持续通入
 气体,加热蒸发浓缩,
气体,加热蒸发浓缩, 气体的目的是
气体的目的是(4)实验中,H2O2的实际用量要大于理论用量,可能因素为:原因1:
(5)该小组对“原因2”进行拓展探究。为验证CuCl2对H2O2分解的催化作用,该小组向5支盛有10mL5%H2O2的试管中滴加不同溶液,实验记录如下表(忽略溶液体积的微小变化;已知一定条件下,还原产物的浓度越小,氧化剂的氧化性越强):
| 实验 | Ⅰ | Ⅱ | Ⅲ | Ⅳ | Ⅴ |
| 滴加试剂 | 2滴1mol/LNaCl | 2滴1mol/LNa2SO4 | 2滴1mol/LCuSO4 | 2滴1mol/LCuSO4和2滴1mol/LNaCl | 2滴1mol/LCuSO4和4滴1mol/LNaCl |
| 现象 | 无气泡产生 | 无气泡产生 | 均产生气泡,且气泡速率从Ⅲ到Ⅴ依次加快 | ||
第一步:H2O2+2Cu2++2Cl-=O2↑+2CuCl+2H+;
第二步:
②已知化学反应速率第一步<第二步,则气泡产生速率实验Ⅳ比实验Ⅲ加快的原因:
③分析上述实验,下列说法正确的是
A.实验Ⅰ的目的是证明仅有NaCl对H2O2分解没有催化作用
B.
 对H2O2分解有显著催化作用
对H2O2分解有显著催化作用C.Cl-增强了Cu2+对H2O2分解的催化效果,且Cl-浓度越大催化效果越强
④写出一种H2O2的用途
您最近一年使用:0次



