名校
1 . 自然界中的氮元素以氮气、氮氧化物和硝酸盐等形式存在,人类对氮元素的利用,就是实现氮元素在不同物质之间的转化。
(1)下列有关物质的性质与用途具有对应关系的是_______。
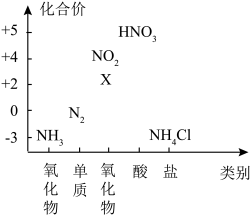
(2)下图为氮元素的价类二维图。下列说法正确的是_______。
(3)为了测定铁铜合金的组成,将15.2 g铁、铜合金加入200 mL某浓度的稀硝酸中,待合金完全溶解后,共收集到NO气体4.48 L(标准状况下),并测得反应后溶液中 的浓度为0.5 mol•L
的浓度为0.5 mol•L ,若反应前后溶液的体积变化忽略不计,则下列判断正确的是_______。
,若反应前后溶液的体积变化忽略不计,则下列判断正确的是_______。
(4)浓、稀硝酸的性质既相似又有差别,若要除去铁制品表面的铜镀层应选择_____ (填“浓”或“稀”)硝酸,原因是_______ 。
(5)①氨气是生产氮肥的主要原料,其电子式为_______ 。
②工业合成氨的化学方程式为_______ 。
③检验铵态氮肥中 的实验方案是
的实验方案是_______ 。
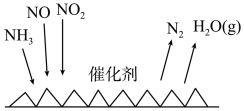
(6) 催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如下图所示。当
催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如下图所示。当 与NO的物质的量之比为1∶1时与足量氨气在一定条件下发生脱氮反应。该反应的化学方程式为
与NO的物质的量之比为1∶1时与足量氨气在一定条件下发生脱氮反应。该反应的化学方程式为_______ 。
(1)下列有关物质的性质与用途具有对应关系的是_______。
A. 易溶于水,可用作制冷剂 易溶于水,可用作制冷剂 | B. 具有强氧化性,可用于制 具有强氧化性,可用于制 |
C. 受热易分解,可用作化肥 受热易分解,可用作化肥 | D. 性质稳定,可用于食品保护 性质稳定,可用于食品保护 |

| A.X属于酸性氧化物 |
B. 转化为 转化为 一定需要加入氧化剂 一定需要加入氧化剂 |
C.一定条件下, 和 和 反应可以转化成 反应可以转化成 |
D.实验室采用加热分解 固体制取 固体制取 |
 的浓度为0.5 mol•L
的浓度为0.5 mol•L ,若反应前后溶液的体积变化忽略不计,则下列判断正确的是_______。
,若反应前后溶液的体积变化忽略不计,则下列判断正确的是_______。A.反应后溶液中可能存在的金属阳离子有: 、 、 和 和 |
B.上述合金中铁与铜物质的量之比为 |
| C.反应后的溶液中可继续溶解铁铜合金质量最多为1.9 g |
D.原硝酸的物质的量浓度为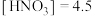 mol⋅L-1 mol⋅L-1 |
(5)①氨气是生产氮肥的主要原料,其电子式为
②工业合成氨的化学方程式为
③检验铵态氮肥中
 的实验方案是
的实验方案是(6)
 催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如下图所示。当
催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如下图所示。当 与NO的物质的量之比为1∶1时与足量氨气在一定条件下发生脱氮反应。该反应的化学方程式为
与NO的物质的量之比为1∶1时与足量氨气在一定条件下发生脱氮反应。该反应的化学方程式为
您最近一年使用:0次
名校
2 . 利用元素的化合价推测物质的性质是化学研究的重要手段。如图是硫元素的常见化合价与部分物质类别的对应关系:
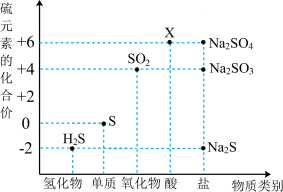
(1)X的浓溶液与碳在一定条件下可以发生反应,体现了X的___________ 性。从硫元素化合价变化的角度分析,图中只有还原性的物质有___________ (填化学式)。
(2)收集了一些含有S元素的酸雨,放置一段时间后,pH变小,小攀认为可能是因为酸雨中的亚硫酸被氧化为了___________ 。小登觉得可以设计实验验证这一推论,具体操作是___________ 。
(3)配平下列反应:___________
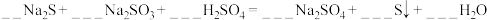 。
。
(4)如图是验证二氧化硫性质的实验装置。
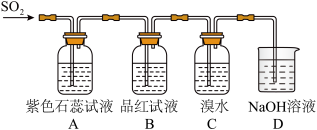
二氧化硫具有:①漂白性、②酸性氧化物性质、③还原性、④氧化性,上述装置中对应表现出的性质是:A中___________ (填序号,下同);B中___________ ;C中___________ 。D装置的作用是___________ 。

(1)X的浓溶液与碳在一定条件下可以发生反应,体现了X的
(2)收集了一些含有S元素的酸雨,放置一段时间后,pH变小,小攀认为可能是因为酸雨中的亚硫酸被氧化为了
(3)配平下列反应:
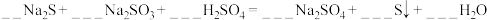 。
。(4)如图是验证二氧化硫性质的实验装置。

二氧化硫具有:①漂白性、②酸性氧化物性质、③还原性、④氧化性,上述装置中对应表现出的性质是:A中
您最近一年使用:0次
名校
3 . 如图是硫元素的常见化合价与部分物质类别的对应关系。请回答下列问题。
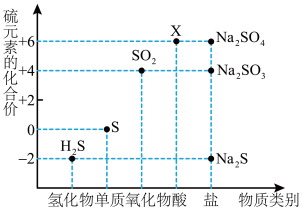
(1)X 的浓溶液与碳在一定条件下可以发生反应,体现了 X 的_______ 性。
(2)仅从硫元素化合价变化的角度分析,图中只有还原性的物质有_______ (填化学式)。
(3)将 H2S 与 SO2混合可生成淡黄色沉淀。该反应中氧化产物与还原产物的物质的量之比为_______ 。
(4)配平下列反应,并用单线桥法标出电子转移的方向和数目______ 。
Na2S+_______Na2SO3+_______H2SO4=_______Na2SO4+_______S↓+_______H2O
(5)下列关于硫及其化合物的叙述正确的是
(6)设 NA为阿伏加德罗常数的值。下列说法正确的是
为了证明铁和硫反应产物中铁的化合价,下面是某同学设计的实验过程的一部分:
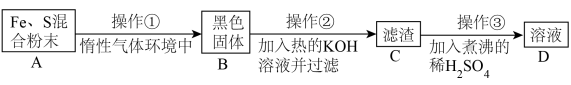
请回答以下问题:
(7)操作②的作用是_______ ,也可改用_______ 。
(8)混合粉末 A 中硫粉过量的原因是_______ 。
(9)下列溶液中通入SO2一定不会产生沉淀的是
(10)区别浓H2SO4和稀H2SO4,既简单又可靠的方法是

(1)X 的浓溶液与碳在一定条件下可以发生反应,体现了 X 的
(2)仅从硫元素化合价变化的角度分析,图中只有还原性的物质有
(3)将 H2S 与 SO2混合可生成淡黄色沉淀。该反应中氧化产物与还原产物的物质的量之比为
(4)配平下列反应,并用单线桥法标出电子转移的方向和数目
Na2S+_______Na2SO3+_______H2SO4=_______Na2SO4+_______S↓+_______H2O
(5)下列关于硫及其化合物的叙述正确的是
| A.试管内壁残留的硫可用酒精洗涤 | B.SO2的水溶液长期放置,酸性会增强 |
| C.SO2有毒,不可以做食品添加剂 | D.浓硫酸在空气中敞口放置,质量会减小 |
| A.1mol 铁单质与足量的硫单质充分反应,转移电子的数目为3NA |
| B.常温下,22.4LSO2与足量的O2反应,生成的SO3分子数为NA |
| C.常温下,将5.6g铁片投入足量的浓硫酸中,铁失去的电子数为0.3NA |
| D.1 molNa2O2与足量H2O反应,转移的电子数为NA |
为了证明铁和硫反应产物中铁的化合价,下面是某同学设计的实验过程的一部分:

请回答以下问题:
(7)操作②的作用是
(8)混合粉末 A 中硫粉过量的原因是
(9)下列溶液中通入SO2一定不会产生沉淀的是
| A.Ba(OH)2 | B.澄清石灰水 | C.Na2S | D.BaCl2 |
| A.各取少许溶液分别放入铜片 | B.分别与石蕊试液作用 |
| C.用玻璃棒各蘸少许液涂在纸上 | D.观察溶液的颜色 |
您最近一年使用:0次
4 . 氯及其化合物在日常生活中有广泛应用。某实验小组设计多组实验,对氯气及氯的化合物的性质进行研究
I.氯气的制备与性质研究
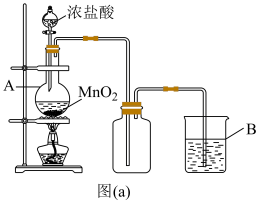
(1)实验室中常用如图(a)所示的装置制备氯气,反应的化学方程式为___________ 。
(2)图中仪器A的名称是___________ 。
(3)装置B内的溶液可以是___________ 。
(4)实验室中常用图(b)所示的装置制备氯气,并同时得到较浓的烧碱溶液。
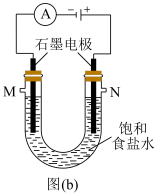
①图(b)反应的化学方程式为___________ 。
②检验制得的烧碱溶液中是否含有NaCl的实验方法是___________ 。
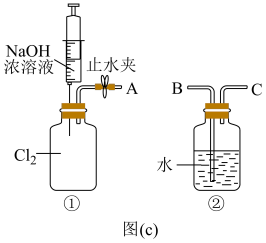
③用图(c)所示的组合装置验证氯气与烧碱溶液的反应。将A与B连接,打开止水夹,用注射器注入过量NaOH浓溶液,观察到的现象有___________ ;若其它操作不变,将A与C连接,②中观察到的现象有___________ 。
Ⅱ.次氯酸是重要的含氯化合物,应用于杀菌消毒、漂白等领域。学习小组以Cl2O为原料制备HClO。
i.常温常压下Cl2O是一种黄绿色气体
ii.将氯气和空气(不参与反应)通入足量的Na2CO3溶液,发生反应生成Cl2O。
iii.Cl2O易溶于水并与水立即反应生成HClO
iv.已知:HClO+2I-+H+=I2+Cl-+H2O,I2+2 =2I-+
=2I-+
(5)装置③中的液体不可燃、不助燃也不导电,关于其用途正确的是___________。
(6)各装置的连接顺序为___________ 。
①→___________→___________→___________→___________
(7)装置②中发生的化学反应中氧化产物与还原产物的物质的量之比为___________ 。
(8)装置④的作用有___________ 。(至少写出2点)
I.氯气的制备与性质研究

(1)实验室中常用如图(a)所示的装置制备氯气,反应的化学方程式为
(2)图中仪器A的名称是
(3)装置B内的溶液可以是
(4)实验室中常用图(b)所示的装置制备氯气,并同时得到较浓的烧碱溶液。

①图(b)反应的化学方程式为
②检验制得的烧碱溶液中是否含有NaCl的实验方法是
③用图(c)所示的组合装置验证氯气与烧碱溶液的反应。将A与B连接,打开止水夹,用注射器注入过量NaOH浓溶液,观察到的现象有

Ⅱ.次氯酸是重要的含氯化合物,应用于杀菌消毒、漂白等领域。学习小组以Cl2O为原料制备HClO。

i.常温常压下Cl2O是一种黄绿色气体
ii.将氯气和空气(不参与反应)通入足量的Na2CO3溶液,发生反应生成Cl2O。
iii.Cl2O易溶于水并与水立即反应生成HClO
iv.已知:HClO+2I-+H+=I2+Cl-+H2O,I2+2
 =2I-+
=2I-+
(5)装置③中的液体不可燃、不助燃也不导电,关于其用途正确的是___________。
| A.可浮于水溶液上方——隔绝空气 | B.与水互不相溶——萃取剂 |
| C.可隔绝空气——灭火剂 | D.遇碘变色——指示剂 |
(6)各装置的连接顺序为
①→___________→___________→___________→___________
(7)装置②中发生的化学反应中氧化产物与还原产物的物质的量之比为
(8)装置④的作用有
您最近一年使用:0次
名校
解题方法
5 . 亚硝酸钠 是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。亚硝酸钠加热到320℃以上会分解产生
是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。亚硝酸钠加热到320℃以上会分解产生 、
、 和
和 ,其水溶液呈碱性,能与
,其水溶液呈碱性,能与 溶液反应生成难溶于水、易溶于酸的
溶液反应生成难溶于水、易溶于酸的 。由于
。由于 有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下;
有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下;
________ ________
________ ________=________
________=________ ________
________ ________
________ ________
________ ________
________
(1)补充并配平该化学方程式______ (若系数为1,请标注“1”)。
(2)从物质分类角度来看, 是
是________ (填字母)。
a.酸 b.酸式盐 c.碱 d.非电解质
e.电解质 f.离子化合物 g.共价化合物
(3)用上述反应来处理 并不是最佳方法,其原因是
并不是最佳方法,其原因是________ 。
(4)下列方法不能用来区分固体 和NaCl的是________(填字母)。
和NaCl的是________(填字母)。
(5)误食 会导致人体血红蛋白中的
会导致人体血红蛋白中的 转化为
转化为 而中毒,该过程中
而中毒,该过程中 表现出的性质与下列________(填字母)反应中
表现出的性质与下列________(填字母)反应中 表现出的性质相同。
表现出的性质相同。
(6)已知亚硝酸钠可以与氯化铵反应生成氮气和氯化钠,写出该反应的化学方程式,并用单线桥表示其电子转移的方向和数目:________ 。
 是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。亚硝酸钠加热到320℃以上会分解产生
是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。亚硝酸钠加热到320℃以上会分解产生 、
、 和
和 ,其水溶液呈碱性,能与
,其水溶液呈碱性,能与 溶液反应生成难溶于水、易溶于酸的
溶液反应生成难溶于水、易溶于酸的 。由于
。由于 有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下;
有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下;________
 ________
________ ________=________
________=________ ________
________ ________
________ ________
________ ________
________
(1)补充并配平该化学方程式
(2)从物质分类角度来看,
 是
是a.酸 b.酸式盐 c.碱 d.非电解质
e.电解质 f.离子化合物 g.共价化合物
(3)用上述反应来处理
 并不是最佳方法,其原因是
并不是最佳方法,其原因是(4)下列方法不能用来区分固体
 和NaCl的是________(填字母)。
和NaCl的是________(填字母)。| A.分别溶于水 | B.分别溶于水并滴加 酸化的 酸化的 溶液 溶液 |
| C.分别加强热并收集气体检验 | D.用筷子分别蘸取固体品尝味道 |
 会导致人体血红蛋白中的
会导致人体血红蛋白中的 转化为
转化为 而中毒,该过程中
而中毒,该过程中 表现出的性质与下列________(填字母)反应中
表现出的性质与下列________(填字母)反应中 表现出的性质相同。
表现出的性质相同。A. |
B. |
C.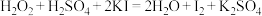 |
D.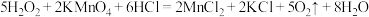 |
您最近一年使用:0次
名校
解题方法
6 . 亚硝酸钠( )是一种用途广泛的工业盐,因其外观和食盐相似,有咸味,容易误食中毒。由于
)是一种用途广泛的工业盐,因其外观和食盐相似,有咸味,容易误食中毒。由于 有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:_______
有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:_______ _______
_______ _______
_______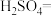 _______
_______ _______
_______ _______
_______ _______
_______ _______
_______ ;完成下列填空:
;完成下列填空:
(1)请配平上述化学反应并标出电子转移的方向和数目_______ :从物质分类角度来看, 属于
属于_______ (填字母)。
a.酸 b.酸式盐 c.正盐 d.碱方程式
氧化剂与还原剂的物质的量之比为_______ 。
(2)误食 会导致人体血红蛋白中的
会导致人体血红蛋白中的 转化为
转化为 而中毒,该过程中
而中毒,该过程中 表现出的性质与下列_______(填字母)反应中
表现出的性质与下列_______(填字母)反应中 表现出的性质完全相同。
表现出的性质完全相同。
 )是一种用途广泛的工业盐,因其外观和食盐相似,有咸味,容易误食中毒。由于
)是一种用途广泛的工业盐,因其外观和食盐相似,有咸味,容易误食中毒。由于 有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:_______
有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:_______ _______
_______ _______
_______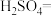 _______
_______ _______
_______ _______
_______ _______
_______ _______
_______ ;完成下列填空:
;完成下列填空:(1)请配平上述化学反应并标出电子转移的方向和数目
 属于
属于a.酸 b.酸式盐 c.正盐 d.碱方程式
氧化剂与还原剂的物质的量之比为
(2)误食
 会导致人体血红蛋白中的
会导致人体血红蛋白中的 转化为
转化为 而中毒,该过程中
而中毒,该过程中 表现出的性质与下列_______(填字母)反应中
表现出的性质与下列_______(填字母)反应中 表现出的性质完全相同。
表现出的性质完全相同。A. |
B. |
C. |
D. |
您最近一年使用:0次
22-23高一下·上海浦东新·期中
名校
解题方法
7 . 钠元素在自然界中都以化合物的形式存在,钠的单质和化合物用途广泛,回答下列问题:
(1)采用空气和Na为原料可制备 。空气与熔融的金属Na反应前需依次通过的试剂为
。空气与熔融的金属Na反应前需依次通过的试剂为___________ 、___________ (选填编号)。
a.浓硫酸 b.饱和食盐水 c.NaOH溶液 d. 溶液
溶液
(2)向酸性 溶液中加入
溶液中加入 粉末,观察到溶液褪色,发生如下反应:___________
粉末,观察到溶液褪色,发生如下反应:___________ ___________
___________ ___________
___________ ___________
___________ ___________
___________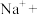 ___________
___________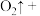 ___________。配平上述离子方程式,并用单线桥法表示电子转移的方向和数目
___________。配平上述离子方程式,并用单线桥法表示电子转移的方向和数目___________ 。该反应说明 具有
具有___________ (选填“氧化性”“还原性”或“漂白性”)。
某研究性学习小组的同学,为测定某种含有少量氧化钠的过氧化钠试样中过氧化钠的含量,称取w g样品与足量的水反应,测定生成气体在通常状况(约20℃,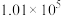 Pa)的体积,设计了如图所示的实验装置进行探究
Pa)的体积,设计了如图所示的实验装置进行探究
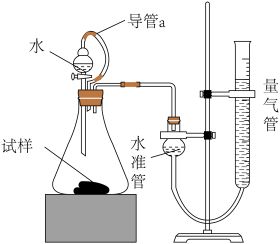
回答下列问题:
(3)装置中导管a的作用是___________ 。
(4)反应前后量气管中液面读数分别为 mL、
mL、 mL(实验条件下的气体摩尔体积为
mL(实验条件下的气体摩尔体积为 L/mol),试计算试样中过氧化钠的质量分数:
L/mol),试计算试样中过氧化钠的质量分数:___________ 。
(5)通过实验,测得该试样中过氧化钠质量分数偏高,产生这种现象的原因可能是___________ (选填编号)。
a.反应后测定气体体积时水准管的水面低于量气管的水面
b.锥形瓶中留有反应生成的气体
c.测定气体体积时未冷却至室温
(1)采用空气和Na为原料可制备
 。空气与熔融的金属Na反应前需依次通过的试剂为
。空气与熔融的金属Na反应前需依次通过的试剂为a.浓硫酸 b.饱和食盐水 c.NaOH溶液 d.
 溶液
溶液(2)向酸性
 溶液中加入
溶液中加入 粉末,观察到溶液褪色,发生如下反应:___________
粉末,观察到溶液褪色,发生如下反应:___________ ___________
___________ ___________
___________ ___________
___________ ___________
___________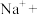 ___________
___________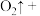 ___________。配平上述离子方程式,并用单线桥法表示电子转移的方向和数目
___________。配平上述离子方程式,并用单线桥法表示电子转移的方向和数目 具有
具有某研究性学习小组的同学,为测定某种含有少量氧化钠的过氧化钠试样中过氧化钠的含量,称取w g样品与足量的水反应,测定生成气体在通常状况(约20℃,
 Pa)的体积,设计了如图所示的实验装置进行探究
Pa)的体积,设计了如图所示的实验装置进行探究
回答下列问题:
(3)装置中导管a的作用是
(4)反应前后量气管中液面读数分别为
 mL、
mL、 mL(实验条件下的气体摩尔体积为
mL(实验条件下的气体摩尔体积为 L/mol),试计算试样中过氧化钠的质量分数:
L/mol),试计算试样中过氧化钠的质量分数:(5)通过实验,测得该试样中过氧化钠质量分数偏高,产生这种现象的原因可能是
a.反应后测定气体体积时水准管的水面低于量气管的水面
b.锥形瓶中留有反应生成的气体
c.测定气体体积时未冷却至室温
您最近一年使用:0次
21-22高一下·上海浦东新·阶段练习
8 . 亚硝酸钠( )是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。亚硝酸钠加热到320℃以上会分解产生
)是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。亚硝酸钠加热到320℃以上会分解产生 、
、 和
和 ,其水溶液呈碱性,能与
,其水溶液呈碱性,能与 溶液反应生成难溶于水、易溶于酸的
溶液反应生成难溶于水、易溶于酸的 。由于
。由于 有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:
有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:
___________ ___________KI+___________=___________NO↑+___________
___________KI+___________=___________NO↑+___________ ___________
___________ ___________
___________ ___________
___________
(1)请完成该化学方程式并配平。___________
(2)从物质分类角度来看, 是
是___________ (填字母代号)。
a.酸 b.酸式盐 c.碱 d.非电解质 e.电解质 f.离子化合物 g.共价化合物
(3)用上述反应来处理 并不是最佳方法,其原因是
并不是最佳方法,其原因是___________ 。从环保角度来讲,要将 转化为氮气,所用物质的
转化为氮气,所用物质的___________ (填“氧化性”或“还原性”)应该比KI更___________ (填“强”或“弱”)。
(4)下列方法不能用来区分固体 和NaCl的是___________(填序号)。
和NaCl的是___________(填序号)。
(5)误食 会导致人体血红蛋白中的
会导致人体血红蛋白中的 转化为
转化为 而中毒,该过程中
而中毒,该过程中 表现出的性质与下列___________(填序号)反应中
表现出的性质与下列___________(填序号)反应中 表现出的性质相同。
表现出的性质相同。
(6)已知亚硝酸钠可以与氯化铵反应生成氮气和氯化钠,写出该反应的化学反应方程式,并用单线桥表示其电子转移的方向和数目:___________ 。
 )是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。亚硝酸钠加热到320℃以上会分解产生
)是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。亚硝酸钠加热到320℃以上会分解产生 、
、 和
和 ,其水溶液呈碱性,能与
,其水溶液呈碱性,能与 溶液反应生成难溶于水、易溶于酸的
溶液反应生成难溶于水、易溶于酸的 。由于
。由于 有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:
有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:___________
 ___________KI+___________=___________NO↑+___________
___________KI+___________=___________NO↑+___________ ___________
___________ ___________
___________ ___________
___________
(1)请完成该化学方程式并配平。
(2)从物质分类角度来看,
 是
是a.酸 b.酸式盐 c.碱 d.非电解质 e.电解质 f.离子化合物 g.共价化合物
(3)用上述反应来处理
 并不是最佳方法,其原因是
并不是最佳方法,其原因是 转化为氮气,所用物质的
转化为氮气,所用物质的(4)下列方法不能用来区分固体
 和NaCl的是___________(填序号)。
和NaCl的是___________(填序号)。| A.分别溶于水 |
B.分别溶于水并滴加 酸化的 酸化的 溶液 溶液 |
| C.分别加强热并收集气体检验 |
| D.用筷子分别蘸取固体品尝味道 |
 会导致人体血红蛋白中的
会导致人体血红蛋白中的 转化为
转化为 而中毒,该过程中
而中毒,该过程中 表现出的性质与下列___________(填序号)反应中
表现出的性质与下列___________(填序号)反应中 表现出的性质相同。
表现出的性质相同。A. |
B. |
C. |
D. |
您最近一年使用:0次
21-22高一上·上海浦东新·期中
名校
解题方法
9 . 储氢纳米碳管具有广泛的用途,电弧法合成的碳纳米管常伴有大量的杂质碳纳米颗粒,这种碳钠来颗粒可用氧化气化法提纯,反应的化学方程式如下(未配平):




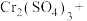

回答下列问题:
(1)配平上述反应方程式,并标出电子转移方向和数目___________ 。
(2) 在该反应中表现出___________(填标号)。
在该反应中表现出___________(填标号)。
(3)生成物中属于非电解质的有___________ 。
磷酸( )、次磷酸(
)、次磷酸( )是精细磷化工产品,均属于中强酸,磷酸为三元酸,而次磷酸为一元酸。回答下列问题:
)是精细磷化工产品,均属于中强酸,磷酸为三元酸,而次磷酸为一元酸。回答下列问题:
(4)① 及
及 均可将溶液中的
均可将溶液中的 还原为银,从而可用于化学镀银。从物质的分类来看,
还原为银,从而可用于化学镀银。从物质的分类来看, 属于
属于___________ (填标号)。
a.正盐 b.酸式盐 c.钠盐 d.氧化物
②写出 与足量NaOH溶液反应的离子方程式
与足量NaOH溶液反应的离子方程式___________ 。
(5)实验室可以用浓磷酸与NaBr(s)加热反应制取HBr气体,利用了浓磷酸的___________ 性,能否用浓硫酸代替浓磷酸制取HBr?说明理由___________ 。





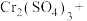

回答下列问题:
(1)配平上述反应方程式,并标出电子转移方向和数目
(2)
 在该反应中表现出___________(填标号)。
在该反应中表现出___________(填标号)。| A.只有酸性 | B.只有氧化性 |
| C.酸性和氧化性 | D.酸性和还原性 |
磷酸(
 )、次磷酸(
)、次磷酸( )是精细磷化工产品,均属于中强酸,磷酸为三元酸,而次磷酸为一元酸。回答下列问题:
)是精细磷化工产品,均属于中强酸,磷酸为三元酸,而次磷酸为一元酸。回答下列问题:(4)①
 及
及 均可将溶液中的
均可将溶液中的 还原为银,从而可用于化学镀银。从物质的分类来看,
还原为银,从而可用于化学镀银。从物质的分类来看, 属于
属于a.正盐 b.酸式盐 c.钠盐 d.氧化物
②写出
 与足量NaOH溶液反应的离子方程式
与足量NaOH溶液反应的离子方程式(5)实验室可以用浓磷酸与NaBr(s)加热反应制取HBr气体,利用了浓磷酸的
您最近一年使用:0次
名校
解题方法
10 . 含氯化合物在日常生活中有多种用途,根据要求完成下列问题:
(1)漂粉精的成分是____________ ,工业上使用漂粉精时,会加入少量的稀盐酸,以加快其漂白速率,发生反应的方程式为___________ 。家庭中使用漂白粉时,不加酸也可漂白,反应的化学方程式为______ 。
(2)84消毒液的成分为NaClO,写出氯气与NaOH反应的化学方程式:___________ 。工业上制取的原理为:NaCl+H2O NaClO+H2↑,标出电子转移数目和方向
NaClO+H2↑,标出电子转移数目和方向_________ 。
(3)日常生活中84消毒液若与洁厕灵(较浓的盐酸)混用,发生反应:NaClO+2HCl→NaCl+Cl2+H2O,该反应的氧化剂为___________ ,被氧化的元素为______ 。若反应中电子转移为1.5 mol,生成的氯气为_______ mol。
(4)亚氯酸钠(NaClO2)与盐酸反应也可制取Cl2,尝试写出反应的化学方程式(不需配平):_______ 。
(5)向KOH溶液中通入11.2 L(标准状况)氯气恰好完全反应生成三种含氯盐:0.7 mol KCl、0.2 mol KClO和X。则X是___________ 。
a.0.1 mol KClO4 b.0.1 mol KClO3
c.0.2 mol KClO2 d.0.1 mol KClO2
(1)漂粉精的成分是
(2)84消毒液的成分为NaClO,写出氯气与NaOH反应的化学方程式:
 NaClO+H2↑,标出电子转移数目和方向
NaClO+H2↑,标出电子转移数目和方向(3)日常生活中84消毒液若与洁厕灵(较浓的盐酸)混用,发生反应:NaClO+2HCl→NaCl+Cl2+H2O,该反应的氧化剂为
(4)亚氯酸钠(NaClO2)与盐酸反应也可制取Cl2,尝试写出反应的化学方程式(不需配平):
(5)向KOH溶液中通入11.2 L(标准状况)氯气恰好完全反应生成三种含氯盐:0.7 mol KCl、0.2 mol KClO和X。则X是
a.0.1 mol KClO4 b.0.1 mol KClO3
c.0.2 mol KClO2 d.0.1 mol KClO2
您最近一年使用:0次



