名校
1 . 从冶炼金属产生的某酸泥(含 单质,
单质, 及锌、铜的化合物等)中回收汞和硒的一种工艺如下:
及锌、铜的化合物等)中回收汞和硒的一种工艺如下: 、
、 、
、 、
、 形式进入溶液。
形式进入溶液。 固体的晶体类型与石墨的晶体类型
固体的晶体类型与石墨的晶体类型___________ 相同(填“是”或者“不”);分离氧化浸出液和浸出渣的操作是___________ 。
2.还原沉汞时加入的 属于正盐,则
属于正盐,则 属于
属于___________ 元酸:沉汞后溶液中磷以最高价形式存在,“还原沉汞”的主要反应中氧化剂和还原剂的物质的量之比为___________ 。
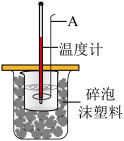
3.实验室测定中和反应热效应的装置如图所示,该装置有利于减少实验误差的设计措施有___________ (至少写一条)。
i.取 粗硒于锥形瓶中,加入
粗硒于锥形瓶中,加入 浓盐酸和
浓盐酸和 浓硝酸,沸水浴加热,使
浓硝酸,沸水浴加热,使 全部转化为
全部转化为 ;
;
ii.除去过量的 和溶解的
和溶解的 ;
;
iii. 加入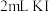 溶液、
溶液、 淀粉溶液,然后用
淀粉溶液,然后用 标准溶液进行滴定,到达滴定终点时,消耗
标准溶液进行滴定,到达滴定终点时,消耗 标准溶液
标准溶液 。
。
已知:
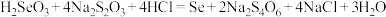

4.滴定时使用的定量仪器为___________ ,到达滴定终点时的现象为___________ 。
5.根据实验数据计算粗硒中硒的纯度为___________ 。
 单质,
单质, 及锌、铜的化合物等)中回收汞和硒的一种工艺如下:
及锌、铜的化合物等)中回收汞和硒的一种工艺如下: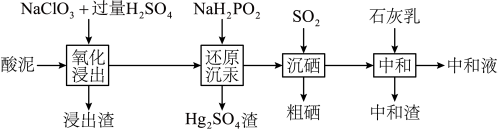
 、
、 、
、 、
、 形式进入溶液。
形式进入溶液。 固体的晶体类型与石墨的晶体类型
固体的晶体类型与石墨的晶体类型2.还原沉汞时加入的
 属于正盐,则
属于正盐,则 属于
属于3.实验室测定中和反应热效应的装置如图所示,该装置有利于减少实验误差的设计措施有
i.取
 粗硒于锥形瓶中,加入
粗硒于锥形瓶中,加入 浓盐酸和
浓盐酸和 浓硝酸,沸水浴加热,使
浓硝酸,沸水浴加热,使 全部转化为
全部转化为 ;
;ii.除去过量的
 和溶解的
和溶解的 ;
;iii. 加入
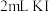 溶液、
溶液、 淀粉溶液,然后用
淀粉溶液,然后用 标准溶液进行滴定,到达滴定终点时,消耗
标准溶液进行滴定,到达滴定终点时,消耗 标准溶液
标准溶液 。
。已知:

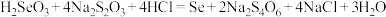

4.滴定时使用的定量仪器为
5.根据实验数据计算粗硒中硒的纯度为
您最近一年使用:0次
名校
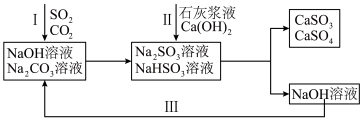
2 . 双碱法是一种用于燃煤尾气脱硫的工艺,其具有脱硫效率高、成本低等优点,以下是一种脱硫工艺简要流程。 时,
时, 和
和 的电离常数如下表所示。
的电离常数如下表所示。
1.等浓度的 和
和 溶液,
溶液,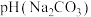
___________ 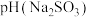 (填“>”、“<”或“=”),请依据电离平衡常数分析原因:
(填“>”、“<”或“=”),请依据电离平衡常数分析原因:___________ 。
2.过程I中, 溶液吸收
溶液吸收 时,随着
时,随着 的通入,会得到不同溶质组成的溶液。
的通入,会得到不同溶质组成的溶液。 时,
时, 的物质的量分数
的物质的量分数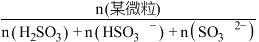 与pH的关系如图所示。
与pH的关系如图所示。___________ 。
②等浓度 和
和 的混合溶液中,下列关系正确的是
的混合溶液中,下列关系正确的是___________ 。
A.
B.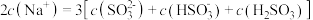
C.
D.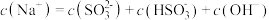
3.生成的 沉淀会被空气中氧气氧化,写出
沉淀会被空气中氧气氧化,写出 被氧化过程的化学方程式为:
被氧化过程的化学方程式为:___________ 。
4.工业上也可以用氨水吸收尾气中的 。氨水吸收
。氨水吸收 后,氨水全部转化为铵盐的溶液。为测定铵盐溶液的成分,设计如下实验。
后,氨水全部转化为铵盐的溶液。为测定铵盐溶液的成分,设计如下实验。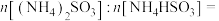
___________ 。
 时,
时, 和
和 的电离常数如下表所示。
的电离常数如下表所示。 |  |
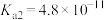 | |
 |  |
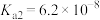 |
1.等浓度的
 和
和 溶液,
溶液,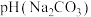
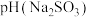 (填“>”、“<”或“=”),请依据电离平衡常数分析原因:
(填“>”、“<”或“=”),请依据电离平衡常数分析原因:2.过程I中,
 溶液吸收
溶液吸收 时,随着
时,随着 的通入,会得到不同溶质组成的溶液。
的通入,会得到不同溶质组成的溶液。 时,
时, 的物质的量分数
的物质的量分数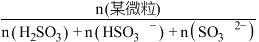 与pH的关系如图所示。
与pH的关系如图所示。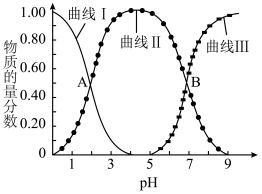
②等浓度
 和
和 的混合溶液中,下列关系正确的是
的混合溶液中,下列关系正确的是A.

B.
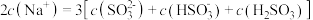
C.

D.
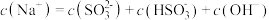
3.生成的
 沉淀会被空气中氧气氧化,写出
沉淀会被空气中氧气氧化,写出 被氧化过程的化学方程式为:
被氧化过程的化学方程式为:4.工业上也可以用氨水吸收尾气中的
 。氨水吸收
。氨水吸收 后,氨水全部转化为铵盐的溶液。为测定铵盐溶液的成分,设计如下实验。
后,氨水全部转化为铵盐的溶液。为测定铵盐溶液的成分,设计如下实验。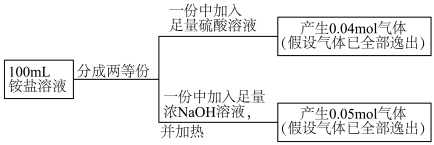
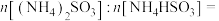
您最近一年使用:0次
名校
3 . I.人类活动中的碳排放无可避免。
(1)配平下列反应,并标出电子转移的方向和数目。___________
___________CH4+___________NO2 ___________NO+___________CO2+___________H2O
___________NO+___________CO2+___________H2O
(2)有一种处理废水中的HCOOH的微型原电池。电池含有Fe-C,使用时通入空气,便可以在___________ 生成H2O2。
A.阴极 B.负极 C.阳极 D.正极
写出H2O2与HCOOH反应生成CO2的化学方程式:___________ 。
Ⅱ.一种富集CO2的原电池模拟装置如下图。
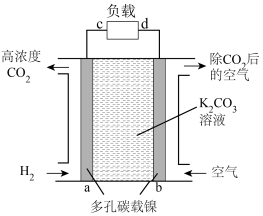
(3)b极为___________ 极(填“正”或“负”),a电极上发生的电极反应为___________ 。
(4)上述电极材料采用多孔碳载镍,“多孔”的优点是___________ 。
(5)该装置若消耗2 mol H2,则理论上在b极除去CO2的体积约为___________ L(标准状况下)。
(1)配平下列反应,并标出电子转移的方向和数目。
___________CH4+___________NO2
 ___________NO+___________CO2+___________H2O
___________NO+___________CO2+___________H2O(2)有一种处理废水中的HCOOH的微型原电池。电池含有Fe-C,使用时通入空气,便可以在
A.阴极 B.负极 C.阳极 D.正极
写出H2O2与HCOOH反应生成CO2的化学方程式:
Ⅱ.一种富集CO2的原电池模拟装置如下图。

(3)b极为
(4)上述电极材料采用多孔碳载镍,“多孔”的优点是
(5)该装置若消耗2 mol H2,则理论上在b极除去CO2的体积约为
您最近一年使用:0次
名校
4 . 氨气是重要的化工原料,氨水、硝酸盐、铵盐等均可作化肥产品。
(1)在VL浓度为 的氨水中滴加等体积
的氨水中滴加等体积 的盐酸,使pH=7,则产物中一水合氨浓度为
的盐酸,使pH=7,则产物中一水合氨浓度为___________  。
。
(2)在自然界的氮循环过程中,硝化细菌将土壤中的 转化为
转化为 后,土壤中的O2进一步将
后,土壤中的O2进一步将 氧化为
氧化为 ,在氧气较少的环境下,
,在氧气较少的环境下, 又可以在反硝化细菌的作用下与
又可以在反硝化细菌的作用下与 反应,使氮以N2形式放出。氧气与
反应,使氮以N2形式放出。氧气与 反应时,反应物
反应时,反应物 与O2的物质的量之比为
与O2的物质的量之比为___________ ,写出 与
与 作用生成N2的离子方程式
作用生成N2的离子方程式___________ 。
(1)在VL浓度为
 的氨水中滴加等体积
的氨水中滴加等体积 的盐酸,使pH=7,则产物中一水合氨浓度为
的盐酸,使pH=7,则产物中一水合氨浓度为 。
。(2)在自然界的氮循环过程中,硝化细菌将土壤中的
 转化为
转化为 后,土壤中的O2进一步将
后,土壤中的O2进一步将 氧化为
氧化为 ,在氧气较少的环境下,
,在氧气较少的环境下, 又可以在反硝化细菌的作用下与
又可以在反硝化细菌的作用下与 反应,使氮以N2形式放出。氧气与
反应,使氮以N2形式放出。氧气与 反应时,反应物
反应时,反应物 与O2的物质的量之比为
与O2的物质的量之比为 与
与 作用生成N2的离子方程式
作用生成N2的离子方程式
您最近一年使用:0次
5 . Ⅰ.硒( )在人体内可以起到提高免疫力、抗氧化等功效,含硒化合物在材料和药物领域具有重要作用。铬(
)在人体内可以起到提高免疫力、抗氧化等功效,含硒化合物在材料和药物领域具有重要作用。铬( )被广泛应用在冶金、化工、铸铁、耐火及高精端科技等领域。
)被广泛应用在冶金、化工、铸铁、耐火及高精端科技等领域。
(1)在元素周期表中,硒是第34号元素,与氧同主族,硒原子的电子式表示为___________ ,比较硫和硒的氢化物的热稳定性:
___________  (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。
Ⅱ.工业制备高纯硒的流程如下:
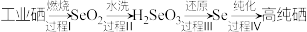
(2)下列说法正确的是___________。
(3)过程Ⅲ中还需要用的反应物为 ,对应产物为
,对应产物为 ,标况下,当有
,标况下,当有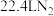 生成时,该反应中转移的电子数目为
生成时,该反应中转移的电子数目为___________ 。
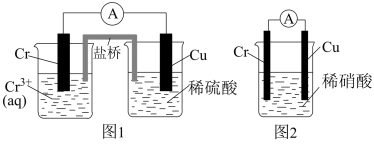
(4)工业上常将铬镀在其他金属表面,同铁、镍组成各种性质的不锈钢,在下图装置中,观察到图1装置铜电极上产生大量的无色气泡,而图2装置中铜电极上无气体产生,铬电极上产生大量有色气体,则下列叙述正确的是___________。
Ⅲ.+6价铬的化合物毒性较大,常用甲醇酸性燃料电池电解处理酸性含铬废水(主要含有 ),其原理示意图如下图所示:
),其原理示意图如下图所示:
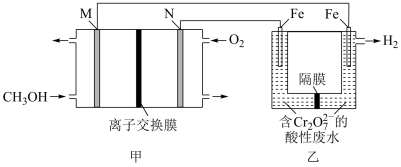
(5)M极为原电池的___________ 极(填“正”或“负”)。
(6)N极附近的
___________ (填“变大”或“变小”或“不变”)。
(7)写出电解池中阳极产物将 转化为
转化为 的离子方程式
的离子方程式___________ 。
 )在人体内可以起到提高免疫力、抗氧化等功效,含硒化合物在材料和药物领域具有重要作用。铬(
)在人体内可以起到提高免疫力、抗氧化等功效,含硒化合物在材料和药物领域具有重要作用。铬( )被广泛应用在冶金、化工、铸铁、耐火及高精端科技等领域。
)被广泛应用在冶金、化工、铸铁、耐火及高精端科技等领域。(1)在元素周期表中,硒是第34号元素,与氧同主族,硒原子的电子式表示为

 (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。Ⅱ.工业制备高纯硒的流程如下:
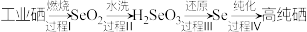
(2)下列说法正确的是___________。
| A.过程Ⅰ只发生氧化反应 |
| B.过程Ⅱ的水洗过程属于非氧化还原反应 |
C. 能与 能与 反应生成 反应生成 和 和 |
D. 在过程Ⅲ的反应中体现了还原性 在过程Ⅲ的反应中体现了还原性 |
(3)过程Ⅲ中还需要用的反应物为
 ,对应产物为
,对应产物为 ,标况下,当有
,标况下,当有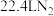 生成时,该反应中转移的电子数目为
生成时,该反应中转移的电子数目为(4)工业上常将铬镀在其他金属表面,同铁、镍组成各种性质的不锈钢,在下图装置中,观察到图1装置铜电极上产生大量的无色气泡,而图2装置中铜电极上无气体产生,铬电极上产生大量有色气体,则下列叙述正确的是___________。

A.由实验现象可知:金属活动性 |
B.图1为原电池装置, 电极上产生的是 电极上产生的是 |
C.两个装置中,电子均由 电极流向 电极流向 电极 电极 |
D.图2装置中 电极上发生的电极反应式为 电极上发生的电极反应式为 |
Ⅲ.+6价铬的化合物毒性较大,常用甲醇酸性燃料电池电解处理酸性含铬废水(主要含有
 ),其原理示意图如下图所示:
),其原理示意图如下图所示:
(5)M极为原电池的
(6)N极附近的

(7)写出电解池中阳极产物将
 转化为
转化为 的离子方程式
的离子方程式
您最近一年使用:0次
名校
解题方法
6 . 通过实验探究温度和浓度对反应速率的影响。
实验原理及方案:在酸性溶液中,KIO3和Na2SO3可发生反应生成I2,生成的I2可用淀粉溶液检验,根据出现蓝色所需的时间来衡量该反应的速率。
(1)碘酸钾和亚硫酸钠反应的离子方程式为_________________ ;
(2)实验①③中V1=_______ ,V2=_______ ;出现蓝色的时间由大到小的顺序_______ ;(用t1、t2、t3表示)
(3)对比实验②、③可得出的结论是___________________ ;
(4)资料显示①的反应进行至10s时,测得Na2SO3溶液的浓度为0.005mol·L-1,则10s内生成I2的平均化学反应速率v(I2)=________________ 。
实验原理及方案:在酸性溶液中,KIO3和Na2SO3可发生反应生成I2,生成的I2可用淀粉溶液检验,根据出现蓝色所需的时间来衡量该反应的速率。
| 实验序号 | 0.1mol·L-1KIO3酸性溶液(含淀粉)的体积/mL | 0.1mol·L-1Na2SO3溶液的体积/mL | 水的体积/mL | 实验温度/℃ | 出现蓝色的时间/s |
| ① | 5 | 5 | V1 | 5 | t1 |
| ② | 5 | 5 | 40 | 25 | t2 |
| ③ | 5 | V2 | 30 | 25 | t3 |
(2)实验①③中V1=
(3)对比实验②、③可得出的结论是
(4)资料显示①的反应进行至10s时,测得Na2SO3溶液的浓度为0.005mol·L-1,则10s内生成I2的平均化学反应速率v(I2)=
您最近一年使用:0次
名校
解题方法
7 . 已知N-H键、O=O键、H-O键键能分别为391kJ·mol-1、497kJ·mol-1、463kJ·mol-1,N2H4(g)与O2(g)反应的能量变化如图所示:
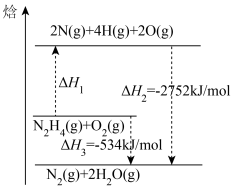
(1)N2H4(g)与O2(g)的反应是___________ (放热/吸热)反应。
(2)N2H4(g)中N-N键的键能为___________ 。
(3)N2(g)中N N键的键能为
N键的键能为___________ 。
(4)美国加利福尼亚大学圣地亚哥的 G·N·SChrauzer等人用氮气和水蒸气在触媒上,光照射下合成高能气态联氨初获成功,该反应的热化学方程式为:___________ 。
(5)在实验室中可以用次氯酸钠和氨气常温制备联氨,反应的离子方程式为:___________ 。
(6)联氨(N2H4)在水中电离方式与NH3相似,若将NH3视为一元弱碱,则N2H4是一种二元弱碱。根据以上信息,推断下列关于N2H4的说法不正确的是_________

(1)N2H4(g)与O2(g)的反应是
(2)N2H4(g)中N-N键的键能为
(3)N2(g)中N
 N键的键能为
N键的键能为(4)美国加利福尼亚大学圣地亚哥的 G·N·SChrauzer等人用氮气和水蒸气在触媒上,光照射下合成高能气态联氨初获成功,该反应的热化学方程式为:
(5)在实验室中可以用次氯酸钠和氨气常温制备联氨,反应的离子方程式为:
(6)联氨(N2H4)在水中电离方式与NH3相似,若将NH3视为一元弱碱,则N2H4是一种二元弱碱。根据以上信息,推断下列关于N2H4的说法不正确的是_________
| A.它与硫酸形成的酸式盐可以表示为N2H5HSO4 |
| B.它溶于水所得的溶液中共有4种离子 |
C.它溶于水发生电离的第一步可表示为:N2H4+H2O N2H N2H +OH- +OH- |
| D.若已知联氨和四氧化二氮可以做火箭推进剂,两者反应产物可以是氮气和水 |
您最近一年使用:0次
名校
解题方法
8 . 无机净水剂主要有铁系和铝系两类,但铝对人体有慢性毒害作用,所以研制各种铁系净水剂成为热门。聚合硫酸铁 是一种常用的净水剂,下图是以废铁屑为原料制备聚合硫酸铁的一种工艺流程。
是一种常用的净水剂,下图是以废铁屑为原料制备聚合硫酸铁的一种工艺流程。
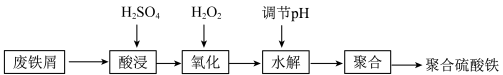
(1)Fe原子价电子排布式为_____ 。
(2)清洗废铁屑表面的油污可选用热的纯碱溶液,请用离子方程式表示纯碱溶液显碱性的原因:_____ 。
(3)“氧化”步骤中发生反应的离子方程式为:
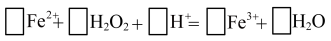
配平上述反应,并标出电子转移方向和数目_____ (在答题卡上画出 )
(4)保持温度不变,向硫酸铁溶液中加入少量的NaOH固体,下列说法正确的是_____(不定项)
(5)“水解”步骤中溶液的pH必须控制在一定的范围内,原因是_____ 。
(6)研究表明, 在水解的过程当中会产生
在水解的过程当中会产生 、
、 等产物,请写出
等产物,请写出 水解产生
水解产生 的离子方程式:
的离子方程式:_____ 。
聚合硫酸铁中 比值的确定方法:取一定量的聚合硫酸铁,先加入足量的稀盐酸酸化,然后加入
比值的确定方法:取一定量的聚合硫酸铁,先加入足量的稀盐酸酸化,然后加入 溶液,经过滤后得到沉淀A和滤液B,洗涤、干燥沉淀A后称得质量为2.33g向滤液B中加入足量的NaOH溶液充分反应,将经过滤后得到的滤渣洗涤、灼烧至恒重,得1.60g固体C。
溶液,经过滤后得到沉淀A和滤液B,洗涤、干燥沉淀A后称得质量为2.33g向滤液B中加入足量的NaOH溶液充分反应,将经过滤后得到的滤渣洗涤、灼烧至恒重,得1.60g固体C。
(7)聚合硫酸铁中
_____ 。
 是一种常用的净水剂,下图是以废铁屑为原料制备聚合硫酸铁的一种工艺流程。
是一种常用的净水剂,下图是以废铁屑为原料制备聚合硫酸铁的一种工艺流程。
(1)Fe原子价电子排布式为
(2)清洗废铁屑表面的油污可选用热的纯碱溶液,请用离子方程式表示纯碱溶液显碱性的原因:
(3)“氧化”步骤中发生反应的离子方程式为:
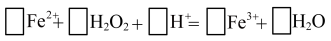
配平上述反应,并标出电子转移方向和数目
(4)保持温度不变,向硫酸铁溶液中加入少量的NaOH固体,下列说法正确的是_____(不定项)
A. 水解程度增大 水解程度增大 | B.溶液pH减小 |
C. 减小 减小 | D.水的电离程度增大 |
(6)研究表明,
 在水解的过程当中会产生
在水解的过程当中会产生 、
、 等产物,请写出
等产物,请写出 水解产生
水解产生 的离子方程式:
的离子方程式:聚合硫酸铁中
 比值的确定方法:取一定量的聚合硫酸铁,先加入足量的稀盐酸酸化,然后加入
比值的确定方法:取一定量的聚合硫酸铁,先加入足量的稀盐酸酸化,然后加入 溶液,经过滤后得到沉淀A和滤液B,洗涤、干燥沉淀A后称得质量为2.33g向滤液B中加入足量的NaOH溶液充分反应,将经过滤后得到的滤渣洗涤、灼烧至恒重,得1.60g固体C。
溶液,经过滤后得到沉淀A和滤液B,洗涤、干燥沉淀A后称得质量为2.33g向滤液B中加入足量的NaOH溶液充分反应,将经过滤后得到的滤渣洗涤、灼烧至恒重,得1.60g固体C。(7)聚合硫酸铁中

您最近一年使用:0次
名校
解题方法
9 . 利用 制备氧钒碱式碳酸铵晶体{[(NH4)5(CO3)4(OH)9]·10H2O}的工艺流程如下:
制备氧钒碱式碳酸铵晶体{[(NH4)5(CO3)4(OH)9]·10H2O}的工艺流程如下:
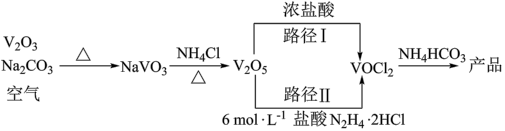
已知:+4价钒在弱酸性环境中具有还原性。下列说法正确的是
 制备氧钒碱式碳酸铵晶体{[(NH4)5(CO3)4(OH)9]·10H2O}的工艺流程如下:
制备氧钒碱式碳酸铵晶体{[(NH4)5(CO3)4(OH)9]·10H2O}的工艺流程如下:
已知:+4价钒在弱酸性环境中具有还原性。下列说法正确的是
A. 制备 制备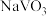 过程中,氧化剂与还原剂物质的量之比为1:2 过程中,氧化剂与还原剂物质的量之比为1:2 |
B.生成 的反应为2NaVO3+2NH4Cl 的反应为2NaVO3+2NH4Cl 2NaCl+V2O5+2NH3·H2O 2NaCl+V2O5+2NH3·H2O |
C.由 制备VOCl2的两种路径,路径I更符合绿色化学思想 制备VOCl2的两种路径,路径I更符合绿色化学思想 |
| D.路径Ⅱ中若盐酸浓度过低,可能生成副产物VO2Cl |
您最近一年使用:0次
名校
解题方法
10 . 党的二十大报告中着重强调了生态文明建设的重要性,在这场蓝天保卫战中,如何有效脱除NOx是当前科学家研究的重要课题。
(1)碱性KMnO4氧化法可将NOx进行脱除。
①KMnO4(NaOH)溶液进行烟气中NO的脱除,将该离子方程式补充完整_______ 。
_______NO+_______MnO _______
_______ =______NO
=______NO 3NO
3NO 10MnO
10MnO _______
_______
②下列叙述错误的是_______ 。
A.将脱除后的混合溶液进行分离可获得氨态氮肥
B.反应后混合溶液中:[MnO ]+[MnO
]+[MnO ]=[K+]
]=[K+]
C.在不同酸碱性条件下,KMnO4发生氧化还原反应的产物可能不同
D.NO 中的O-N-O键角大于NO
中的O-N-O键角大于NO 中的O-N-O键角
中的O-N-O键角
③在实验室用KMnO4(NaOH)溶液对模拟烟气中的NO进行脱除。若将标准状况下224L含NO体积分数为10%的模拟烟气进行处理,假设NO最终全部转化为NO ,理论上需要KMnO4的质量为
,理论上需要KMnO4的质量为_______ g。
(2)用Pl-g-C3N4光催化氧化法脱除NO的过程如图所示。
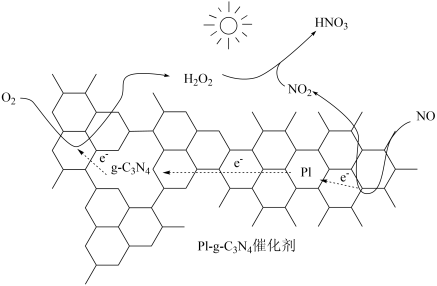
在酸性水溶液中,光催化脱除原理和电化学反应原理类似。g-C3N4端的反应为O2+2H++2e-=H2O2,P1端的反应为_______ 。
无害化处理水体中的含氮化合物(以NH3、NO 、NO
、NO 等形式存在)也是生态文明建设的重要环节之一。
等形式存在)也是生态文明建设的重要环节之一。
(3)向该酸性废水(主要是以NH 形式存在)中加入NaClO溶液可将NH
形式存在)中加入NaClO溶液可将NH 转化成无害气体放出,发生反应的离子方程式为
转化成无害气体放出,发生反应的离子方程式为_______ ;NaClO可以通过Cl2与NaOH溶液反应制得,该反应中氧化剂与还原剂的物质的量之比为_______ 。
(4)使用NH3时也要注意防止污染环境。电化学气敏传感器可用于监测环境中NH3的含量,其工作原理如图:
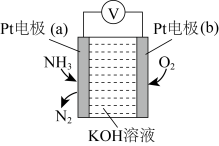
①Pt电极(a)为_______ 极(填“正”或“负”);Pt电极(b)上的电极反应式为_______ 。
②电池总反应的化学反应方程式为_______ ,反应一段时间后,KOH溶液的浓度将_______ (填“增大”“减小”或“不变”)。
(1)碱性KMnO4氧化法可将NOx进行脱除。
①KMnO4(NaOH)溶液进行烟气中NO的脱除,将该离子方程式补充完整
_______NO+_______MnO
 _______
_______ =______NO
=______NO 3NO
3NO 10MnO
10MnO _______
_______
②下列叙述错误的是
A.将脱除后的混合溶液进行分离可获得氨态氮肥
B.反应后混合溶液中:[MnO
 ]+[MnO
]+[MnO ]=[K+]
]=[K+]C.在不同酸碱性条件下,KMnO4发生氧化还原反应的产物可能不同
D.NO
 中的O-N-O键角大于NO
中的O-N-O键角大于NO 中的O-N-O键角
中的O-N-O键角③在实验室用KMnO4(NaOH)溶液对模拟烟气中的NO进行脱除。若将标准状况下224L含NO体积分数为10%的模拟烟气进行处理,假设NO最终全部转化为NO
 ,理论上需要KMnO4的质量为
,理论上需要KMnO4的质量为(2)用Pl-g-C3N4光催化氧化法脱除NO的过程如图所示。

在酸性水溶液中,光催化脱除原理和电化学反应原理类似。g-C3N4端的反应为O2+2H++2e-=H2O2,P1端的反应为
无害化处理水体中的含氮化合物(以NH3、NO
 、NO
、NO 等形式存在)也是生态文明建设的重要环节之一。
等形式存在)也是生态文明建设的重要环节之一。(3)向该酸性废水(主要是以NH
 形式存在)中加入NaClO溶液可将NH
形式存在)中加入NaClO溶液可将NH 转化成无害气体放出,发生反应的离子方程式为
转化成无害气体放出,发生反应的离子方程式为(4)使用NH3时也要注意防止污染环境。电化学气敏传感器可用于监测环境中NH3的含量,其工作原理如图:
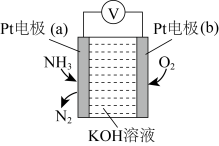
①Pt电极(a)为
②电池总反应的化学反应方程式为
您最近一年使用:0次



