2022高三·全国·专题练习
1 . 以焙烧黄铁矿 (杂质为石英等)产生的红渣为原料制备铵铁蓝
(杂质为石英等)产生的红渣为原料制备铵铁蓝 颜料。工艺流程如下:
颜料。工艺流程如下:
(1)红渣的主要成分为_______ (填化学式),滤渣①的主要成分为_______ (填化学式)。
(2)黄铁矿研细的目的是_______ 。
(3)还原工序中,不生成S单质的反应的化学方程式为_______ 。
(4)工序①的名称为_______ ,所得母液循环使用。
(5)沉铁工序产生的白色沉淀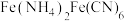 中
中 的化合价为
的化合价为_______ ,氧化工序发生反应的离子方程式为_______ 。
(6)若用还原工序得到的滤液制备 和
和 ,所加试剂为
,所加试剂为_______ 和_______ (填化学式,不引入杂质)。
 (杂质为石英等)产生的红渣为原料制备铵铁蓝
(杂质为石英等)产生的红渣为原料制备铵铁蓝 颜料。工艺流程如下:
颜料。工艺流程如下: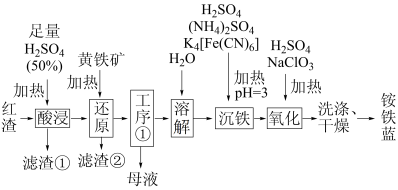
(1)红渣的主要成分为
(2)黄铁矿研细的目的是
(3)还原工序中,不生成S单质的反应的化学方程式为
(4)工序①的名称为
(5)沉铁工序产生的白色沉淀
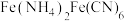 中
中 的化合价为
的化合价为(6)若用还原工序得到的滤液制备
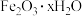 和
和 ,所加试剂为
,所加试剂为
您最近一年使用:0次
2022-07-01更新
|
10260次组卷
|
20卷引用:专题17 化工流程综合题-备战2023年高考化学母题题源解密(广东卷)
(已下线)专题17 化工流程综合题-备战2023年高考化学母题题源解密(广东卷)(已下线)专题15 工艺流程题-2022年高考真题模拟题分项汇编(已下线)2022年新高考河北省高考真题化学试题(部分试题)(已下线)第09讲 铁及其重要化合物(练)-2023年高考化学一轮复习讲练测(全国通用)2022年河北省高考真题化学试题(已下线)易错点32 物质的分离、提纯与检验-备战2023年高考化学考试易错题(已下线)热点情景汇编-专题十 工艺流程中的新工艺河北省衡水阳光中学2022-2023学年高二上学期第一次阶段考试化学试题(已下线)2022年河北省高考真题变式题(14-18)第一部分 命题热点剖析——知晓高考新方向 剖析工艺流程题命题热点 构建高效解题思维模型(已下线)专题29 无机化工流程综合分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)陕西省渭南市2023届高三第一次教学质量检测(一模)化学试题(已下线)第6讲 铁及其重要化合物(已下线)考点14 铁及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)专题13 工艺流程综合题-2023年高考化学真题题源解密(新高考专用)(已下线)考点47 无机工艺流程(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)四川省成都市第七中学2023-2024学年高二上学期10月月考化学试题吉林省长春外国语学校2023-2024学年高三上学期9月月考化学试题(已下线)工业流程题吉林省通化市辉南县第六中学2023-2024学年高一下学期3月半月考化学试卷
名校
2 . 载人航天器中的物质和能量资源都十分宝贵,我国科学家进行了如图所示的氧循环研究,实现了空间站中氧气的再生。下列说法不正确的是


| A.用于循环的氢原子利用率为100% |
| B.太阳能可作为反应①和②的能量来源 |
C.反应①为 |
D.等物质的量的 和 和 含有的电子数相同 含有的电子数相同 |
您最近一年使用:0次
2023-03-16更新
|
2051次组卷
|
8卷引用:广东省广州市2023届高三一模考试化学试题
名校
解题方法
3 . 已知电离常数:Ka(HCN)=5×10-10,H2CO3:Ka1=4.3×10-7,Ka2=5.6×10-11,下列离子方程式书写正确的是
A.向KCN(aq)中通入少量的CO2气体:CO2+H2O+2CN-=2HCN+CO |
| B.少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO |
| C.氢氧化铁沉淀溶解于过量氢碘酸溶液中:2Fe(OH)3+6H++2I-=2Fe2++6H2O+I2 |
D.向Ba(OH)2溶液中加入少量的NaHCO3溶液:2HCO +Ba2++2OH-=BaCO3↓+CO +Ba2++2OH-=BaCO3↓+CO +2H2O +2H2O |
您最近一年使用:0次
2023-06-18更新
|
1729次组卷
|
8卷引用:2024届广东省梅州市兴宁市第一中学高三下学期二模化学试题
2024届广东省梅州市兴宁市第一中学高三下学期二模化学试题河南省郑州外国语学校2023届高三下学期全真模拟五理综化学试题(已下线)第九章单元测试卷(已下线)考点1 电离平衡(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)电离平衡江西省赣州地区2023-2024学年十大教学能手选拔赛高中化学试题2024届湖南省长沙市雅礼中学高三下学期4月综合测试化学试题湖南省雅礼中学2024届高三下学期综合自主压轴测试 (一)化学题
4 . 市政污泥含大量金属(Cu、Zn、Ni、Fe、Ag等),不经处理直接填埋会对环境造成严重的污染。市政污泥的综合利用能够使其得到科学、妥善的处置,并可以作为资源再次被我们利用,同时可以带来一定的经济价值。某科研团队利用市政污泥回收皓矾(ZnSO4·7H2O)的工艺流程如下:
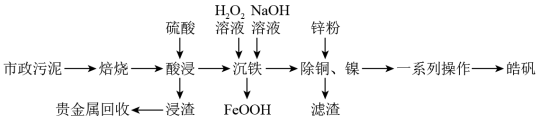
已知:“沉铁”时若pH过高,会产生具有较强吸附性的氢氧化铁胶状沉淀。回答下列问题:
(1)为提高“酸浸”效率,可采取的措施有___________ (任写一条)。
(2)“一系列操作”主要包括___________ 、___________ 、过滤、洗涤,干燥。
(3)用锌粉除铜、镍时,先除去铜,然后分离再置换除镍,用锌粉直接置换速率极慢,目前采用“锑盐净化法”,即置换时在酸性含Ni2+溶液中同时加入锌粉和Sb2O3,得到金属Ni和Sb的混合物,该混合物可表示为NiSb,形成NiSb的离子方程式为___________ 。
(4)“浸渣”中含有Ag2S,经一系列处理得Ag(NH3)2Cl(可溶于水,电离成[Ag(NH3)2]+和Cl-},用肼(N2H4)还原Ag(NH3)2Cl得到单质银,N2H4的氧化产物为N2,写出该反应的离子方程式:_______ ,则反应中氧化剂与还原剂的物质的量之比为_______ 。
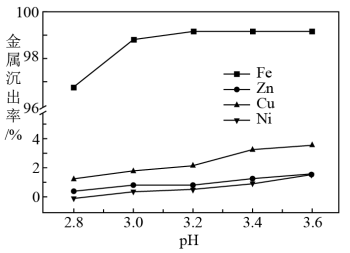
(5)浸出液中含有Fe2+,“沉铁”步骤中发生反应的离子方程式为_______ 。pH对不同金属沉出率的影响如图所示,则“沉铁’时最合理的pH约为_______ 。在pH<6时,Zn2+、Cu2+、Ni2+在溶液中以离子形式存在,但是有铁离子存在时,pH升高,Zn、Cu、Ni损失率均升高,原因可能是_______ 。

已知:“沉铁”时若pH过高,会产生具有较强吸附性的氢氧化铁胶状沉淀。回答下列问题:
(1)为提高“酸浸”效率,可采取的措施有
(2)“一系列操作”主要包括
(3)用锌粉除铜、镍时,先除去铜,然后分离再置换除镍,用锌粉直接置换速率极慢,目前采用“锑盐净化法”,即置换时在酸性含Ni2+溶液中同时加入锌粉和Sb2O3,得到金属Ni和Sb的混合物,该混合物可表示为NiSb,形成NiSb的离子方程式为
(4)“浸渣”中含有Ag2S,经一系列处理得Ag(NH3)2Cl(可溶于水,电离成[Ag(NH3)2]+和Cl-},用肼(N2H4)还原Ag(NH3)2Cl得到单质银,N2H4的氧化产物为N2,写出该反应的离子方程式:
(5)浸出液中含有Fe2+,“沉铁”步骤中发生反应的离子方程式为

您最近一年使用:0次
2022-01-11更新
|
1500次组卷
|
5卷引用:广东省清远市2021-2022学年高三上学期期末教学质量检测化学试题
名校
5 . 下列有关Fe3+、Fe2+的性质及应用的说法正确的是
①向盛有FeCl3溶液的试管中加过量铁粉,充分振荡后加1滴KSCN溶液,黄色逐渐消失,加KSCN后溶液颜色不变
②将废铁屑加入FeCl2溶液中,可用于除去工业废气中的Cl2
③向FeCl2溶液中滴加NH4SCN溶液,溶液显红色
④将NaOH浓溶液滴加到饱和FeCl3溶液中制备Fe(OH)3胶体
⑤向Fe2(SO4)3溶液中加入过量铁粉的离子方程式:Fe3++Fe=2Fe2+
⑥Fe2+与H2O2在酸性溶液中的反应:2Fe2++H2O2+2H+=2Fe3++2H2O
①向盛有FeCl3溶液的试管中加过量铁粉,充分振荡后加1滴KSCN溶液,黄色逐渐消失,加KSCN后溶液颜色不变
②将废铁屑加入FeCl2溶液中,可用于除去工业废气中的Cl2
③向FeCl2溶液中滴加NH4SCN溶液,溶液显红色
④将NaOH浓溶液滴加到饱和FeCl3溶液中制备Fe(OH)3胶体
⑤向Fe2(SO4)3溶液中加入过量铁粉的离子方程式:Fe3++Fe=2Fe2+
⑥Fe2+与H2O2在酸性溶液中的反应:2Fe2++H2O2+2H+=2Fe3++2H2O
| A.①②⑥ | B.①②③ | C.①④⑤ | D.②④⑥ |
您最近一年使用:0次
2021-12-18更新
|
4231次组卷
|
10卷引用:广东省汕尾华大实验学校2022-2023学年高一上学期12月月考化学试题
广东省汕尾华大实验学校2022-2023学年高一上学期12月月考化学试题吉林省洮南市第一中学2021-2022学年高一上学期第三次月考化学试题山东省济南第三中学2022-2023学年高一上学期12月月考化学试题黑龙江省哈尔滨市尚志中学2022-2023学年高三上学期12月月考化学试题江西省景德镇一中2022-2023学年高一上学期期中考试(19班)化学试题天津市南开区崇化中学2022-2023学年高一上学期期末质量检测化学试题江西省南昌市豫章中学20212-2022学年高一下学期第一次月考化学试题新疆乌鲁木齐市第101中学2022-2023学年高一上学期12月月考化学试题新疆乌鲁木齐市高级中学2023-2024学年高一上学期1月期末化学试题山东省菏泽市郓城县第一中学(英华校区)2023-2024学年高三上学期10月阶段性考试化学试题
真题
名校
6 . 在酸性条件下,可发生如下反应:  +2M3++4H2O=
+2M3++4H2O=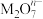 +Cl-+8H+,
+Cl-+8H+, 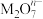 中M的化合价是
中M的化合价是
 +2M3++4H2O=
+2M3++4H2O=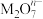 +Cl-+8H+,
+Cl-+8H+, 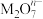 中M的化合价是
中M的化合价是 | A.+4 | B.+5 | C.+6 | D.+7 |
您最近一年使用:0次
2017-08-08更新
|
12049次组卷
|
141卷引用:广东省惠州市2017-2018学年高一上学期期末教学质量检测化学试题
广东省惠州市2017-2018学年高一上学期期末教学质量检测化学试题【全国百强校】广东省湛江第一中学2018-2019学年高一上学期第二次大考化学试题广东省普宁市华侨中学2021-2022学年高一上学期期中考试化学试题广东省肇庆市封开县广信中学2022-2023学年高一上学期第一次月考化学试题广东省肇庆市四会市四会中学、封开县广信中学2023-2024学年高一上学期第二次月考化学试题2017年全国普通高等学校招生统一考试化学(海南卷精编版)2福建省福州市八县(市)协作校2017-2018学年高二上学期期中联考化学(理)试题贵州省兴义中学2017-2018学年高一上学期期中考试化学试题陕西省西安市长安区第一中学2017-2018学年高一上学期第二次月考化学(重点、平行班)试题(已下线)《考前20天终极攻略》6月2日 专项二 化学用语(已下线)2019高考备考一轮复习精品资料 第二章 化学物质及其变化第3讲 氧化还原反应【教学案】【全国县级联考】江西省上饶县高中2017-2018学年高一下学期期末考试化学试题【全国百强校】江西省新余市第四中学2019届高三9月月考化学试题山西省临猗县临晋中学2019届高三9月月考化学试题【全国百强校】宁夏回族自治区育才中学2019届高三上学期月考(二)化学试题(已下线)2019高考热点题型和提分秘籍 第二章 化学物质及其变化 第3讲 氧化还原反应 (教学案)福建省厦门市湖滨中学2018-2019学年高一上学期期中考试化学试题(已下线)2019高考备考二轮复习精品资料-专题3 氧化还原反应(教学案)河南省安阳市第三十六中学2018-2019学年高二6月月考化学试题第2章《元素与物质世界》期中复习检测试卷海南省儋州市第一中学2020届高三上学期第一次月考化学试卷浙江省宁波三中2019-2020学年高三10月月考化学试题贵州省贵阳市第六中学2019—2020学年高一上学期期中考试化学试题福建省永泰县第一中学2019-2020学年高二上学期期中考试化学试题海南省海南枫叶国际学校2019-2020学年高一上学期期中考试化学试题广西柳州市柳江中学2019-2020学年高一上学期期中考试化学试题内蒙古呼和浩特市土默特左旗第一中学2019-2020学年高一上学期第二次月考化学试题云南省西双版纳傣族自治州勐腊县第一中学2019-2020学年高一上学期期末考试化学试题辽宁省滨海实验中学2019-2020学年高一上学期期末化学试题重庆市南开中学2020年高一化学春季在线学习重点知识查漏补缺《离子反应》专题训练山东省日照市2019-2020学年高一上学期期末校际联考化学试题(已下线)专题四 氧化还原反应(真题汇编)-2020年高考二轮模块化复习之《化学基本概念》名师讲案与提分特训陕西省吴起高级中学2019-2020学年高二下学期第一次质量检测化学试题贵州省贵阳市南明甲秀高级中学2019—2020学年高一上学期期中考试化学试题(已下线)小题必刷07 氧化还原反应概念及应用——2021年高考化学一轮复习小题必刷(通用版)人教版(2019)高一必修第一册第一章 物质及其变化 高考挑战区人教版(2019)高一必修第一册 第一章素养检测鲁科版(2019)高一必修第一册第2章 元素与物质世界 总结检测鲁科版(2019)高一必修第一册第二章C 高考挑战区 过高考 3年真题强化闯关(已下线)期末模拟卷(一)-2020-2021学年高一化学必修第一册同步单元AB卷(新教材人教版)高一必修第一册(鲁科2019)第2章第3节 氧化还原反应 高考帮人教版(2019)高一必修第一册 第一章 物质及其变化 第三节 氧化还原反应 高考帮山东省济宁邹城市第一中学2020-2021学年高一10月月考化学试题江苏省南通市海安县2020-2021学年高一上学期第一次月考化学试题重庆市杨家坪中学2020-2021学年高一上学期第一次月考化学试题黑龙江省大庆市东风中学2020-2021学年高一上学期第一次阶段考试化学试题安徽省滁州市明光县明光中学2020-2021学年高一上学期第一次月考化学试题福建省福州市罗源第一中学2020-2021学年高二上学期10月月考化学试题福建省福州市福清西山学校高中部2019-2020学年高一上学期期中考试化学试题(已下线)【浙江新东方】1山西省晋中市平遥第四中学2020-2021学年高一上学期10月月考化学试题江西省南昌市第二中学2020-2021学年高一上学期期中考试化学试题辽宁省大连市瓦房店市2019-2020学年高一上学期期中考试化学试题湖北省沙市中学2020-2021学年高一上学期期中考试化学(选考)试题山东省临沂外国语学校2020-2021学年高一上学期10月月考化学试题湖南省湘潭电机子弟中学2020-2021学年高一上学期段考化学试题(已下线)【南昌新东方】11 . 2020 高一上 南昌二中 期中 刘志平,项金辉内蒙古赤峰市翁牛特旗乌丹第二中学2020-2021学年高一上学期期中考试化学试题湖南平江县第一中学2021届高三上学期第二次月考化学试题吉林省白城市大安市第一中学校2020-2021学年高一上学期第三次月考化学试题(已下线)【浙江新东方】71.河南省许昌市建安区第一高级中学2020-2021学年高一上学期阶段性测试(12月)化学试题黑龙江省齐齐哈尔市2020-2021学年高一上学期期末考试化学试题江苏省海安高级中学2020~2021学年高一上学期阶段检测(一)化学试题宁夏回族自治区银川市六盘山市高级中学2020-2021学年高一上学期第二次月考化学试题天津市静海区第一中学2020-2021学年高一12月考化学试题吉林省白山市抚松县第五中学2020-2021学年高一上学期期中考试化学试题海南省东方市八所中学2020-2021学年高一上学期期中考试化学试题吉林省延边朝鲜族自治州2020-2021学年高一上学期期末考试化学试题江苏省南菁高级中学2020-2021学年高一上学期第一次阶段性检测考试化学试题重庆实验中学2020-2021学年高一上学期第一阶段测试化学试题海南省海南鑫源高级中学2019-2020学年高一上学期期中考试化学试题海南省海南鑫源高级中学2019-2020学年高三上学期期中考试化学试题山东省嘉祥县第一中学2020-2021学年高一上学期10月月考化学试题(已下线)专题1.3.2 氧化还原反应中电子转移的表示方法(备作业)-【上好课】2021-2022学年高一化学同步备课系列(人教版2019必修第一册)(已下线)课时10 氧化还原反应规律及应用-2022年高考化学一轮复习小题多维练(全国通用)河北省石家庄市第九中学2020-2021学年高一上学期11月月考化学试题黑龙江省哈尔滨市第三中学2022届高三第一次验收考试化学试题江西省南昌八一中学2021-2022学年高一上学期10月月考化学试题河北省辛集市第一中学2021-2022学年高一上学期第一次月考化学试题黑龙江省尚志市尚志中学2021-2022学年高一上学期第一次月考化学试题云南省罗平县第二中学2021-2022学年高一上学期10月月考化学试题江西省奉新县第一中学2021-2022学年高一上学期第一次月考化学试题黑龙江省哈尔滨师范大学青冈实验中学2021-2022学年高一10月月考化学试题河南省新乡县高级中学2021-2022学年高一上学期第一次月考化学试题湖南省邵阳邵东市第一中学2021-2022学年高一上学期期中考试化学试题四川省广安市武胜烈面中学校2021-2022学年高一上学期期中测试化学试题贵州省黔南州都匀市都匀第一中学2021-2022学年高一上学期期中化学试题内蒙古呼和浩特市2021-2022学年高一上学期期末考试化学试题第三节 氧化还原反应 第2课时 氧化剂和还原剂黑龙江省大庆市肇州县第二中学2021-2022学年高一上学期第一次月考化学试题新疆石河子第二中学2021-2022学年高一上学期第一次月考化学试题吉林省松原市2021-2022学年高一上学期11月联考化学试题浙江省吴兴高级中学2021-2022学年高一上学期10月月考化学试题云南省德宏州2021-2022学年高一上学期期末统一监测化学试题浙江省马寅初中学2022--2023学年高一上学期第一次月考化学试题四川省绵阳南山中学2022-2023学年高一上学期10月月考化学试题河南省洛阳市强基联盟2022-2023学年高一上学期第一次大联考化学试题江苏省南京市第二十九中学2022-2023学年高一上学期10月月考化学试题天津市宝坻区第一中学2022-2023学年高一上学期阶段性练习(一)化学试题天津市南开大学附属中学2022-2233学年高一上学期阶段检测化学试题(一)山东省淄博实验中学2022-2023学年高一上学期月考化学试题湖北省宜昌市协作体2022-2023学年高一上学期期中考试化学试题天津市实验中学2022-2023学年高一上学期学情评估(一)化学试题内蒙古呼和浩特市第二中学致远级部2022-2023学年高一上学期第一次月考化学试题内蒙古包头市第九中学2022-2023学年高一上学期10月月考化学试题贵州省贵阳市花溪第六中学2022-2023学年高一上学期期中考试化学试题四川省芦山中学2022-2023学年高一上学期半期考试(期中)化学试题四川省成都市东部新区养马高级中学2022-2023学年高一上学期期中考试化学试题河南省开封市尉氏三中南校区2021-2022学年高一上学期月考化学试题福建省福清西山学校2021-2022学年高一上学期12月月考化学试题安徽省淮北市实验高级中学2022-2023学年高一上学期阶段性考试化学试题云南省曲靖市第一中学2022-2023学年高一上学期第一次检测化学试题内蒙古乌兰浩特市第四中学2022-2023学年高一上学期第一次月考化学试题宁夏吴忠中学2022-2023学年高一上学期期末考试化学试题贵州省贵阳清镇北大培文学校2022-2023学年高二下学期3月月考(4班)化学试题安徽省马鞍山市花山区等4地安徽工业大学附属中学2022-2023学年高一上学期10月月考化学试题河北省石家庄市第一中学东校区2023-2024学年高一上学期第一次月考化学试题天津市南开中学2023-2024学年高一上学期第一次月考化学试题江西省南昌市豫章中学2022-2023学年高一上学期10月月考化学试题浙江省温州市新力量联盟2023-2024学年高一上学期11月期中联考化学试题浙江省湖州市第二中学2023-2024学年高一上学期9月月考化学试题辽宁省沈阳市第十五中学2023-2024学年高一上学期10月月考化学试题(已下线)BBWYhjhx1001.pdf新疆乌鲁木齐市第二十三中学2023-2024学年高一上学期10月月考化学试题山西省太原市第十二中学校2023-2024学年高一上学期第一次月考化学试题陕西省宝鸡市金台区2023-2024学年高一上学期期中考试化学试题黑龙江省齐齐哈尔市恒昌中学校2023-2024学年高一上学期期中考试化学试题云南省楚雄东兴中学2023-2024学年高一上学期10月月考化学试题四川省兴文第二中学校2023-2024学年高一上学期11月期中考试化学试题河南省济源市2023-2024学年高级中学高一上学期化学模拟练习辽宁省朝阳市第一高级中学 第二高级中学2023-2024学年高一上学期12月月考化学试题 吉林省通化市梅河口市第五中学2023-2024学年高一上学期1月期末化学试题福建省宁德衡水育才中学2022-2023学年高一上学期1月期末测试化学试题青海省西宁市大通回族土族自治县第二完全中学2022-2023学年高一下学期开学检测化学试卷 海南华侨中学2023-2024学年高一上学期期末考试化学试题海南省华东师范大学第二附属中学乐东黄流中学2023-2024学年高一上学期11月期中化学试题云南省罗平县第二中学2021-2022学年高一上学期期末考试化学试题云南省保山市腾冲市第八中学2020-2021学年高一下学期期末考试化学试题内蒙古自治区通辽市科尔沁左翼中旗实验高级中学2023-2024学年高一上学期1月期末化学试题云南大理州实验中学2021-2022学年高二下学期化学开学试题
名校
解题方法
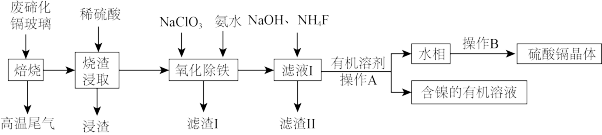
7 . 碲化镉玻璃中主要含有CdTe(其中含有少量Fe、Ni、Mg、Si、O等元素组成的化合物),工业上利用废弃碲化镉(CdTe)玻璃回收其中金属的工艺流程如下。
已知:①常温时,有关物质的 如下表。
如下表。
②当溶液中离子浓度小于 时,可认为沉淀完全。
时,可认为沉淀完全。
回答下列问题:
(1)在“焙烧”时为提高效率可采用的措施有_______ (答出一条即可)。写出“浸渣”的工业用途:_______ 。
(2)实验室中,“操作A”需要的玻璃仪器有_______ 。“高温尾气”中的 在水溶液中可用
在水溶液中可用 将其还原为Te单质,写出该反应的化学方程式:
将其还原为Te单质,写出该反应的化学方程式:_______ 。
(3)“氧化除铁”步骤中可以先调节pH为5,然后再加入 ,则此时
,则此时 被氧化的离子方程式为
被氧化的离子方程式为_______ 。
(4)测得“滤液I”中 浓度为
浓度为 ,取1L滤液,则至少加入
,取1L滤液,则至少加入_______ g 固体才能使
固体才能使 沉淀完全。
沉淀完全。
(5)取1吨含碲化镉80%的废弃玻璃,最终回收得到0.64吨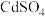 ,则硫酸镉的回收率为
,则硫酸镉的回收率为_______ (保留三位有效数字)。

已知:①常温时,有关物质的
 如下表。
如下表。 |  |  |  |  |
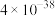 | 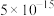 | 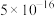 |  | 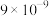 |
 时,可认为沉淀完全。
时,可认为沉淀完全。回答下列问题:
(1)在“焙烧”时为提高效率可采用的措施有
(2)实验室中,“操作A”需要的玻璃仪器有
 在水溶液中可用
在水溶液中可用 将其还原为Te单质,写出该反应的化学方程式:
将其还原为Te单质,写出该反应的化学方程式:(3)“氧化除铁”步骤中可以先调节pH为5,然后再加入
 ,则此时
,则此时 被氧化的离子方程式为
被氧化的离子方程式为(4)测得“滤液I”中
 浓度为
浓度为 ,取1L滤液,则至少加入
,取1L滤液,则至少加入 固体才能使
固体才能使 沉淀完全。
沉淀完全。(5)取1吨含碲化镉80%的废弃玻璃,最终回收得到0.64吨
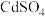 ,则硫酸镉的回收率为
,则硫酸镉的回收率为
您最近一年使用:0次
2022-11-04更新
|
1356次组卷
|
4卷引用:广东省2023届高三一轮复习联考(二)广东卷化学试题
广东省2023届高三一轮复习联考(二)广东卷化学试题广东省部分学校2022-2023学年高三上学期一轮复习联考(二)化学试题(已下线)热点情景汇编-专题十 工艺流程中的新工艺福建省惠安第一中学2022-2023学年高三上学期第三次月考化学试题
8 . N2O、NO和NO2等氮氧化物是空气污染物,含有氮氧化物的尾气需处理后才能排放。
(1)N2O的处理。N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与O2在加热和催化剂作用下生成N2O的化学方程式为________ 。
(2)NO和NO2的处理。已除去N2O的硝酸尾气可用NaOH溶液吸收,主要反应为
NO+NO2+2OH− 2
2 +H2O
+H2O
2NO2+2OH−
 +
+ +H2O
+H2O
①下列措施能提高尾气中NO和NO2去除率的有________ (填字母)。
A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量NaOH溶液
②吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,该晶体中的主要杂质是________ (填化学式);吸收后排放的尾气中含量较高的氮氧化物是________ (填化学式)。
(3)NO的氧化吸收。用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
①在酸性NaClO溶液中,HClO氧化NO生成Cl−和 ,其离子方程式为
,其离子方程式为________ 。
②NaClO溶液的初始pH越小,NO转化率越高。其原因是________ 。

(1)N2O的处理。N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与O2在加热和催化剂作用下生成N2O的化学方程式为
(2)NO和NO2的处理。已除去N2O的硝酸尾气可用NaOH溶液吸收,主要反应为
NO+NO2+2OH−
 2
2 +H2O
+H2O2NO2+2OH−

 +
+ +H2O
+H2O①下列措施能提高尾气中NO和NO2去除率的有
A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量NaOH溶液
②吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,该晶体中的主要杂质是
(3)NO的氧化吸收。用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为
 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。①在酸性NaClO溶液中,HClO氧化NO生成Cl−和
 ,其离子方程式为
,其离子方程式为②NaClO溶液的初始pH越小,NO转化率越高。其原因是

您最近一年使用:0次
2019-06-10更新
|
7392次组卷
|
32卷引用:广东省潮州市饶平县第二中学2021-2022学年高一下学期月考(一)化学试题
广东省潮州市饶平县第二中学2021-2022学年高一下学期月考(一)化学试题2019年江苏省高考化学试题湖南省长沙市第一中学2020届高三第一次月考化学试题河北省邯郸市2019-2020学年高三上学期期中考试化学试题2020届高三化学二轮冲刺新题专练——氮及其氧化物的性质(提升练)2019-2020学年新人教版必修2第5章第2节《氮及其化合物》作业专题3.2 非金属及其化合物(综合提升卷)——巅峰冲刺2020年高考化学二轮专项提升专题1.3 氧化还原反应(综合提升卷)——巅峰冲刺2020年高考化学二轮专项提升第2章 化学键化学反应规律 模拟高考——C挑战区 夯实基础(鲁科版(2019)第二册)第2章 化学键 化学反应与能量 模拟高考——C挑战区 夯实基础(鲁科版必修2)专题4 化学科学与人类文明——C挑战区 模拟高考(苏教版必修2)江苏省苏州新草桥中学2020届高三上学期10月月考化学试题(已下线)2020年高考化学押题预测卷01(新课标Ⅰ卷)--《2020年高考押题预测卷》(已下线)专题6.3 化学原理题(必考)(疑难突破)——巅峰冲刺2020年高考化学二轮专项提升江苏省扬州市江都区大桥高级中学2019-2020学年高二下学期期中考试化学试题江苏省启东中学2021届高三上学期期初考试化学试题鲁科版(2019)高一必修第一册第三章C 高考挑战区 过高考 3年真题强化闯关专题7 第三单元综合拔高练-高中化学必修第二册苏教版2019人教版2019必修第二册 第五章 第二~三节综合拔高练江苏省苏州市工业园区星海实验中学高一下学期3月月考化学试题(已下线)【苏州新东方】04 吴县中学重庆市凤鸣山中学2020-2021学年高一下学期期中考试化学试题湖北省广水市普通中学2020-2021学年高一下学期5月月考化学试题(已下线)第12讲 氮及其化合物(练) — 2022年高考化学一轮复习讲练测(新教材新高考)海南省海南枫叶国际学校2021-2022学年高三上学期第三次月考(1月)化学试题黑龙江省大庆市第四中学2018-2019学年高二下学期第三次月考化学试题(已下线)专题17 原理综合题(已下线)常见无机物的性质江苏省镇江市句容市南京人民中学等三市四校联考2022-2023学年高一下学期4月月考化学试题湖北省黄石市第二中学2023-2024学年高二上学期第三次统测化学试题江苏省常州市联盟校2023-2024学年高一下学期3月阶段调研化学试题江苏省南京市金陵中学2023-2024学年高一下学期3月月考化学试题
9 . 由含硒废料(主要 含S、Se 、Fe2O3、CuO 、ZnO 、SiO2等)制取硒的流程如图:

下列有关说法正确的是

下列有关说法正确的是
| A.“分离”时得到含硫煤油的方法是蒸馏 |
| B.“酸溶”时能除去废料中的全部氧化物杂质 |
C.“酸化”的离子反应为: +2H+=Se↓+SO2↑+H2O +2H+=Se↓+SO2↑+H2O |
| D.若向“酸溶”所得的滤液中加入少量铜,铜不会溶解 |
您最近一年使用:0次
2022-06-30更新
|
1304次组卷
|
9卷引用:广东省广州市海珠外国语实验中学2022-2023学年高三上学期第三次阶段性(期中)考试化学试题
广东省广州市海珠外国语实验中学2022-2023学年高三上学期第三次阶段性(期中)考试化学试题四川省攀枝花市2022届高三下学期第三次统一考试理科综合化学试题(已下线)专题12 工艺流程选择题-备战2023年高考化学母题题源解密(全国通用)河南省顶级名校2022-2023学年高三上学期第一次月考化学试题(已下线)微专题43 常见物质的分离、提纯和鉴别-备战2023年高考化学考点微专题(全国版)河南省濮阳市南乐县第一高级中学2022-2023学年高三上学期10月月考化学试题(已下线)易错点04 氧化还原反应-备战2023年高考化学考试易错题湖南省长沙市第一中学2022-2023学年高三上学期月考(一)化学试题湖南省常德市桃源县第一中学2022-2023学年高三上学期10月月考化学试题
2017·全国·高考真题
10 . Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:

回答下列问题:
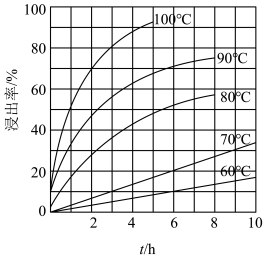
(1)“酸浸”实验中,铁的浸出率结果如下图所示。由图可知,当铁的浸出率为70%时,所采用的实验条件为____________________________ 。
(2)“酸浸”后,钛主要以TiOCl42-形式存在,写出相应反应的离子方程式____________________ 。
(3)TiO2·xH2O沉淀与双氧水、氨水反应40min所得实验结果如下表所示:
分析40℃时TiO2·xH2O转化率最高的原因_______________________________________ 。
(4)Li2Ti5O15中Ti的化合价为+4,其中过氧键的数目为___________ 。
(5)若“滤液②”中c(Mg2+)=0.02 mol/L,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1.0×10-5 mol/L,此时是否有Mg3(PO4)2沉淀生成______________ (列式计算)。FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0×10-24。
(6)写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式____________ 。

回答下列问题:
(1)“酸浸”实验中,铁的浸出率结果如下图所示。由图可知,当铁的浸出率为70%时,所采用的实验条件为

(2)“酸浸”后,钛主要以TiOCl42-形式存在,写出相应反应的离子方程式
(3)TiO2·xH2O沉淀与双氧水、氨水反应40min所得实验结果如下表所示:
| 温度/℃ | 30 | 35 | 40 | 45 | 50 |
| TiO2·xH2O转化率/% | 92 | 95 | 97 | 93 | 88 |
(4)Li2Ti5O15中Ti的化合价为+4,其中过氧键的数目为
(5)若“滤液②”中c(Mg2+)=0.02 mol/L,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1.0×10-5 mol/L,此时是否有Mg3(PO4)2沉淀生成
(6)写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式
您最近一年使用:0次
2017-08-09更新
|
12685次组卷
|
23卷引用:广东省深圳中学2020届高三3月份教学质量监测卷理综化学试题
(已下线)广东省深圳中学2020届高三3月份教学质量监测卷理综化学试题广东省深圳中学2020年高中毕业班教学质量监测卷理科综合化学试题广东省华南师范大学附属中学2021-2022学年高三上学期1月模拟考试化学试题广东省梅州市梅江区梅州中学2021-2022学年高三下学期开学模拟考试化学试题2017年全国普通高等学校招生统一考试理综化学(新课标Ⅰ卷精编版)重庆市第二中学2018届高三3月测试化学试题(已下线)《考前20天终极攻略》-5月28日 工艺流程分析(已下线)解密19 工艺流程题(教师版)——备战2018年高考化学之高频考点解密【全国百强校】河南省实验中学2019届高三上学期质量预测模拟(三)化学试题吉林省四平四中2019届高三下学期第二次模拟考试化学试题四川省成都实验高级中学2020届高三上学期入学考试化学试题四川省棠湖中学2020届高三10月月考理综化学试题2020届高考化学二轮复习大题精准训练——化学工艺流程专题百所名校联考-化学实验综合题型云南省大理白族自治州祥云县第一中学2020届高三下学期4月月考理综化学试题(已下线)专题七 工艺流程题(真题汇编)-2020年高考二轮模块化复习之《元素化合物》名师讲案与提分特训2020届四川省成都市第七中学高三二月份网络教学质量监测卷化学试题吉林省长春市东北师大附中2020届高中毕业班三月份网络教学质量监测卷理科综合化学部分湖北省武汉市华中师范大学第一附属中学2020届高三下学期四月份网络教学质量监测理科综合化学试题四川省宜宾市叙州区第一中学校2020届高三下学期第四学月考试理综化学试题(已下线)解密10 水溶液中离子反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密10 水溶液中离子反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)河南省商丘市回民中学2022-2023学年高三上学期期末考试(线上)化学试题



