名校
1 . Ⅰ.某地出现硫酸型酸雨,现采集了一份雨水样品,其pH随时间变化如下:
(1)用化学方程式表示雨水样品pH变化的原因_______ 。
(2)如将刚采集到的雨水样品与自来水混合(自来水含氯气),pH将_______ (选填“变大”、“变小”、“不变”)。发生反应的化学方程式为_______ 。
(3)为了防治酸雨,降低煤燃烧时产生的SO2,工业上将生石灰(CaO)与含硫煤混合使用制取石膏,请写出燃烧时,有关“固硫”的方程式:_______ 。
Ⅱ.如图是土壤中发生的氮循环示意图,回答下列问题:
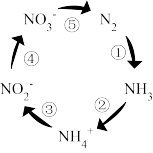
(4)固氮过程的序号是_______ 。人工固氮的反应方程式为_______ 。在细菌微生物的作用下可实现反硝化作用,实现转化的序号为_______ 。为了消除NOx对大气的污染,工业上通常利用NH3还原的方法实现无害化处理,配平NO2与NH3反应的化学方程式:_______ 。
(5)现有NO2和NO的混合气体3L,可用相同状况下3.5L的NH3恰好使其完全转化为N2,则混合气体中NO2和NO体积之比为_______ 。
| 测试时间/h | 0 | 2 | 4 | 6 |
| pH | 4.73 | 4.55 | 4.42 | 4.41 |
(1)用化学方程式表示雨水样品pH变化的原因
(2)如将刚采集到的雨水样品与自来水混合(自来水含氯气),pH将
(3)为了防治酸雨,降低煤燃烧时产生的SO2,工业上将生石灰(CaO)与含硫煤混合使用制取石膏,请写出燃烧时,有关“固硫”的方程式:
Ⅱ.如图是土壤中发生的氮循环示意图,回答下列问题:

(4)固氮过程的序号是
(5)现有NO2和NO的混合气体3L,可用相同状况下3.5L的NH3恰好使其完全转化为N2,则混合气体中NO2和NO体积之比为
您最近一年使用:0次
名校
解题方法
2 . 已知有如图所示转化关系(反应条件略)。
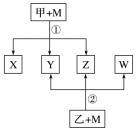
已知:① 、
、 、
、 、
、 均为氧化物。常温下,
均为氧化物。常温下, 是红棕色气体;
是红棕色气体; 能使澄清石灰水变浑浊但不能使品红溶液褪色。②相对分子质量:甲
能使澄清石灰水变浑浊但不能使品红溶液褪色。②相对分子质量:甲 乙。③将甲的浓溶液露置在空气中一段时间,质量减小浓度降低;将乙的浓溶液露置在空气中一段时间,质量增加浓度降低。请完成下列空白:
乙。③将甲的浓溶液露置在空气中一段时间,质量减小浓度降低;将乙的浓溶液露置在空气中一段时间,质量增加浓度降低。请完成下列空白:
(1) 是:
是:_______ 。(填写化学式)
(2)在 与
与 的反应中,被氧化的
的反应中,被氧化的 与被还原的
与被还原的 的物质的量之比是
的物质的量之比是_______ 。
(3) 可用于工业制溴过程中吸收潮湿空气中的
可用于工业制溴过程中吸收潮湿空气中的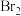 ,写出该反应的化学方程式:
,写出该反应的化学方程式:_______ ,该反应很好地解决了环保问题。
(4)写出Cu与甲的浓溶液反应的化学方程_______ 。

已知:①
 、
、 、
、 、
、 均为氧化物。常温下,
均为氧化物。常温下, 是红棕色气体;
是红棕色气体; 能使澄清石灰水变浑浊但不能使品红溶液褪色。②相对分子质量:甲
能使澄清石灰水变浑浊但不能使品红溶液褪色。②相对分子质量:甲 乙。③将甲的浓溶液露置在空气中一段时间,质量减小浓度降低;将乙的浓溶液露置在空气中一段时间,质量增加浓度降低。请完成下列空白:
乙。③将甲的浓溶液露置在空气中一段时间,质量减小浓度降低;将乙的浓溶液露置在空气中一段时间,质量增加浓度降低。请完成下列空白:(1)
 是:
是:(2)在
 与
与 的反应中,被氧化的
的反应中,被氧化的 与被还原的
与被还原的 的物质的量之比是
的物质的量之比是(3)
 可用于工业制溴过程中吸收潮湿空气中的
可用于工业制溴过程中吸收潮湿空气中的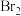 ,写出该反应的化学方程式:
,写出该反应的化学方程式:(4)写出Cu与甲的浓溶液反应的化学方程
您最近一年使用:0次
3 . 请按要求回答下列问题:
(1)钠在空气中燃烧生成淡黄色的固体,则其化学方程式为___________ ;
(2)Al2O3能溶于酸或强碱溶液生成盐和水,则是一种___________ (填“酸性”、“碱性”或“两性”)氧化物;
(3)Fe(OH)3不溶于水,但能溶于酸,请写出Fe(OH)3与盐酸反应的离子方程式___________ ;
(4)氨气极易溶于水,其水溶液显___________ (填“酸”、“碱”或“中”)性;
(5)加热时,浓硫酸可与碳发生反应:C+2H2SO4(浓) CO2↑+2SO2↑+2H2O。在该反应中,浓H2SO4表现出
CO2↑+2SO2↑+2H2O。在该反应中,浓H2SO4表现出___________ (填“吸水”、“脱水”或“氧化”)性;
(6)向试管中的品红溶液中通入一段时间的SO2,观察到品红溶液褪色,然后再加热试管,已褪色的溶液___________ (填“恢复”或“不恢复”)红色。
(7)在常温下,将Cl2通入NaOH溶液中,可以得到漂白液。请写出该反应的离子方程式___________ ;
(1)钠在空气中燃烧生成淡黄色的固体,则其化学方程式为
(2)Al2O3能溶于酸或强碱溶液生成盐和水,则是一种
(3)Fe(OH)3不溶于水,但能溶于酸,请写出Fe(OH)3与盐酸反应的离子方程式
(4)氨气极易溶于水,其水溶液显
(5)加热时,浓硫酸可与碳发生反应:C+2H2SO4(浓)
 CO2↑+2SO2↑+2H2O。在该反应中,浓H2SO4表现出
CO2↑+2SO2↑+2H2O。在该反应中,浓H2SO4表现出(6)向试管中的品红溶液中通入一段时间的SO2,观察到品红溶液褪色,然后再加热试管,已褪色的溶液
(7)在常温下,将Cl2通入NaOH溶液中,可以得到漂白液。请写出该反应的离子方程式
您最近一年使用:0次
2022-02-15更新
|
578次组卷
|
2卷引用:湖南省娄底市新化县2021-2022学年高一上学期期末考试化学试题
解题方法
4 . 下列离子方程式正确的是
A.碳酸氢铵溶液与过量氢氧化钠溶液反应:NH +OH-=NH3•H2O +OH-=NH3•H2O |
| B.铁与浓盐酸反应:2Fe+6H+=2Fe3++3H2↑ |
| C.向硫酸铜溶液中加入少量钠:Cu2++2Na+2H2O=Cu(OH)2↓+2Na++H2↑ |
D.向溴水中通入少量二氧化硫:2SO2+Br2+2H2O=2Br- +2SO +4H+ +4H+ |
您最近一年使用:0次
名校
5 . 用如图所示实验装置可以完成中学化学实验中的一些实验。
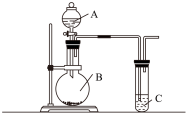
利用如图装置实验,证明二氧化硫气体具有漂白性。已知:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O。在装置A中加入70%的硫酸溶液,B中加入Na2SO3粉末。
(1)C中应加入溶液___ (填“品红”或“石蕊”)。打开分液漏斗活塞,一段时间后观察到C中现象是___ ,反应完全后,将C试管加热一段时间发生的现象是___ 。
(2)如果仅用如图装置进行此实验,可能造成环境污染,此污染属于___ (选填“白色污染”或“酸雨污染"),因此应该在C装置后加一个盛有___ 溶液的洗气瓶。
(3)将二氧化硫气体通入FeCl3溶液中反应一段时间后,滴加KSCN溶液,溶液未变红色,请写出所发生反应的离子方程式:___ 。

利用如图装置实验,证明二氧化硫气体具有漂白性。已知:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O。在装置A中加入70%的硫酸溶液,B中加入Na2SO3粉末。
(1)C中应加入溶液
(2)如果仅用如图装置进行此实验,可能造成环境污染,此污染属于
(3)将二氧化硫气体通入FeCl3溶液中反应一段时间后,滴加KSCN溶液,溶液未变红色,请写出所发生反应的离子方程式:
您最近一年使用:0次
名校
6 . 工业上用氨气和氢气直接合成氨,并通过下列转化过程制备硝酸:

(1)上述物质中为红棕色气体的是___________ (填化学式);
(2)NH3溶于水所得溶液呈___________ (填“酸性”、“碱性”或“中性”);
(3)配平NO2→HNO3的化学方程式:3NO2+H2O=___________HNO3+NO。___________
(4)已知I2与H2.发生反应:I2(g)+H2(g) 2HI(g)。一定条件下,将1molI2和1molH2充入1L的密闭容器中,5min后测得I2的物质的量为0.4mol。
2HI(g)。一定条件下,将1molI2和1molH2充入1L的密闭容器中,5min后测得I2的物质的量为0.4mol。
①用I2表示该反应的化学反应速率是___________ mol·L-1·min-1;
②当其他条件不变时,升高温度,该反应速率将___________ (填“增大”或“减小”)。

(1)上述物质中为红棕色气体的是
(2)NH3溶于水所得溶液呈
(3)配平NO2→HNO3的化学方程式:3NO2+H2O=___________HNO3+NO。
(4)已知I2与H2.发生反应:I2(g)+H2(g)
 2HI(g)。一定条件下,将1molI2和1molH2充入1L的密闭容器中,5min后测得I2的物质的量为0.4mol。
2HI(g)。一定条件下,将1molI2和1molH2充入1L的密闭容器中,5min后测得I2的物质的量为0.4mol。①用I2表示该反应的化学反应速率是
②当其他条件不变时,升高温度,该反应速率将
您最近一年使用:0次
解题方法
7 . 下列含氮物质中,氮元素化合价最低的是
| A.NO | B.NH3 | C.NO2 | D.HNO3 |
您最近一年使用:0次
2021-04-23更新
|
256次组卷
|
4卷引用:黑龙江省宾县第二中学2020-2021学年高一下学期第一次月考化学试题
名校
8 . 媒体报道某工厂排放的废水中含有三氯合镉酸钠NaCdCl3,造成了水体重金属镉污染,三氯合镉酸钠中镉Cd的化合价是( )
| A.+2 | B.+1 | C.﹣4 | D.+4 |
您最近一年使用:0次
2020-11-12更新
|
126次组卷
|
2卷引用:云南省峨山彝族自治县第一中学2020-2021学年高一上学期10月月考化学试题
名校
解题方法
9 . 某离子反应中涉及H2O、ClO-、NH 、H+、N2、Cl-六种微粒。其中N2的分子数随时间变化的曲线如图所示。下列判断正确的是( )
、H+、N2、Cl-六种微粒。其中N2的分子数随时间变化的曲线如图所示。下列判断正确的是( )

 、H+、N2、Cl-六种微粒。其中N2的分子数随时间变化的曲线如图所示。下列判断正确的是( )
、H+、N2、Cl-六种微粒。其中N2的分子数随时间变化的曲线如图所示。下列判断正确的是( )
| A.该反应的还原剂是Cl- |
| B.每生成1个N2分子,转移3个电子 |
| C.参与反应的氧化剂与还原剂的个数比为2:3 |
| D.反应后溶液的酸性明显增强 |
您最近一年使用:0次
2020-10-25更新
|
794次组卷
|
5卷引用:广东省汕头市金山中学2020-2021学年高一上学期10月月考化学试题
10 . 高铁酸钾(K2FeO4)是一种既能杀菌、消毒,又能絮凝净水的水处理剂,工业制备高铁酸钾的反应离子方程式为Fe(OH)3+ClO-+OH-→ +Cl-+H2O(未配平)。下列有关说法不正确的是
+Cl-+H2O(未配平)。下列有关说法不正确的是
 +Cl-+H2O(未配平)。下列有关说法不正确的是
+Cl-+H2O(未配平)。下列有关说法不正确的是A.由上述反应可知,ClO-的氧化性强于 |
| B.高铁酸钾中铁显+6价 |
| C.上述反应中氧化剂和还原剂的物质的量之比为2∶3 |
| D.K2FeO4处理水时,不仅能消毒杀菌,而且生成的Fe3+与水反应形成Fe(OH)3胶体能吸附水中的悬浮杂质 |
您最近一年使用:0次
2020-09-08更新
|
545次组卷
|
3卷引用:河南省洛阳市第一高级中学2021届高三9月月考化学试题



