解题方法
1 . 盐与盐的反应机理较多,某兴趣小组向0.1mol/L的氯化铜溶液(pH为3)中滴加亚硫酸钠溶液,探究其反应机理。查阅资料:
下列说法错误的是
| 铜盐 | 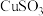 |  |  | CuCl | 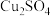 |
| 颜色 | 绿色 | 蓝色 | 红色 | 白色 | 褐色 |
| 溶解性 | 难溶于水 | 难溶于水 | 难溶于水 | 难溶于水 | 易溶于水 |
| A.上述表格中的沉淀都是强电解质 |
B.若生成红色沉淀,反应原理为 |
C.若生成白色沉淀,反应原理为 |
D.若产生蓝色沉淀,反应原理为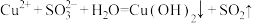 |
您最近一年使用:0次
名校
2 . 某实验小组探究浅黄色草酸亚铁晶体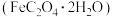 分解产物的装置如图所示。
分解产物的装置如图所示。
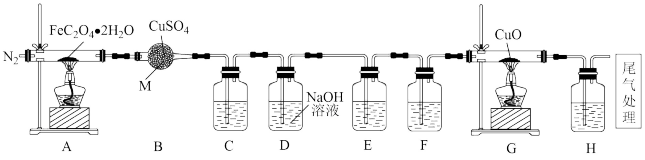
回答下列问题:
(1)仪器M的名称是_______ 。
(2)点燃酒精灯之前,先通入 ,其目的是
,其目的是_______ 。
(3)装置C的作用是_______ 。
(4)如果实验中观察到C、H变浑浊,E不变浑浊,可以得出实验结论:A装置中分解的气体产物一定有_______ (填化学式)。
(5)在 、
、 下进行上述实验,A装置中分别得到甲、乙两种黑色粉末,进行实验并观察到现象如下:
下进行上述实验,A装置中分别得到甲、乙两种黑色粉末,进行实验并观察到现象如下:
根据上述实验,实验①产生蓝色沉淀的离子方程式为_______ 。乙中的成分可能为_______ (填化学式)。
(6)A中固体完全反应后,持续通入 ,熄灭G处酒精灯之前,先
,熄灭G处酒精灯之前,先_______ (填“断开”或“不断开”)G和H之间的导管。
(7)测定草酸亚铁晶体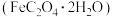 纯度。准确称取
纯度。准确称取 样品于锥形瓶,加入适量的稀硫酸,用
样品于锥形瓶,加入适量的稀硫酸,用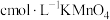 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液
溶液 。滴定反应:
。滴定反应: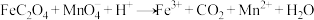 (未配平)。该样品纯度为
(未配平)。该样品纯度为_______ %。若滴定管没有用待装液润洗,测得结果_______ (填“偏高”、“偏低”或“无影响”)。
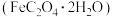 分解产物的装置如图所示。
分解产物的装置如图所示。
回答下列问题:
(1)仪器M的名称是
(2)点燃酒精灯之前,先通入
 ,其目的是
,其目的是(3)装置C的作用是
(4)如果实验中观察到C、H变浑浊,E不变浑浊,可以得出实验结论:A装置中分解的气体产物一定有
(5)在
 、
、 下进行上述实验,A装置中分别得到甲、乙两种黑色粉末,进行实验并观察到现象如下:
下进行上述实验,A装置中分别得到甲、乙两种黑色粉末,进行实验并观察到现象如下:| 实验 | 操作及现象 |
| ① | 用强磁铁接近甲,无明显现象;将黑色粉末溶于稀硫酸,滴加 溶液,产生蓝色沉淀 溶液,产生蓝色沉淀 |
| ② | 用强磁铁接近乙,吸起部分粉末,将吸起来的粉末投入盐酸中,产生气泡;将剩余黑色粉末溶于稀硫酸,滴加 溶液,产生蓝色沉淀 溶液,产生蓝色沉淀 |
(6)A中固体完全反应后,持续通入
 ,熄灭G处酒精灯之前,先
,熄灭G处酒精灯之前,先(7)测定草酸亚铁晶体
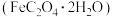 纯度。准确称取
纯度。准确称取 样品于锥形瓶,加入适量的稀硫酸,用
样品于锥形瓶,加入适量的稀硫酸,用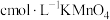 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液
溶液 。滴定反应:
。滴定反应: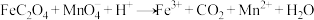 (未配平)。该样品纯度为
(未配平)。该样品纯度为
您最近一年使用:0次
名校
解题方法
3 . 下列化学反应的离子方程式书写正确的是
A.海水提溴中用 的水溶液富集溴: 的水溶液富集溴: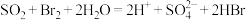 |
B. 溶液和 溶液和 溶液等体积、等浓度混合: 溶液等体积、等浓度混合: |
C.向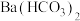 溶液中滴加 溶液中滴加 溶液至恰好沉淀完全: 溶液至恰好沉淀完全: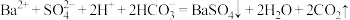 |
D.少量 与 与 溶液反应: 溶液反应: |
您最近一年使用:0次
2023-02-14更新
|
411次组卷
|
4卷引用:湖南省湘潭市第一中学2023届高三下学期入学考试化学试题
湖南省湘潭市第一中学2023届高三下学期入学考试化学试题(已下线)安徽省、云南省、吉林省、黑龙江省2023届高三2月适应性测试变式题(选择题7-10)湖南省岳阳市第一中学2023届高三下学期第七次月考化学试题(已下线)河北省石家庄市2023届高中毕业年级教学质量检测(一模)变式题(选择题1-5)
4 . 纳米氧化锌是一种新型无机功能材料。以氧化锌烟灰(含ZnO及少量Fe2O3、FeO、MnO、CuO)为原料制备纳米氧化锌的工艺流程如图:
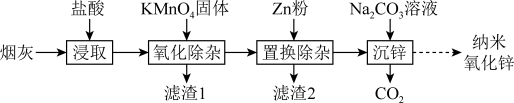
如表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为0.1mol·L-1计算)。
(1)Cu2+基态核外电子排布式为____ 。
(2)“浸取”过程中盐酸不宜过量太多,其可能原因是____ 。
(3)“滤渣1”的成分是MnO2、Fe(OH)3。“氧化除杂”过程中KMnO4与Mn2+发生反应的离子方程式为____ ,溶液pH范围应控制在____ 。
(4)①“沉锌”得到碱式碳酸锌[化学式为2ZnCO3·3Zn(OH)2·2H2O],该反应的离子方程式为____ 。
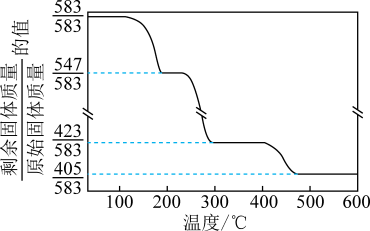
②碱式碳酸锌加热升温过程中固体的质量变化如图所示。350℃时,剩余固体中已不含碳元素,则剩余固体中含有____ (填化学式)。

如表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为0.1mol·L-1计算)。
| 金属离子 | Fe3+ | Fe2+ | Cu2+ | Zn2+ | Mn2+ |
| 开始沉淀的pH | 1.5 | 6.3 | 6.0 | 6.2 | 8.1 |
| 完全沉淀的pH | 2.8 | 8.3 | 8.0 | 8.2 | 10.1 |
(1)Cu2+基态核外电子排布式为
(2)“浸取”过程中盐酸不宜过量太多,其可能原因是
(3)“滤渣1”的成分是MnO2、Fe(OH)3。“氧化除杂”过程中KMnO4与Mn2+发生反应的离子方程式为
(4)①“沉锌”得到碱式碳酸锌[化学式为2ZnCO3·3Zn(OH)2·2H2O],该反应的离子方程式为
②碱式碳酸锌加热升温过程中固体的质量变化如图所示。350℃时,剩余固体中已不含碳元素,则剩余固体中含有

您最近一年使用:0次
2022-05-18更新
|
659次组卷
|
2卷引用:湖南省湘潭市第一中学2022届高三下学期第三次模拟考试化学试题
5 . 碘在生活中有着广泛应用。一种由含碘废水制取单质碘的工艺流程如下:
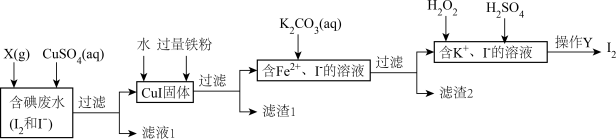
回答下列问题:
(1)检验含碘废水中是否含有I2,常用的试剂是_______ 。
(2)X是一种常见的有刺激性气味的气体,通入X气体的主要目的是将I2还原为I-,反应的离子方程式为_______ 。
(3)分离滤渣1各成分最简便的方法是_______ ;滤渣2在潮湿的空气中能被氧化为红褐色物质,故发生反应的化学方程式为_______ 。
(4)操作Y包括_______ 。
(5)常温下,在得到含K+和I-的溶液时,Fe2+会水解形成胶状物吸附I-,造成I-的损失。若含Fe2+和I-的溶液中c(Fe2+) =0.48 mol·L-1,为减少I-的损失,则必须保持该溶液的pH小于_______ 。(已知常温下Ksp[Fe(OH)2] =4.8×l0-17)

回答下列问题:
(1)检验含碘废水中是否含有I2,常用的试剂是
(2)X是一种常见的有刺激性气味的气体,通入X气体的主要目的是将I2还原为I-,反应的离子方程式为
(3)分离滤渣1各成分最简便的方法是
(4)操作Y包括
(5)常温下,在得到含K+和I-的溶液时,Fe2+会水解形成胶状物吸附I-,造成I-的损失。若含Fe2+和I-的溶液中c(Fe2+) =0.48 mol·L-1,为减少I-的损失,则必须保持该溶液的pH小于
您最近一年使用:0次
名校
解题方法
6 . 下列实验对应的离子方程式不正确 的是
A.C6H5ONa溶液中通入少量CO2:C6H5O-+CO2+H2O→C6H5OH+HCO |
B.将少量NO2通入NaOH溶液:2NO2+2OH-=NO +NO +NO +H2O +H2O |
C.将少量SO2通入NaClO溶液:SO2+H2O+2ClO-=SO +2HClO +2HClO |
| D.向氨水中滴入少量硝酸银溶液:Ag++2NH3·H2O=[Ag(NH3)2]++2H2O |
您最近一年使用:0次
2022-04-29更新
|
300次组卷
|
3卷引用:湖南省湘潭市湘乡市东山学校2022学年高三下学期期中考试化学试题
湖南省湘潭市湘乡市东山学校2022学年高三下学期期中考试化学试题天津市第一中学2021-2022学年高三下学期4月月考化学试题(已下线)卷02 小题素养卷-【小题小卷】冲刺2022年高考化学小题限时集训(全国卷专用)
名校
7 . 马蒂逊(Mathieson)法制备亚氯酸钠 的流程如下:
的流程如下:
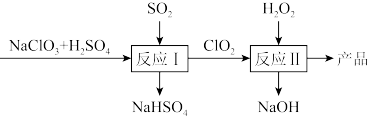
已知:消毒效率就是得到相同的电子数时消耗消毒剂的质量。下列说法正确的是
 的流程如下:
的流程如下:
已知:消毒效率就是得到相同的电子数时消耗消毒剂的质量。下列说法正确的是
A. 的消毒效率比 的消毒效率比 的差 的差 |
B.反应①中 和 和 的物质的量之比为1∶2 的物质的量之比为1∶2 |
| C.反应②反应前后离子数目基本不变 |
D.反应②中 将 将 氧化成 氧化成 |
您最近一年使用:0次
名校
8 . 钯(Pd)是一种不活泼金属,具有优良的吸氢功能,其氢氧化物具有两性。工业上采用如图流程从二氯二氨合钯[Pd(NH3)2Cl2]中提取钯。
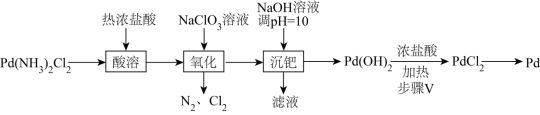
(1)Pd(NH3)2Cl2中钯元素的化合价为____ 。
(2)“酸溶”生成(NH4)2PdCl4,则该反应的化学反应方程式为___ 。
(3)“氧化”后,钯仍以PdCl 形式存在,则“氧化”过程中发生的氧化还原的离子反应方程式为
形式存在,则“氧化”过程中发生的氧化还原的离子反应方程式为____ ,____ 。
(4)“滤液”中含有的阴离子主要是____ ,“沉钯”时,若pH大于10,则上层清液中钯含量升高,其原因为____ 。
(5)“步骤Ⅴ”中需加浓盐酸并加热至100℃浓缩直至蒸干,加浓盐酸的目的是___ 。
(6)已知金属钯密度为12.0g•cm-3,标准状况下,吸附的氢气是其体积的850倍,则此条件下钯的吸附容量R=____ mL•g-1【R为单位质量(g)的钯所吸附氢气的体积(mL),结果保留一位小数】。

(1)Pd(NH3)2Cl2中钯元素的化合价为
(2)“酸溶”生成(NH4)2PdCl4,则该反应的化学反应方程式为
(3)“氧化”后,钯仍以PdCl
 形式存在,则“氧化”过程中发生的氧化还原的离子反应方程式为
形式存在,则“氧化”过程中发生的氧化还原的离子反应方程式为(4)“滤液”中含有的阴离子主要是
(5)“步骤Ⅴ”中需加浓盐酸并加热至100℃浓缩直至蒸干,加浓盐酸的目的是
(6)已知金属钯密度为12.0g•cm-3,标准状况下,吸附的氢气是其体积的850倍,则此条件下钯的吸附容量R=
您最近一年使用:0次
2022-03-20更新
|
204次组卷
|
2卷引用:湖南省湘潭市湘乡市东山学校2022学年高三下学期期中考试化学试题
名校
解题方法
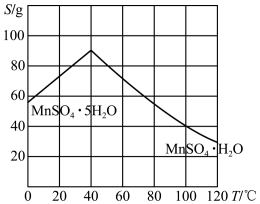
9 . 以黄铁矿(主要成分是FeS2,含少量SiO2)和软锰矿(主要成分是MnO2,含少量Fe2O3、Al2O3)为原料制备MnSO4·H2O的工艺流程如下。回答下列问题:

已知溶液中金属离子开始沉淀和完全沉淀的 如下表所示:
如下表所示:
(1)混合研磨成细粉的目的是_______ 。“酸浸”过程得到的滤液中含有 ,则该过程中主要反应的离子方程式是
,则该过程中主要反应的离子方程式是_______ 。
(2)根据上表数据,计算 的
的
_______ 。若“调 ”后的溶液中
”后的溶液中 浓度为
浓度为 ,则“调
,则“调 ”应控制的
”应控制的 范围是
范围是_______ 。
(3)“沉锰”时, 参与反应的离子方程式是
参与反应的离子方程式是_______ 。
(4)结合图象,分析从“操作A”所得溶液中得到 晶体需进行的操作是
晶体需进行的操作是_______ 、洗涤、干燥.若称取一定质量的 用标准
用标准 溶液滴定(操作过程产生的误差很小可忽略),计算所得样品质量分数大于
溶液滴定(操作过程产生的误差很小可忽略),计算所得样品质量分数大于 ,分析可能的原因是
,分析可能的原因是_______ 。

已知溶液中金属离子开始沉淀和完全沉淀的
 如下表所示:
如下表所示:| 金属离子 |  |  |  |  |
开始沉淀时 的 的 | 8.1 | 7.5 | 2.2 | 3.7 |
沉淀完全时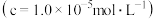 的 的 | 9.6 | 9.0 | 3.2 | 4.7 |
 ,则该过程中主要反应的离子方程式是
,则该过程中主要反应的离子方程式是(2)根据上表数据,计算
 的
的
 ”后的溶液中
”后的溶液中 浓度为
浓度为 ,则“调
,则“调 ”应控制的
”应控制的 范围是
范围是(3)“沉锰”时,
 参与反应的离子方程式是
参与反应的离子方程式是(4)结合图象,分析从“操作A”所得溶液中得到
 晶体需进行的操作是
晶体需进行的操作是 用标准
用标准 溶液滴定(操作过程产生的误差很小可忽略),计算所得样品质量分数大于
溶液滴定(操作过程产生的误差很小可忽略),计算所得样品质量分数大于 ,分析可能的原因是
,分析可能的原因是
您最近一年使用:0次
2022-01-17更新
|
839次组卷
|
6卷引用:湖南省湘潭市第一中学2022届2021-2022学年高三下学期月考化学试题
湖南省湘潭市第一中学2022届2021-2022学年高三下学期月考化学试题山东省烟台市2021-2022学年高三上学期期末考试化学试题(已下线)专题27 无机化工流程-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)(已下线)一轮巩固卷3-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(广东专用)河北省五个一名校联盟2023届高三年级模拟底考试化学试题江西省重点校2022-2023学年高三上学期第二次联考化学试题.
名校
10 . 2020年突如其来的“新冠肺炎”使人们认识到日常杀菌消毒的重要性。氯气、漂白液、漂白粉都是生活中常用的含氯消毒剂。家庭中常常使用的消毒剂主要是84消毒液,可以说化学让生活更美好。下图为84消毒液说明书。请回答下列问题。
(1)84消毒液的有效氯指的是每升含氯消毒剂的氧化能力(得失电子数)相当于多少克Cl2的氧化能力(Cl均转化为Cl-)。若该84消毒液商品的有效氯按53.25g·L-1计算,该消毒液的NaClO的物质的量浓度是___________ 。
(2)常温下用烧碱溶液吸收Cl2制备84消毒液。写出该反应的离子方程式:___________ ,若将Cl2通入热的烧碱溶液中,可以得到NaCl、NaClO和NaClO3的混合液。当混合液中Cl-和ClO 的个数比为15∶2时,混合液中ClO-和ClO
的个数比为15∶2时,混合液中ClO-和ClO 的个数比为
的个数比为___________ ,从氧化还原角度分析Cl2表现了___________ 性。
(3)家庭用84消毒液用法强调,为家庭物品消毒时,要做适当的稀释,喷洒后也不要急于用清水擦拭,要浸泡,这样效果会更好,原因是(用离子方程式表示)___________ (已知酸性:H2CO3>HClO>HCO )。
)。
(4)游泳池水的消毒多用漂粉精,但酸碱性对漂粉精的消毒效果影响明显。池水碱性过强,杀毒作用会___________ (填“增强”或“减弱”)。
(5)Cl2可直接用于杀菌消毒,但常常把氯气制成漂白粉、84消毒液,主要目的是___________。
 | 药品名称 | 84消毒液 |
| 主要成分 | NaClO,有效氯含量50.00g·L-1~60.00g·L-1 | |
| 注意事项 | 不可与其他洗涤剂或消毒液混合使用 | |
| 用法用量 | 稀释后浸泡或洗刷白色衣物、浴缸等1∶200水溶液 餐饮具、瓜果等1∶100水溶液 |
(2)常温下用烧碱溶液吸收Cl2制备84消毒液。写出该反应的离子方程式:
 的个数比为15∶2时,混合液中ClO-和ClO
的个数比为15∶2时,混合液中ClO-和ClO 的个数比为
的个数比为(3)家庭用84消毒液用法强调,为家庭物品消毒时,要做适当的稀释,喷洒后也不要急于用清水擦拭,要浸泡,这样效果会更好,原因是(用离子方程式表示)
 )。
)。(4)游泳池水的消毒多用漂粉精,但酸碱性对漂粉精的消毒效果影响明显。池水碱性过强,杀毒作用会
(5)Cl2可直接用于杀菌消毒,但常常把氯气制成漂白粉、84消毒液,主要目的是___________。
| A.增强漂白能力和消毒作用 |
| B.使它转化为较稳定物质,便于保存和运输 |
| C.使它转化为较易溶于水的物质 |
| D.提高氯的质量分数,有利于漂白、消毒 |
您最近一年使用:0次
2021-12-21更新
|
183次组卷
|
2卷引用:湖南省湘潭凤凰中学2021-2022学年高一上学期12月月考化学试题



