名校
解题方法
1 . 利用元素的化合价推测物质的性质是化学研究的重要手段。如图是硫元素的常见化合价与部分物质类别的对应关系:
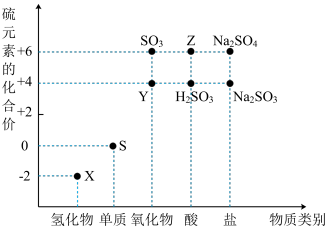
(1)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有_______ (填化学式)。
(2)将X与Y混合,可生成淡黄色固体,该反应中氧化剂与还原剂的物质的量之比为_______ 。
(3)Z的浓溶液与铜单质在一定条件下可以发生化学反应,该反应的化学方程式为_______ 。
(4)Na2S2O3是重要的化工原料。从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是_______ (填字母)。
a.Na2S+S b.Na2SO3+S c.SO2+Na2SO4 d.Na2SO3+Na2SO4
(5)已知Na2SO3能被K2Cr2O7氧化为Na2SO4,则24 mL 0.05 mol·L-1的Na2SO3溶液与20 mL 0.02 mol·L-1的K2Cr2O7溶液恰好反应时,Cr元素在还原产物中的化合价为_______ 。

(1)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有
(2)将X与Y混合,可生成淡黄色固体,该反应中氧化剂与还原剂的物质的量之比为
(3)Z的浓溶液与铜单质在一定条件下可以发生化学反应,该反应的化学方程式为
(4)Na2S2O3是重要的化工原料。从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是
a.Na2S+S b.Na2SO3+S c.SO2+Na2SO4 d.Na2SO3+Na2SO4
(5)已知Na2SO3能被K2Cr2O7氧化为Na2SO4,则24 mL 0.05 mol·L-1的Na2SO3溶液与20 mL 0.02 mol·L-1的K2Cr2O7溶液恰好反应时,Cr元素在还原产物中的化合价为
您最近一年使用:0次
2021-04-25更新
|
418次组卷
|
14卷引用:沪科版高中化学拓展课程第4章《离子互换反应和氧化还原反应》检测题2
沪科版高中化学拓展课程第4章《离子互换反应和氧化还原反应》检测题2【全国百强校】黑龙江省牡丹江市第一高级中学2018-2019学年高一上学期期末考试化学试题【全国百强校】内蒙古自治区杭锦后旗奋斗中学2018-2019学年高一下学期第一次月考化学试题辽宁省大连市辽宁师范大学附属中学2019-2020学年高一下学期期末考试化学试题鲁科版(2019)高一必修第一册第三章第2节 硫的转化 课时4 不同价态硫元素之间的转化酸雨及其防治高一必修第一册(苏教2019版)专题4 第二单元 硫及其化合物的相互转化 课时2 含硫物质之间的转化 氧化还原反应方程式的配平河北省安平中学2020-2021学年高一上学期12月月考化学试题山西省长治市第二中学校2020-2021学年高一下学期期中考试化学试题河北省张家口市第一中学2020-2021学年高一下学期4月月考化学试题贵州省岑巩县第四中学2019-2020学年高一上学期期末考试化学试题贵州省施秉县一中2019-2020学年高一上学期期末考试化学试题湖南省衡阳县四中2022-2023学年高二上学期开学摸底考试化学试题(A卷)江苏省盱眙中学2022-2023学年高一下学期6月阶段测试化学试题黑龙江省双鸭山市第一中学2023-2024学年高二上学期开学考试化学试题
解题方法
2 . 氮、硫、碳的氧化物都会引起环境问题,越来越引起人们的重视。如图是氮、硫元素的各种价态与物质类别的对应关系: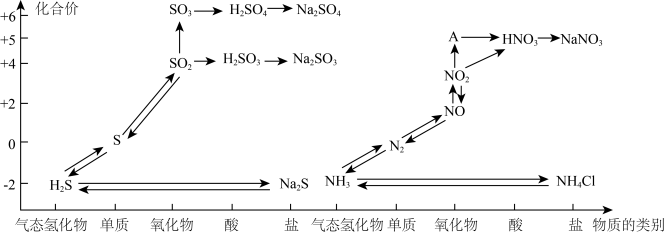
(1)根据A对应的化合价和物质类别,A为___________ (写分子式),从氮元素的化合价能否发生变化的角度判断,图中既有氧化性又有还原性的化合物有____________ 。
(2)浓、稀硝酸的性质既相似又有差别,若要除去铁制品表面的铜镀层应选择________ ,反应的离子方程式为______________ 。
(3)某同学设计了如图所示的套管实验装置(部分装置未画出)来制备SO2并利用实验现象来检验其还原性,制备SO2时选用的试剂为Cu和浓H2SO4。回答下列问题:

①写出制取SO2的化学方程式:_______________ 。
②该同学利用实验现象来检验SO2的还原性,则选用的试剂为_____ 。
A. 品红溶液 B. 酸性高锰酸钾溶液 C. 双氧水(H2O2)
(4)工厂里常采用NaOH溶液吸收NO、NO2的混合气体,使其转化为化工产品NaNO2,试写出其化学反应方程式_______ 。
(5)工业上把海水先进行氧化,再吸收溴,达到富集溴的目的。吸收工艺常用的方法是先用热空气吹出Br2,再用SO2吸收Br2。取吸收后的溶液,向其中加入氯化钡溶液有白色沉淀析出。写出SO2吸收Br2反应的化学方程式为____________ 。

(1)根据A对应的化合价和物质类别,A为
(2)浓、稀硝酸的性质既相似又有差别,若要除去铁制品表面的铜镀层应选择
(3)某同学设计了如图所示的套管实验装置(部分装置未画出)来制备SO2并利用实验现象来检验其还原性,制备SO2时选用的试剂为Cu和浓H2SO4。回答下列问题:

①写出制取SO2的化学方程式:
②该同学利用实验现象来检验SO2的还原性,则选用的试剂为
A. 品红溶液 B. 酸性高锰酸钾溶液 C. 双氧水(H2O2)
(4)工厂里常采用NaOH溶液吸收NO、NO2的混合气体,使其转化为化工产品NaNO2,试写出其化学反应方程式
(5)工业上把海水先进行氧化,再吸收溴,达到富集溴的目的。吸收工艺常用的方法是先用热空气吹出Br2,再用SO2吸收Br2。取吸收后的溶液,向其中加入氯化钡溶液有白色沉淀析出。写出SO2吸收Br2反应的化学方程式为
您最近一年使用:0次
2020-05-29更新
|
706次组卷
|
2卷引用:第五章 化工生产中的重要非金属元素 单元测试
解题方法
3 . 锑(Sb)及其化合物在工业上有许多用途。以辉锑矿(主要成分为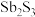 ,还含有PbS、
,还含有PbS、 、CuO、
、CuO、 等)为原料制备金属锑的工艺流程如图所示:
等)为原料制备金属锑的工艺流程如图所示: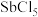 之外,还含有
之外,还含有 、
、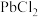 、
、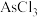 、
、 等;
等;
②常温下: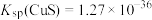 ,
,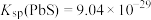 ;
;
③溶液中离子浓度小于或等于 mol/L时,认为该离子沉淀完全。
mol/L时,认为该离子沉淀完全。
(1)滤渣1中除了S之外,还有_______ (填化学式)。
(2)“浸出”时,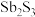 发生反应的化学方程式为
发生反应的化学方程式为_______ 。
(3)该生产流程能实现循环利用的物质是_______ (填化学式)。
(4)常温下,“除铜、铅”时, 和
和 均沉淀完全,此时溶液中的
均沉淀完全,此时溶液中的 不低于
不低于_______ 。所加 也不宜过多,其原因为
也不宜过多,其原因为_______ 。
(5)“除砷”时有 生成,该反应的离子方程式为
生成,该反应的离子方程式为_______ 。
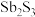 ,还含有PbS、
,还含有PbS、 、CuO、
、CuO、 等)为原料制备金属锑的工艺流程如图所示:
等)为原料制备金属锑的工艺流程如图所示:
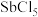 之外,还含有
之外,还含有 、
、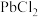 、
、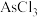 、
、 等;
等;②常温下:
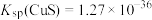 ,
,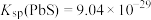 ;
;③溶液中离子浓度小于或等于
 mol/L时,认为该离子沉淀完全。
mol/L时,认为该离子沉淀完全。(1)滤渣1中除了S之外,还有
(2)“浸出”时,
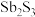 发生反应的化学方程式为
发生反应的化学方程式为(3)该生产流程能实现循环利用的物质是
(4)常温下,“除铜、铅”时,
 和
和 均沉淀完全,此时溶液中的
均沉淀完全,此时溶液中的 不低于
不低于 也不宜过多,其原因为
也不宜过多,其原因为(5)“除砷”时有
 生成,该反应的离子方程式为
生成,该反应的离子方程式为
您最近一年使用:0次
21-22高一下·上海浦东新·阶段练习
4 . 亚硝酸钠( )是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。亚硝酸钠加热到320℃以上会分解产生
)是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。亚硝酸钠加热到320℃以上会分解产生 、
、 和
和 ,其水溶液呈碱性,能与
,其水溶液呈碱性,能与 溶液反应生成难溶于水、易溶于酸的
溶液反应生成难溶于水、易溶于酸的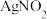 。由于
。由于 有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:
有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:
___________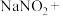 ___________KI+___________=___________NO↑+___________
___________KI+___________=___________NO↑+___________ ___________
___________ ___________
___________ ___________
___________
(1)请完成该化学方程式并配平。___________
(2)从物质分类角度来看, 是
是___________ (填字母代号)。
a.酸 b.酸式盐 c.碱 d.非电解质 e.电解质 f.离子化合物 g.共价化合物
(3)用上述反应来处理 并不是最佳方法,其原因是
并不是最佳方法,其原因是___________ 。从环保角度来讲,要将 转化为氮气,所用物质的
转化为氮气,所用物质的___________ (填“氧化性”或“还原性”)应该比KI更___________ (填“强”或“弱”)。
(4)下列方法不能用来区分固体 和NaCl的是___________(填序号)。
和NaCl的是___________(填序号)。
(5)误食 会导致人体血红蛋白中的
会导致人体血红蛋白中的 转化为
转化为 而中毒,该过程中
而中毒,该过程中 表现出的性质与下列___________(填序号)反应中
表现出的性质与下列___________(填序号)反应中 表现出的性质相同。
表现出的性质相同。
(6)已知亚硝酸钠可以与氯化铵反应生成氮气和氯化钠,写出该反应的化学反应方程式,并用单线桥表示其电子转移的方向和数目:___________ 。
 )是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。亚硝酸钠加热到320℃以上会分解产生
)是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。亚硝酸钠加热到320℃以上会分解产生 、
、 和
和 ,其水溶液呈碱性,能与
,其水溶液呈碱性,能与 溶液反应生成难溶于水、易溶于酸的
溶液反应生成难溶于水、易溶于酸的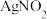 。由于
。由于 有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:
有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:___________
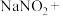 ___________KI+___________=___________NO↑+___________
___________KI+___________=___________NO↑+___________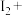 ___________
___________ ___________
___________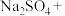 ___________
___________
(1)请完成该化学方程式并配平。
(2)从物质分类角度来看,
 是
是a.酸 b.酸式盐 c.碱 d.非电解质 e.电解质 f.离子化合物 g.共价化合物
(3)用上述反应来处理
 并不是最佳方法,其原因是
并不是最佳方法,其原因是 转化为氮气,所用物质的
转化为氮气,所用物质的(4)下列方法不能用来区分固体
 和NaCl的是___________(填序号)。
和NaCl的是___________(填序号)。| A.分别溶于水 |
B.分别溶于水并滴加 酸化的 酸化的 溶液 溶液 |
| C.分别加强热并收集气体检验 |
| D.用筷子分别蘸取固体品尝味道 |
 会导致人体血红蛋白中的
会导致人体血红蛋白中的 转化为
转化为 而中毒,该过程中
而中毒,该过程中 表现出的性质与下列___________(填序号)反应中
表现出的性质与下列___________(填序号)反应中 表现出的性质相同。
表现出的性质相同。A. |
B. |
C.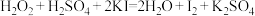 |
D. |
您最近一年使用:0次
21-22高一上·河北廊坊·期末
名校
5 . 从物质类别和元素化合价两个维度研究物质的性质及转化是重要的化学学习方法。氯及其化合物有重要用途,以下是氯元素的“价类二维图”的部分信息。请回答下列问题:

(1)根据图中信息写出Y、Z的化学式_______ 、_______ 。
(2)已知高氯酸(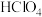 )是强酸,写出高氯酸与铁反应的离子方程式
)是强酸,写出高氯酸与铁反应的离子方程式_______ 。
(3)氯气既有氧化性又有还原性,结合上图说明理由_______ 
(4)实验室可用二氧化锰与浓盐酸在加热条件下制得氯气。写出该反应的化学方程式_______ ,该反应中盐酸表现_______ (填字母)。
A.酸性 B.氧化性 C.还原性 D. 挥发性
(5)84消毒液使用说明中特别提醒不可与洁厕灵混合使用,否则会产生氯气,有关反应方程式为 ,下列有关该反应说法
,下列有关该反应说法不正确 的是_______。
(6)某游泳池常用 来抑制藻类生长,工作人员一次错用
来抑制藻类生长,工作人员一次错用 消毒,因两种物质相互反应,使游泳池的藻类疯长。已知该反应产生了
消毒,因两种物质相互反应,使游泳池的藻类疯长。已知该反应产生了 和
和 ,写出相应的化学方程式
,写出相应的化学方程式_______ 。

(1)根据图中信息写出Y、Z的化学式
(2)已知高氯酸(
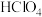 )是强酸,写出高氯酸与铁反应的离子方程式
)是强酸,写出高氯酸与铁反应的离子方程式(3)氯气既有氧化性又有还原性,结合上图说明理由

(4)实验室可用二氧化锰与浓盐酸在加热条件下制得氯气。写出该反应的化学方程式
A.酸性 B.氧化性 C.还原性 D. 挥发性
(5)84消毒液使用说明中特别提醒不可与洁厕灵混合使用,否则会产生氯气,有关反应方程式为
 ,下列有关该反应说法
,下列有关该反应说法| A.n(氧化剂):n(还原剂)=1:1 | B.n(氧化剂):n(还原剂)=1:2 |
C.氧化性: | D. 既是氧化产物又是还原产物 既是氧化产物又是还原产物 |
 来抑制藻类生长,工作人员一次错用
来抑制藻类生长,工作人员一次错用 消毒,因两种物质相互反应,使游泳池的藻类疯长。已知该反应产生了
消毒,因两种物质相互反应,使游泳池的藻类疯长。已知该反应产生了 和
和 ,写出相应的化学方程式
,写出相应的化学方程式
您最近一年使用:0次
2022-03-20更新
|
1086次组卷
|
3卷引用:第二章《 海水中的重要元素----钠和氯》基础过关单元检测-【帮课堂】2022-2023学年高一化学同步精品讲义(人教版2019必修第一册)
(已下线)第二章《 海水中的重要元素----钠和氯》基础过关单元检测-【帮课堂】2022-2023学年高一化学同步精品讲义(人教版2019必修第一册)河北省三河市第二中学2021-2022学年高一上学期期末考试化学试题广东省江门市第二中学2022-2023学年高一上学期期中考试化学试题
名校
解题方法
6 . 氧化还原反应在生产、生活中具有广泛的用途,贯穿古今。
(1)水是人体中含量最多的一种物质。四种基本反应类型与氧化还原反应的关系如图。

试写出有水参加的符合反应类型Ⅳ的一个化学方程式:________________________ ,其中水为______ 剂。
(2)氯化铵溶液常用于焊接。在焊接铜器时可用氯化铵除去铜器表面的氧化铜以便焊接,其反应如下:______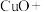 ______
______ ______
______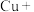 ______
______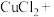 ______
______ ______
______ 。
。
①配平此氧化还原反应的化学方程式。______
②该反应中,被氧化的元素是______ (填元素名称),氧化剂是______ (填化学式)。
(1)水是人体中含量最多的一种物质。四种基本反应类型与氧化还原反应的关系如图。

试写出有水参加的符合反应类型Ⅳ的一个化学方程式:
(2)氯化铵溶液常用于焊接。在焊接铜器时可用氯化铵除去铜器表面的氧化铜以便焊接,其反应如下:______
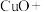 ______
______ ______
______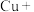 ______
______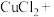 ______
______ ______
______ 。
。①配平此氧化还原反应的化学方程式。
②该反应中,被氧化的元素是
您最近一年使用:0次
2020-09-07更新
|
1796次组卷
|
3卷引用:人教版(2019)高一必修第一册 第一章素养检测
名校
解题方法
7 . 氧化还原反应是一类重要的化学反应,在工农业生产、日常生活中都有广泛的用途。亚硝酸钠(NaNO2)像食盐一样有咸味,但有很强的毒性,误食NaNO2会使人中毒。已知亚硝酸钠能发生如下反应: 2NaNO2+4HI=2NO↑+2NaI+I2+2H2O
(1)用双线桥法标出该反应中电子转移的方向及数目:_______ ,被氧化的原子与被还原的原子数目之比为______ 。
(2)自来水中的 对人类健康会产生危害,碱性条件下用Al粉还原
对人类健康会产生危害,碱性条件下用Al粉还原 ,产物是N2,发生的反应可表示如下,完成方程式并配平。
,产物是N2,发生的反应可表示如下,完成方程式并配平。
____ Al+___  +
+_____ =____ 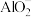 +
+____ N2↑+____
(1)用双线桥法标出该反应中电子转移的方向及数目:
(2)自来水中的
 对人类健康会产生危害,碱性条件下用Al粉还原
对人类健康会产生危害,碱性条件下用Al粉还原 ,产物是N2,发生的反应可表示如下,完成方程式并配平。
,产物是N2,发生的反应可表示如下,完成方程式并配平。 +
+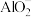 +
+
您最近一年使用:0次
2020-09-16更新
|
248次组卷
|
2卷引用:鲁科版(2019)高一必修第一册第二章B 素养拓展区 过综合 章末素养综合检测
20-21高一·全国·单元测试
8 . 氧化还原反应在生产、生活中具有广泛的用途,贯穿古今。
(1)下列生产、生活中的事例中没有发生氧化还原反应的是____ (填字母)。

(2)水是人体的重要组成部分,是人体中含量最多的一种物质。而“四种基本反应类型与氧化还原反应的关系”可用下图表达。

试写出有水参加的符合反应类型Ⅳ的一个化学方程式:____ ,其中水为____ 剂。
(3)过氧化氢俗称双氧水,医疗上利用它的杀菌消毒作用来清洗伤口。H2O2有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称。如消除采矿业胶液中的氰化物(如KCN),可经以下反应实现:KCN+H2O2+H2O=A+NH3↑,试写出生成物A的化学式:____ ,并阐明H2O2被称为绿色氧化剂的理由:____ 。
(4)氯化铵常用于焊接。如在焊接铜器时用氯化铵除去铜器表面的氧化铜以便焊接,其反应为CuO+NH4Cl Cu+CuCl2+N2↑+H2O(未配平)。
Cu+CuCl2+N2↑+H2O(未配平)。
①配平此氧化还原反应方程式__ CuO+__ NH4Cl
__ Cu+__ CuCl2+__ N2↑+__ H2O。
②该反应中,被氧化的元素是____ (填元素名称),氧化剂是______ (填化学式)。
(1)下列生产、生活中的事例中没有发生氧化还原反应的是

(2)水是人体的重要组成部分,是人体中含量最多的一种物质。而“四种基本反应类型与氧化还原反应的关系”可用下图表达。

试写出有水参加的符合反应类型Ⅳ的一个化学方程式:
(3)过氧化氢俗称双氧水,医疗上利用它的杀菌消毒作用来清洗伤口。H2O2有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称。如消除采矿业胶液中的氰化物(如KCN),可经以下反应实现:KCN+H2O2+H2O=A+NH3↑,试写出生成物A的化学式:
(4)氯化铵常用于焊接。如在焊接铜器时用氯化铵除去铜器表面的氧化铜以便焊接,其反应为CuO+NH4Cl
 Cu+CuCl2+N2↑+H2O(未配平)。
Cu+CuCl2+N2↑+H2O(未配平)。①配平此氧化还原反应方程式

②该反应中,被氧化的元素是
您最近一年使用:0次
2020-08-23更新
|
433次组卷
|
4卷引用:第01章 物质及其变化(A卷基础强化篇)——2020-2021学年高一化学必修第一册同步单元AB卷(新教材人教版)
(已下线)第01章 物质及其变化(A卷基础强化篇)——2020-2021学年高一化学必修第一册同步单元AB卷(新教材人教版)(已下线)【浙江新东方】32甘肃省秦安县第一中学2021-2022学年高一上学期期中考试化学试题江苏省无锡市天一中学2023-2024学年高一上学期平行班11月期中考试化学试题
名校
解题方法
9 . 中科院化学所研制的晶体材料——纳米四氧化三铁,在核磁共振造影及医药上有广泛用途,其生产过程的部分流程如下所示: 纳米四氧化三铁,下列有关叙述错误的是( )
纳米四氧化三铁,下列有关叙述错误的是( )
 纳米四氧化三铁,下列有关叙述错误的是( )
纳米四氧化三铁,下列有关叙述错误的是( )A.纳米四氧化三铁可分散在水中形成胶体,它与 溶液的分散质直径相当 溶液的分散质直径相当 |
| B.纳米四氧化三铁具有磁性,可作为药物载体用于治疗疾病 |
C.在反应①中环丙胺的作用可能是促进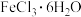 转化为 转化为 |
D.反应②的化学方程式是 |
您最近一年使用:0次
2020-04-15更新
|
115次组卷
|
2卷引用:专题4 化学科学与人类文明 易错疑难集训——A学习区 夯实基础(苏教版必修2)
名校
解题方法
10 . 明矾石的主要成分是K2SO4·Al2(SO4)3·2Al2O3·6H2O,含有少量氧化铁,利用明矾石制备K2SO4的工艺流程如图所示:

据此流程图回答下列问题:
(1)①焙烧炉中Al2(SO4)3与S反应的产物是两种氧化物,该反应的化学方程式为______ ;写出炉气的一种用途________ 。
(2)②中Al2O3参与反应的离子方程式为__________ 。
(3)③中调节pH不能用CO2的理由是____________________ 。
(4)工业冶炼金属铝需要定期更换补充阳极碳块的原因是__________________ 。
(5)纯净氢氧化铝经历两次__________________ (填反应类型)可制得铝。以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池负极的电极反应式是__________________ 。
(6)现有明矾石1 625 t,按上述流程制得780 t Al(OH)3,忽略铝元素的损失,请计算明矾石中钾元素的质量分数为____________ %。

据此流程图回答下列问题:
(1)①焙烧炉中Al2(SO4)3与S反应的产物是两种氧化物,该反应的化学方程式为
(2)②中Al2O3参与反应的离子方程式为
(3)③中调节pH不能用CO2的理由是
(4)工业冶炼金属铝需要定期更换补充阳极碳块的原因是
(5)纯净氢氧化铝经历两次
(6)现有明矾石1 625 t,按上述流程制得780 t Al(OH)3,忽略铝元素的损失,请计算明矾石中钾元素的质量分数为
您最近一年使用:0次
2020-01-14更新
|
315次组卷
|
9卷引用:人教版高中化学必修1第三章《金属及其化合物》测试卷1
人教版高中化学必修1第三章《金属及其化合物》测试卷1云南省西双版纳傣族自治州勐腊县第一中学2019-2020学年高二上学期期末考试化学试题云南省昭通市彝良县一中2019—2020学年高一上学期期末考试化学试题云南省镇雄县民族中学2019-2020学年高一上学期期末考试化学试题贵州省雷山县第四中学2019-2020学年高一上学期期末考试化学试题贵州省剑河县第二中学2019-2020学年高二上学期期末考试化学试题云南省曲靖市马龙区第二中学2019-2020学年 高一上学期期末考试化学试题云南省玉溪市三中2021-2022学年高一下学期3月份入学考试 化学试题云南省玉溪市通海县第三中学2020-2021学年高一上学期期中考试化学试题



