名校
解题方法
1 . 为实现“碳中和”的目标,CO2资源化利用成为研究热点。将CO2转化为甲酸(HCOOH)的一种流程如图:
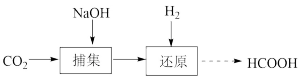
(1)该流程还得到少量乙酸等副产物。甲酸和乙酸(CH3COOH)具有的相同官能团是______ 。
(2)CO2被捕集后生成NaHCO3。理论上1molNaOH捕集的CO2在标准状况下的体积约为______ L。
(3)在催化剂、加热条件下,H2还原NaHCO3得到HCOONa。反应的化学方程式为______ 。

(1)该流程还得到少量乙酸等副产物。甲酸和乙酸(CH3COOH)具有的相同官能团是
(2)CO2被捕集后生成NaHCO3。理论上1molNaOH捕集的CO2在标准状况下的体积约为
(3)在催化剂、加热条件下,H2还原NaHCO3得到HCOONa。反应的化学方程式为
您最近一年使用:0次
2 . 化学既能指导人们科学生活,也能指导人们治理环境污染等。
(1)没有擦干的铸铁锅易生锈,是因为发生了______________ (填“吸氧”或“析氢”)腐蚀。
(2)下列金属的防护方法中,正确的是_____________ (填字母)。
A.在铁制的下水道上焊上铜块
B.衣架和电线的外面包上一层塑料层
C.在自行车的钢圈上刷油漆,以防生锈
(3)汽车尾气中含有CO和NO等有毒气体,在催化剂的作用下,使CO和NO反应转化成 和一种无毒的单质气体,该反应的化学方程式是
和一种无毒的单质气体,该反应的化学方程式是__________________________ 。
(4)钢铁厂、电镀厂在生产过程中会产生酸性废水,一般用_____________(填字母)来进行中和处理。
(5)近几年冬季,雾霾天气有所减少.导致雾霾出现的主要原因是____________ (填字母)。
A. B.
B. C.PM2.5
C.PM2.5
(6)垃圾的再生利用是垃圾资源化的最佳途径,以下垃圾处理方法中正确的是_____________(填字母)。
(1)没有擦干的铸铁锅易生锈,是因为发生了
(2)下列金属的防护方法中,正确的是
A.在铁制的下水道上焊上铜块
B.衣架和电线的外面包上一层塑料层
C.在自行车的钢圈上刷油漆,以防生锈
(3)汽车尾气中含有CO和NO等有毒气体,在催化剂的作用下,使CO和NO反应转化成
 和一种无毒的单质气体,该反应的化学方程式是
和一种无毒的单质气体,该反应的化学方程式是(4)钢铁厂、电镀厂在生产过程中会产生酸性废水,一般用_____________(填字母)来进行中和处理。
A. | B. | C. | D. |
A.
 B.
B. C.PM2.5
C.PM2.5(6)垃圾的再生利用是垃圾资源化的最佳途径,以下垃圾处理方法中正确的是_____________(填字母)。
| A.废旧电池无须处理,集中深埋即可 | B.厨余垃圾直接倒入下水道 |
| C.废旧玻璃可回收熔炼,再生利用 | D.废旧纸张可直接露天焚烧 |
您最近一年使用:0次
解题方法
3 . 铵态氮肥的过度使用会导致水体的富营养化,研究发现,可以用化学方法和生物方法去除氨氮。现探究去除溶液中氨氮的最适宜条件。
(1)化学方法一般用次氯酸钠氧化。次氯酸钠可以和水中溶解的氨气反应得到无毒无害物质,其离子方程式为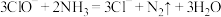 。次氯酸钠溶液中含氯的微粒有
。次氯酸钠溶液中含氯的微粒有_______ 。
(2)规定义:氨氮脱除率
氨氮脱除率受溶液pH 的影响。如表是不同pH下的氨氮脱除率:
的影响。如表是不同pH下的氨氮脱除率:
图示为最适宜pH条件,NaClO和 起始投料比例不同的情况下的氨氮脱除率。
起始投料比例不同的情况下的氨氮脱除率。

试分析为什么最佳pH时,按照3∶2投料氨氮脱除率较低,只有0.6,写出两个可能的原因:_____ 。
(3)由上述信息判断,反应的最佳pH范围是_______ ,最佳投料比是_______ 。
生物方法是利用硝化细菌,将土壤中的 转化为
转化为 后,土壤中的
后,土壤中的 进一步将
进一步将 氧化为
氧化为 。之后,在氧气较少的环境下,
。之后,在氧气较少的环境下, 又可以在反硝化细菌的作用下与
又可以在反硝化细菌的作用下与 反应,使氮以
反应,使氮以 形式放出。
形式放出。
(4)氧气与 反应时,反应物
反应时,反应物 与
与 的物质的量之比为
的物质的量之比为_______ 。写出 与
与 作用生成
作用生成 的离子方程式:
的离子方程式:_______ 。
(5)在VLamol·L 的氨水中滴加等体积0.01mol·L
的氨水中滴加等体积0.01mol·L 的盐酸,使
的盐酸,使 ,则产物中一水合氨浓度为
,则产物中一水合氨浓度为_______ 。
(1)化学方法一般用次氯酸钠氧化。次氯酸钠可以和水中溶解的氨气反应得到无毒无害物质,其离子方程式为
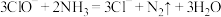 。次氯酸钠溶液中含氯的微粒有
。次氯酸钠溶液中含氯的微粒有(2)规定义:氨氮脱除率

氨氮脱除率受溶液pH
 的影响。如表是不同pH下的氨氮脱除率:
的影响。如表是不同pH下的氨氮脱除率:| pH | 反应前氮元素质量 | 反应后氮元素质量 | 氨氮脱除率 |
| 5.8 | 49.3 | 24.11 | 51.1% |
| 6.9 | 49.3 | 19.08 | 61.3% |
| 7.7 | 49.3 | 16.86 | 65.8% |
| 8.8 | 49.3 | 18.88 | 61.7% |
| 9.3 | 49.3 | 25.29 | x |
 起始投料比例不同的情况下的氨氮脱除率。
起始投料比例不同的情况下的氨氮脱除率。
试分析为什么最佳pH时,按照3∶2投料氨氮脱除率较低,只有0.6,写出两个可能的原因:
(3)由上述信息判断,反应的最佳pH范围是
生物方法是利用硝化细菌,将土壤中的
 转化为
转化为 后,土壤中的
后,土壤中的 进一步将
进一步将 氧化为
氧化为 。之后,在氧气较少的环境下,
。之后,在氧气较少的环境下, 又可以在反硝化细菌的作用下与
又可以在反硝化细菌的作用下与 反应,使氮以
反应,使氮以 形式放出。
形式放出。(4)氧气与
 反应时,反应物
反应时,反应物 与
与 的物质的量之比为
的物质的量之比为 与
与 作用生成
作用生成 的离子方程式:
的离子方程式:(5)在VLamol·L
 的氨水中滴加等体积0.01mol·L
的氨水中滴加等体积0.01mol·L 的盐酸,使
的盐酸,使 ,则产物中一水合氨浓度为
,则产物中一水合氨浓度为
您最近一年使用:0次
4 . 以菱锌矿(主要含有 ,另含有少量
,另含有少量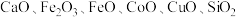 等)为原料电解制
等)为原料电解制 的流程如图:
的流程如图:
(1)“酸浸”时为提高锌的浸出率,可采取的措施有_______ (写出一种即可)。
(2)“调 过滤”中,物质X最适宜选择
过滤”中,物质X最适宜选择_______ (填标号)。
A. B.
B. C.
C.
(3)“氧化过滤”中, 转化为
转化为 的离子方程式为
的离子方程式为_______ 。若反应结束时,溶液 为5,则残留的
为5,则残留的
_______  。
。
(4)“转化过滤”中,除去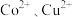 速率先慢后快的原因是
速率先慢后快的原因是_______ 。
(5)“脱钙镁过滤”后,溶液中
_______ 。
(6)“电解”装置示意如图。 ,保护阳极不被酸性电解液腐蚀,相应的电极反应式为
,保护阳极不被酸性电解液腐蚀,相应的电极反应式为_______ 。
②电解过程中,电解液中 含量应维持在
含量应维持在 ,
, 含量不宜过高的原因是
含量不宜过高的原因是_______ 。
 ,另含有少量
,另含有少量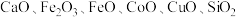 等)为原料电解制
等)为原料电解制 的流程如图:
的流程如图: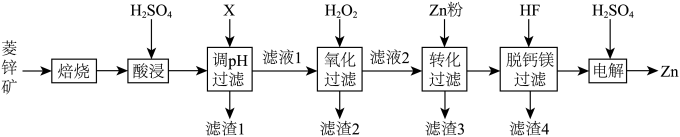
| 物质 |  |  |  |  |
 | 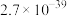 | 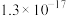 |  |  |
(2)“调
 过滤”中,物质X最适宜选择
过滤”中,物质X最适宜选择A.
 B.
B. C.
C.
(3)“氧化过滤”中,
 转化为
转化为 的离子方程式为
的离子方程式为 为5,则残留的
为5,则残留的
 。
。(4)“转化过滤”中,除去
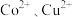 速率先慢后快的原因是
速率先慢后快的原因是(5)“脱钙镁过滤”后,溶液中

(6)“电解”装置示意如图。
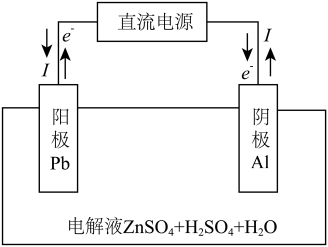
 ,保护阳极不被酸性电解液腐蚀,相应的电极反应式为
,保护阳极不被酸性电解液腐蚀,相应的电极反应式为②电解过程中,电解液中
 含量应维持在
含量应维持在 ,
, 含量不宜过高的原因是
含量不宜过高的原因是
您最近一年使用:0次
解题方法
5 . 高铁酸钾 是一种新型非氯高效消毒净水剂,实验室由
是一种新型非氯高效消毒净水剂,实验室由 氧化法制备制取
氧化法制备制取 的装置如下:
的装置如下:

(1)装置 中产生
中产生 ,反应中化合价降低的元素是
,反应中化合价降低的元素是_______ (填元素名称)。
(2)装置 中
中 被
被 氧化为高铁酸钠
氧化为高铁酸钠 溶液,该反应的离子方程式为
溶液,该反应的离子方程式为_______ 。
(3)充分反应后,在较低温度下向装置 所得溶液中加入浓
所得溶液中加入浓 溶液,析出
溶液,析出 粗产品,则该条件下
粗产品,则该条件下 的溶解度
的溶解度_______ (填“大于”“小于”或“等于”) 的溶解度。
的溶解度。
(4)测定 粗产品纯度的实验步骤如下:
粗产品纯度的实验步骤如下:
步骤一:称取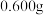 高铁酸钾粗产品配成
高铁酸钾粗产品配成 溶液。取
溶液。取 该溶液于锥形瓶内,向其中加入足量
该溶液于锥形瓶内,向其中加入足量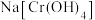 ,发生反应
,发生反应
步骤二:向锥形瓶内加入适量稀 ,发生反应
,发生反应 ;再滴加
;再滴加 硫酸亚铁铵
硫酸亚铁铵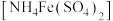 溶液至恰好完全反应,发生反应:
溶液至恰好完全反应,发生反应: 。
。
步骤三:重复以上步骤2~3次,平均消耗硫酸亚铁铵溶液 。
。
计算该 粗产品的纯度
粗产品的纯度______ (写出计算过程)。
 是一种新型非氯高效消毒净水剂,实验室由
是一种新型非氯高效消毒净水剂,实验室由 氧化法制备制取
氧化法制备制取 的装置如下:
的装置如下:
(1)装置
 中产生
中产生 ,反应中化合价降低的元素是
,反应中化合价降低的元素是(2)装置
 中
中 被
被 氧化为高铁酸钠
氧化为高铁酸钠 溶液,该反应的离子方程式为
溶液,该反应的离子方程式为(3)充分反应后,在较低温度下向装置
 所得溶液中加入浓
所得溶液中加入浓 溶液,析出
溶液,析出 粗产品,则该条件下
粗产品,则该条件下 的溶解度
的溶解度 的溶解度。
的溶解度。(4)测定
 粗产品纯度的实验步骤如下:
粗产品纯度的实验步骤如下:步骤一:称取
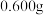 高铁酸钾粗产品配成
高铁酸钾粗产品配成 溶液。取
溶液。取 该溶液于锥形瓶内,向其中加入足量
该溶液于锥形瓶内,向其中加入足量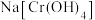 ,发生反应
,发生反应
步骤二:向锥形瓶内加入适量稀
 ,发生反应
,发生反应 ;再滴加
;再滴加 硫酸亚铁铵
硫酸亚铁铵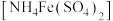 溶液至恰好完全反应,发生反应:
溶液至恰好完全反应,发生反应: 。
。步骤三:重复以上步骤2~3次,平均消耗硫酸亚铁铵溶液
 。
。计算该
 粗产品的纯度
粗产品的纯度
您最近一年使用:0次
2023-02-05更新
|
316次组卷
|
3卷引用:江苏省扬州市2022-2023学年高二上学期普通高中学业水平合格性模拟试卷(一)化学试题
江苏省扬州市2022-2023学年高二上学期普通高中学业水平合格性模拟试卷(一)化学试题江苏省徐州市沛县2023-2024学年高二上学期12月月考化学试题(已下线)题型四 以无机物制备为载体的综合实验-备战2024年高考化学答题技巧与模板构建
解题方法
6 . 工业上用重晶石矿(主要成分为 )制备
)制备 晶体的部分流程如下:
晶体的部分流程如下:

已知: 易溶于水,微溶于乙醇。
易溶于水,微溶于乙醇。
(1)“高温焙烧”时生成 和
和 ,发生反应的化学方程式是
,发生反应的化学方程式是_______ 。
(2)“溶解”时产生 ,可用
,可用 溶液在吸收塔中吸收处理,处理时能提高
溶液在吸收塔中吸收处理,处理时能提高 吸收率的措施有_______。
吸收率的措施有_______。
(3)“结晶”的操作是:蒸发浓缩,冷却后向溶液中加入适量95%的乙醇,搅拌,静置一段时间使晶体充分析出,过滤后用少量95%的乙醇润洗该晶体2~3次,此操作中95%乙醇的作用分别是_______ 。
 )制备
)制备 晶体的部分流程如下:
晶体的部分流程如下:
已知:
 易溶于水,微溶于乙醇。
易溶于水,微溶于乙醇。(1)“高温焙烧”时生成
 和
和 ,发生反应的化学方程式是
,发生反应的化学方程式是(2)“溶解”时产生
 ,可用
,可用 溶液在吸收塔中吸收处理,处理时能提高
溶液在吸收塔中吸收处理,处理时能提高 吸收率的措施有_______。
吸收率的措施有_______。A.适当增大 溶液的浓度 溶液的浓度 | B.增大 气体的流速 气体的流速 |
| C.在吸收塔中气体自下而上,吸收液自上而下喷淋 | D.吸收时适当搅拌 |
(3)“结晶”的操作是:蒸发浓缩,冷却后向溶液中加入适量95%的乙醇,搅拌,静置一段时间使晶体充分析出,过滤后用少量95%的乙醇润洗该晶体2~3次,此操作中95%乙醇的作用分别是
您最近一年使用:0次
2023-02-05更新
|
279次组卷
|
4卷引用:江苏省扬州市2022-2023学年高二上学期普通高中学业水平合格性模拟试卷(一)化学试题
江苏省扬州市2022-2023学年高二上学期普通高中学业水平合格性模拟试卷(一)化学试题江苏省徐州市沛县2023-2024学年高二上学期12月月考化学试题(已下线)合格考汇编3氧化还原反应(已下线)专题三 物质的制备
解题方法
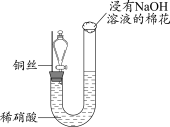
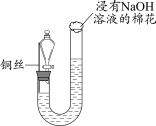
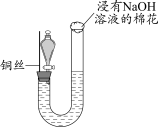
7 . 某同学研究铜与稀硝酸的反应,实验如下(夹持装置已略去,气密性良好)。
(1)HNO3中的氮元素为+5价,是氮元素的最高价态,HNO3具有_______ (填“氧化”或“还原”)性。
(2)步骤III中分液漏斗内的红棕色气体是_______ 。
(3)补全铜与稀硝酸反应的化学方程式:_______ 。_______ (写出一条即可)。
| 步骤I | 步骤II | 步骤III |
|
|
|
| 如图组装仪器并加入药品,分液漏斗旋塞关闭,U型管左侧无气体 | 将铜丝下移,一段时间后,U型管左侧产生无色气体,溶液逐渐变蓝,当液面低于铜丝时,反应逐渐停止 | 将铜丝上移,打开分液漏斗旋塞,U型管内气体进入分液漏斗立即变为红棕色,待气体全部进入分液漏斗后关闭旋塞 |
(2)步骤III中分液漏斗内的红棕色气体是
(3)补全铜与稀硝酸反应的化学方程式:
3Cu+8HNO3(稀)=3Cu(NO3)2+ _______↑+4H2O
_______↑+4H2O
您最近一年使用:0次
2023-01-17更新
|
218次组卷
|
2卷引用:北京市2022-2023学年高二上学期第二次合格考化学试题
名校
解题方法
8 . 海带中含有丰富的碘。为了从海带中提取碘并测定海带中碘元素的百分含量,某研究性学习小组称量了一定量海带,设计并进行了以下实验:
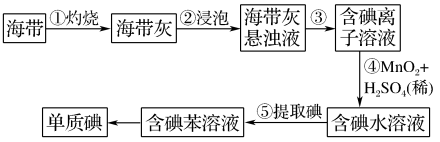
(1) 步骤①中高温灼烧海带时,除需要三脚架、泥三角、酒精灯、玻璃棒外,还需要用的实验仪器是___________ 。
(2)步骤④反应中能生成可溶性的Mn2+,写出该反应的离子方程式:___________ 。
(3) 请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法:___________ 。

(1) 步骤①中高温灼烧海带时,除需要三脚架、泥三角、酒精灯、玻璃棒外,还需要用的实验仪器是
(2)步骤④反应中能生成可溶性的Mn2+,写出该反应的离子方程式:
(3) 请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法:
您最近一年使用:0次
2021-01-03更新
|
396次组卷
|
3卷引用:江苏省南京市第二十九中学2020-2021学年高二上学期合格性考试模化学试题
江苏省南京市第二十九中学2020-2021学年高二上学期合格性考试模化学试题江苏省涟水县第一中学2022-2023学年高二上学期学业水平合格性考试化学试题(已下线)专题01 物质的组成、分类、性质与变化-【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(江苏专用)
9 . 烟气脱硝(将NOx转化成无害物质)是工业废气处理中的重要工艺。相对传统的处理工艺,活性炭吸附脱硝法具有工艺过程无二次污染、氮资源和脱硝剂可循环利用等优点。回答下列问题。
(1)活性炭吸附脱硝法的工艺流程如图所示。
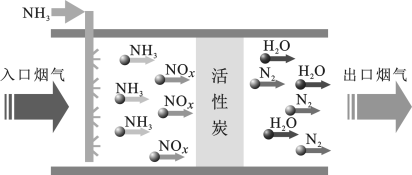
该流程中活性炭的作用是____ ,若入口烟气中NOx以NO形式参加反应,则相应的化学方程式为____ 。
(2)某同学选择如下装置(省略夹持仪器)对该方法进行模拟实验:

①实验前,按h→j,i→k的顺序连接仪器,检查装置____ 。按h→j而不是h→k连接仪器的原因是____ 。
②先通入空气,再打开A、B中分液漏斗的活塞,观察到B中出现红棕色气体,此时,所获得的氮氧化物中一定含有____ 气体。
③装置F除了能用于判断气体流速和脱硝效果外,还可用于____ 。
④为达到更好的脱硝效果,实验中应采取的措施有____ (任写两种)。
⑤常温常压下,以一定流速和比例混合NO、NH3、空气等气体进行模拟实验,现测得NO入口体积分数为3×10-4,出口体积分数为6×10-5,则脱硝百分率为____ %(因混合气体中NO所占比例很小,可忽略脱硝前后气体总体积的变化,计算结果保留小数点后1位)。
(1)活性炭吸附脱硝法的工艺流程如图所示。

该流程中活性炭的作用是
(2)某同学选择如下装置(省略夹持仪器)对该方法进行模拟实验:

①实验前,按h→j,i→k的顺序连接仪器,检查装置
②先通入空气,再打开A、B中分液漏斗的活塞,观察到B中出现红棕色气体,此时,所获得的氮氧化物中一定含有
③装置F除了能用于判断气体流速和脱硝效果外,还可用于
④为达到更好的脱硝效果,实验中应采取的措施有
⑤常温常压下,以一定流速和比例混合NO、NH3、空气等气体进行模拟实验,现测得NO入口体积分数为3×10-4,出口体积分数为6×10-5,则脱硝百分率为
您最近一年使用:0次
2020-12-17更新
|
174次组卷
|
2卷引用:广西壮族自治区2018年12月普通高中学业水平考试化学试题
名校
10 . 用图所示实验装置可以完成中学化学实验中的一些实验。
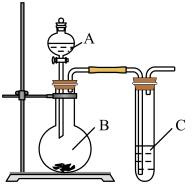
(1)现有稀硝酸、稀盐酸、稀硫酸、碳酸钠粉末、硅酸钠溶液五种试剂。选择三种试剂利用如图装置证明酸性强弱:H2SO4 > H2CO3 > H2SiO3
①仪器B的名称________ ,A中试剂________ ,B中试剂________
②C中发生反应的化学方程式:________________________________
(2)利用如图装置实验,证明二氧化硫气体具有漂白性。已知:Na2SO3 + H2SO4=Na2SO4 +SO2↑+H2O。 在装置A中加入 70%的硫酸溶液,B中加入Na2SO3粉末,
①C中应加入________ 溶液(填“品红”或“石蕊”)。打开分液漏斗活塞,一段时间后观察到C中现象是________________________________ ,反应完全后,将C试管加热一 段时间发生的现象是________________________
②如果仅用如图装置进行此实验,可能造成环境污染,此污染属于________ (选填“白色污染”或“酸雨污染"),因此应该在C装置后加一个盛有________ 溶液的洗气瓶。
③将二氧化硫气体通入FeCl3溶液中反应一.段时间后,滴加KSCN溶液,溶液未变红色,请写出所发生反应的离子方程式:________________________________

(1)现有稀硝酸、稀盐酸、稀硫酸、碳酸钠粉末、硅酸钠溶液五种试剂。选择三种试剂利用如图装置证明酸性强弱:H2SO4 > H2CO3 > H2SiO3
①仪器B的名称
②C中发生反应的化学方程式:
(2)利用如图装置实验,证明二氧化硫气体具有漂白性。已知:Na2SO3 + H2SO4=Na2SO4 +SO2↑+H2O。 在装置A中加入 70%的硫酸溶液,B中加入Na2SO3粉末,
①C中应加入
②如果仅用如图装置进行此实验,可能造成环境污染,此污染属于
③将二氧化硫气体通入FeCl3溶液中反应一.段时间后,滴加KSCN溶液,溶液未变红色,请写出所发生反应的离子方程式:
您最近一年使用:0次
2020-04-19更新
|
586次组卷
|
5卷引用:云南省2019年7月普通高中学业水平考试化学试题