1 . 利用镍黄铁矿(主要成分是 、
、 、
、 )制备硫酸镍铵和磷酸铁的工艺流程如图所示。已知煅烧过程中
)制备硫酸镍铵和磷酸铁的工艺流程如图所示。已知煅烧过程中 、
、 全部参与反应,
全部参与反应, 煅烧后的产物为
煅烧后的产物为 。
。
(1) 的核外电子排布式为
的核外电子排布式为______ 。
(2)煅烧前将镍黄铁矿粉碎,目的是______ ;煅烧过程中 发生反应的化学方程式为
发生反应的化学方程式为____________ 。
(3)酸溶过程中产生的沉淀1是______ (填化学式)。
(4)加入物质X的目的是通过调节 生成
生成 沉淀,则物质X宜选用______(填标号)。
沉淀,则物质X宜选用______(填标号)。
(5) 有关沉淀数据如下表所示(完全沉淀时金属离子浓度
有关沉淀数据如下表所示(完全沉淀时金属离子浓度 )。
)。
若在 下溶液1中的
下溶液1中的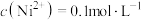 ,则此时需调节溶液的
,则此时需调节溶液的 的范围是
的范围是______ 。
(6)调 后的溶液2溶质是
后的溶液2溶质是 ,其浓溶液可与硫酸铵的饱和溶液反应生成硫酸镍铵
,其浓溶液可与硫酸铵的饱和溶液反应生成硫酸镍铵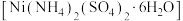 ,以硫酸镍浓溶液制备硫酸镍铵的实验方案为
,以硫酸镍浓溶液制备硫酸镍铵的实验方案为____________ (已知:硫酸镍铵易溶于水,难溶于乙醇;温度越高,其溶解度越大。实验中可选用的试剂:饱和硫酸铵溶液、硫酸镍的浓溶液、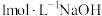 溶液)。
溶液)。
 、
、 、
、 )制备硫酸镍铵和磷酸铁的工艺流程如图所示。已知煅烧过程中
)制备硫酸镍铵和磷酸铁的工艺流程如图所示。已知煅烧过程中 、
、 全部参与反应,
全部参与反应, 煅烧后的产物为
煅烧后的产物为 。
。
(1)
 的核外电子排布式为
的核外电子排布式为(2)煅烧前将镍黄铁矿粉碎,目的是
 发生反应的化学方程式为
发生反应的化学方程式为(3)酸溶过程中产生的沉淀1是
(4)加入物质X的目的是通过调节
 生成
生成 沉淀,则物质X宜选用______(填标号)。
沉淀,则物质X宜选用______(填标号)。A. | B. | C. | D. |
(5)
 有关沉淀数据如下表所示(完全沉淀时金属离子浓度
有关沉淀数据如下表所示(完全沉淀时金属离子浓度 )。
)。沉淀 |
|
|
恰好完全沉淀时 |
| 9 |
 下溶液1中的
下溶液1中的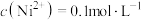 ,则此时需调节溶液的
,则此时需调节溶液的 的范围是
的范围是(6)调
 后的溶液2溶质是
后的溶液2溶质是 ,其浓溶液可与硫酸铵的饱和溶液反应生成硫酸镍铵
,其浓溶液可与硫酸铵的饱和溶液反应生成硫酸镍铵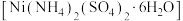 ,以硫酸镍浓溶液制备硫酸镍铵的实验方案为
,以硫酸镍浓溶液制备硫酸镍铵的实验方案为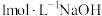 溶液)。
溶液)。
您最近一年使用:0次
2 . 以软锰矿[主要成分为MnO2,还含有钙镁碳酸盐及少量的有机物(C12H22O11)]为原料制备硫酸锰,进而进一步制备Mn3O4。
(1)制备硫酸锰的流程如下:
①写出用硝酸“酸洗”时,有机物与MnO2反应生成CO2的离子方程式___________ 。
②工业上常采用硝酸酸洗而不采用磷酸酸洗的主要原因是___________ 。
③控制反应温度和SO2流速一定,反应2小时,测得“还原”时锰元素的回收率与“制浆”时液固比的关系如图所示。液固比为20∶1浆料中锰元素回收率低于液固比为10∶1的浆料,原因是___________ 。___________ 。pH在4~6范围内,随溶液pH增大,MnS2O6的生成速率减小,其主要原因是___________ 。
(2)已知:pH在6.4~7.6范围内,MnSO4可被氧气直接氧化得到Mn3O4.实际工业生产时,先向MnSO4溶液中通入氨气生成 沉淀,再将
沉淀,再将 氧化得到Mn3O4,其他条件一定时,Mn2+的沉淀率随氨气通入量的变化如图所示。
氧化得到Mn3O4,其他条件一定时,Mn2+的沉淀率随氨气通入量的变化如图所示。___________ 。
②实际工业生产中,当氨气超过30mL时,Mn2+的沉淀率下降的主要原因是___________ 。
(1)制备硫酸锰的流程如下:
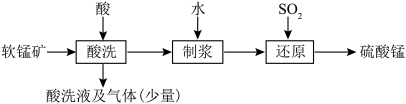
①写出用硝酸“酸洗”时,有机物与MnO2反应生成CO2的离子方程式
②工业上常采用硝酸酸洗而不采用磷酸酸洗的主要原因是
③控制反应温度和SO2流速一定,反应2小时,测得“还原”时锰元素的回收率与“制浆”时液固比的关系如图所示。液固比为20∶1浆料中锰元素回收率低于液固比为10∶1的浆料,原因是

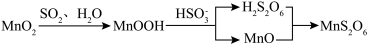
(2)已知:pH在6.4~7.6范围内,MnSO4可被氧气直接氧化得到Mn3O4.实际工业生产时,先向MnSO4溶液中通入氨气生成
 沉淀,再将
沉淀,再将 氧化得到Mn3O4,其他条件一定时,Mn2+的沉淀率随氨气通入量的变化如图所示。
氧化得到Mn3O4,其他条件一定时,Mn2+的沉淀率随氨气通入量的变化如图所示。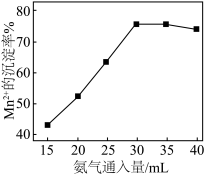
②实际工业生产中,当氨气超过30mL时,Mn2+的沉淀率下降的主要原因是
您最近一年使用:0次
3 . 四氧化三铁俗称磁性氧化铁,常用于制造录音磁带和电讯器材,也可作颜料和抛光剂。某工厂以硫铁矿烧渣(主要含有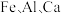 等元素的氧化物及
等元素的氧化物及 )为原料,制备
)为原料,制备 的工艺流程如图所示。
的工艺流程如图所示。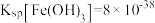 、
、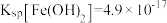 、
、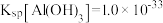 。
。
回答下列问题:
(1)“酸溶”硫铁矿烧渣时,为了加快酸溶速率可采取的措施有___________ (任写两条)。
(2)料渣1的主要成分有___________ (填化学式)。
(3)常温下,已知溶液中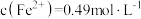 ,要使
,要使 沉淀完全,则“调
沉淀完全,则“调 ”的范围是
”的范围是___________ (保留2位有效数字,一般离子浓度 认为沉淀完全)。
认为沉淀完全)。
(4)加入 “沉铁”时,发生反应的离子方程式为
“沉铁”时,发生反应的离子方程式为___________ 。
(5)①“煅烧1”的目的是将 转化为
转化为 ,若“煅烧2”阶段发生反应时
,若“煅烧2”阶段发生反应时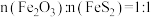 ,则该反应的化学方程式为
,则该反应的化学方程式为___________ 。
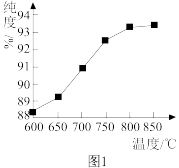
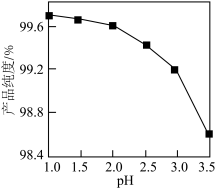
②“煅烧2”时温度对 的纯度有很大影响。已知温度对
的纯度有很大影响。已知温度对 纯度的影响如图1所示,则“煅烧2”时,温度最好控制在
纯度的影响如图1所示,则“煅烧2”时,温度最好控制在___________  。
。 )的晶胞如图2所示。已知:该晶胞底边边长为
)的晶胞如图2所示。已知:该晶胞底边边长为 ,高为
,高为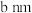 ,l号原子的高为
,l号原子的高为 。
。 为阿伏加德罗常数的值。
为阿伏加德罗常数的值。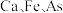 原子的个数之比为
原子的个数之比为___________ ;距2号原子最近的铁有___________ 个。
②该晶体的密度为___________  ,1号原子的坐标为
,1号原子的坐标为___________ 。
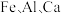 等元素的氧化物及
等元素的氧化物及 )为原料,制备
)为原料,制备 的工艺流程如图所示。
的工艺流程如图所示。
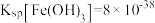 、
、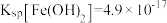 、
、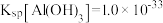 。
。回答下列问题:
(1)“酸溶”硫铁矿烧渣时,为了加快酸溶速率可采取的措施有
(2)料渣1的主要成分有
(3)常温下,已知溶液中
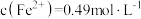 ,要使
,要使 沉淀完全,则“调
沉淀完全,则“调 ”的范围是
”的范围是 认为沉淀完全)。
认为沉淀完全)。(4)加入
 “沉铁”时,发生反应的离子方程式为
“沉铁”时,发生反应的离子方程式为(5)①“煅烧1”的目的是将
 转化为
转化为 ,若“煅烧2”阶段发生反应时
,若“煅烧2”阶段发生反应时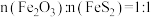 ,则该反应的化学方程式为
,则该反应的化学方程式为②“煅烧2”时温度对
 的纯度有很大影响。已知温度对
的纯度有很大影响。已知温度对 纯度的影响如图1所示,则“煅烧2”时,温度最好控制在
纯度的影响如图1所示,则“煅烧2”时,温度最好控制在 。
。
 )的晶胞如图2所示。已知:该晶胞底边边长为
)的晶胞如图2所示。已知:该晶胞底边边长为 ,高为
,高为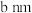 ,l号原子的高为
,l号原子的高为 。
。 为阿伏加德罗常数的值。
为阿伏加德罗常数的值。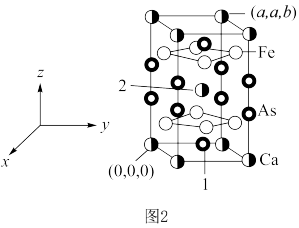
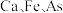 原子的个数之比为
原子的个数之比为②该晶体的密度为
 ,1号原子的坐标为
,1号原子的坐标为
您最近一年使用:0次
解题方法
4 . 氯化亚铜(CuCl)广泛应用于冶金工业,用作催化剂和杀菌剂。以工业废铜渣(主要含CuO,还有CuS、Al2O3、CaO、SiO2、CuFeS2和FeO等)为原料制备CuCl,工业流程如下: (无色)。
(无色)。
②常温下,部分阳离子开始沉淀和完全沉淀(当离子浓度小于 ,视为完全沉淀)时的pH如下表:
,视为完全沉淀)时的pH如下表:
回答下列问题:
(1)滤渣1含有淡黄色固体,此外还含________ ,浸取步骤中CuFeS2参与反应的离子方程式为________ 。
(2)除杂后对滤液进行加热的目的是________ 。
(3)关于该工艺流程,下列说法正确的是________(填字母)。
(4)CuSO4参与反应的离子方程式为________ 。
(5)在实际生产中发现:当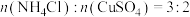 时,CuCl的产率最高,试解释原因:
时,CuCl的产率最高,试解释原因:________ 。
(6)①CuCl晶体的熔点为326℃,液态时不导电,推知CuCl晶体属于________ (填晶体类型)。
②通过分析CuCl________ 图谱可获得晶体结构相关信息。通过图谱分析,发现CuCl晶胞与金刚石晶胞类似,晶胞参数为xnm,铜原子半径为ynm,氯原子半径为znm,则原子的空间占有率为________________ (结果化简)。

 (无色)。
(无色)。②常温下,部分阳离子开始沉淀和完全沉淀(当离子浓度小于
 ,视为完全沉淀)时的pH如下表:
,视为完全沉淀)时的pH如下表:| 物质 | Fe3+ | Al3+ | Cu2+ | Fe2+ |
| 开始沉淀的pH | 1.6 | 3.2 | 5.2 | 6.8 |
| 完全沉淀的pH | 3.1 | 4.7 | 6.7 | 8.3 |
(1)滤渣1含有淡黄色固体,此外还含
(2)除杂后对滤液进行加热的目的是
(3)关于该工艺流程,下列说法正确的是________(填字母)。
| A.把CuO改为ZnO也能达到除杂的目的 |
| B.本流程还可以得到一种常用作化肥的副产物 |
| C.为了加快浸取速率,可以采取的措施:粉碎废渣、搅拌,高温等 |
| D.“系列操作”可能是抽滤、依次用温度较低的SO2水溶液与无水乙醇洗涤沉淀、真空干燥 |
(5)在实际生产中发现:当
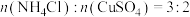 时,CuCl的产率最高,试解释原因:
时,CuCl的产率最高,试解释原因:(6)①CuCl晶体的熔点为326℃,液态时不导电,推知CuCl晶体属于
②通过分析CuCl
您最近一年使用:0次
名校
解题方法
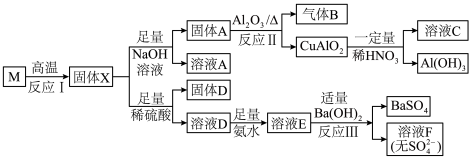
5 . 固态化合物M的组成为CuSi2O5,以M为原料实现如下转化:
(1)①固体D的成分为_______ ,溶液E中含氮微粒有_______ 。
②写出反应Ⅱ的化学反应方程式_______ 。
③溶液F加热可得纳米 ,过程中pH会明显下降,原因是
,过程中pH会明显下降,原因是_______ 。
(2)下列说法正确的是_______。
(3)已知 能溶于较浓强碱溶液,蓝色溶液C中可能存在铝元素,请设计实验方案进行检验
能溶于较浓强碱溶液,蓝色溶液C中可能存在铝元素,请设计实验方案进行检验_______ 。
(1)①固体D的成分为
②写出反应Ⅱ的化学反应方程式
③溶液F加热可得纳米
 ,过程中pH会明显下降,原因是
,过程中pH会明显下降,原因是(2)下列说法正确的是_______。
| A.反应Ⅰ不能在陶瓷坩埚中进行 |
| B.固体X可溶于浓氨水 |
| C.溶液A经净化处理后可用于工业粘合剂 |
D.反应Ⅲ中发生的离子反应有: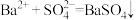 |
(3)已知
 能溶于较浓强碱溶液,蓝色溶液C中可能存在铝元素,请设计实验方案进行检验
能溶于较浓强碱溶液,蓝色溶液C中可能存在铝元素,请设计实验方案进行检验
您最近一年使用:0次
6 .  常用于玻璃、陶瓷中作染色剂,含铝合金钢具有韧性好、高温塑性强等优点,可用于制造机床结构部件。工业上常用铝钒混合矿(主要成分为
常用于玻璃、陶瓷中作染色剂,含铝合金钢具有韧性好、高温塑性强等优点,可用于制造机床结构部件。工业上常用铝钒混合矿(主要成分为 、
、 ,还含
,还含 、
、 、
、 、
、 等杂质)提取高熔点金属单质钼和
等杂质)提取高熔点金属单质钼和 ,其工艺流程如图所示。
,其工艺流程如图所示。 、
、 、
、 、
、 和
和 均可与纯碱反应生成对应的钠盐,而
均可与纯碱反应生成对应的钠盐,而 不行。
不行。
②“气体X”为混合气体,经处理后得“气体Y”。
③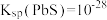 ,
, ,
,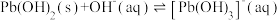
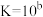 。
。
④“滤渣Ⅳ”主要成分是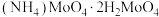 。
。
回答下列问题:
(1)“焙烧”时,采用逆流式投料,且分批加入铝钒混合矿、碳酸钠粉末,其目的是_______ , 参与反应的化学方程式为
参与反应的化学方程式为_______ 。
(2)“气体X”经洗气操作可获得较纯净的“气体Y”,洗气时选择的试剂是_______ ,“滤渣Ⅲ”的主要成分是_______ (填化学式)。
(3)“沉铅”过程中,总反应为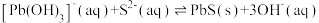 则该反应的平衡常数
则该反应的平衡常数
_______ 。
(4)“沉钒”后,经过滤、洗涤、干燥,将所得固体进行煅烧,当固体质量减少16.8t时,理论上制得 的质量为
的质量为_______ t。
(5)“滤渣Ⅳ”中需要加入稍过量的 还原
还原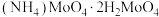 制
制 ,加入稍过量
,加入稍过量 的原因是
的原因是_______ 。
 常用于玻璃、陶瓷中作染色剂,含铝合金钢具有韧性好、高温塑性强等优点,可用于制造机床结构部件。工业上常用铝钒混合矿(主要成分为
常用于玻璃、陶瓷中作染色剂,含铝合金钢具有韧性好、高温塑性强等优点,可用于制造机床结构部件。工业上常用铝钒混合矿(主要成分为 、
、 ,还含
,还含 、
、 、
、 、
、 等杂质)提取高熔点金属单质钼和
等杂质)提取高熔点金属单质钼和 ,其工艺流程如图所示。
,其工艺流程如图所示。
 、
、 、
、 、
、 和
和 均可与纯碱反应生成对应的钠盐,而
均可与纯碱反应生成对应的钠盐,而 不行。
不行。②“气体X”为混合气体,经处理后得“气体Y”。
③
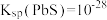 ,
, ,
,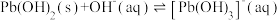
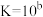 。
。④“滤渣Ⅳ”主要成分是
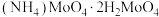 。
。回答下列问题:
(1)“焙烧”时,采用逆流式投料,且分批加入铝钒混合矿、碳酸钠粉末,其目的是
 参与反应的化学方程式为
参与反应的化学方程式为(2)“气体X”经洗气操作可获得较纯净的“气体Y”,洗气时选择的试剂是
(3)“沉铅”过程中,总反应为
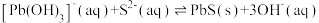 则该反应的平衡常数
则该反应的平衡常数
(4)“沉钒”后,经过滤、洗涤、干燥,将所得固体进行煅烧,当固体质量减少16.8t时,理论上制得
 的质量为
的质量为(5)“滤渣Ⅳ”中需要加入稍过量的
 还原
还原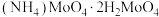 制
制 ,加入稍过量
,加入稍过量 的原因是
的原因是
您最近一年使用:0次
名校
解题方法
7 . 锆被称为原子时代的头号金属。一种以氧氯化锆(主要含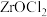 ,还含有少量Fe、Cr、Hf等元素)为原料生产金属锆的工艺流程如下:
,还含有少量Fe、Cr、Hf等元素)为原料生产金属锆的工艺流程如下:
①“酸溶”后溶液中各金属元素的存在形式为: 、
、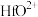 、
、 、
、 ;
;
②25℃时, ,
,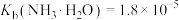 ;
;
回答下列问题:
(1)“萃取”时,锆元素可与萃取剂形成多种络合物,写出生成 的离子方程式:
的离子方程式:___________ 。
(2)“沉淀”后,“废液”中 ,则“废液”中
,则“废液”中
_______ mol•L-1。
(3)“沸腾氯化”时, 转化为
转化为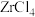 ,同时生成一种还原性气体,该反应的化学方程式为
,同时生成一种还原性气体,该反应的化学方程式为___________ 。
(4)①“还原”的主要目的是___________ 。
②FeCl3沸点远低于 的可能原因为
的可能原因为___________ 。
(5)某种掺杂CaO的 晶胞如图所示,Ca位于晶胞的面心。
晶胞如图所示,Ca位于晶胞的面心。___________ 。
②已知该晶胞为立方晶胞,晶胞中O与Zr的最小间距为anm,设 为阿伏加德罗常数的值,该晶体的密度为
为阿伏加德罗常数的值,该晶体的密度为___________ 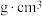 (列出计算式)。
(列出计算式)。
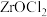 ,还含有少量Fe、Cr、Hf等元素)为原料生产金属锆的工艺流程如下:
,还含有少量Fe、Cr、Hf等元素)为原料生产金属锆的工艺流程如下:
①“酸溶”后溶液中各金属元素的存在形式为:
 、
、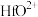 、
、 、
、 ;
;②25℃时,
 ,
,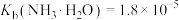 ;
;| 物质 | 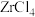 |  |  |  | 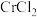 |
| 沸点/℃ | 331 | 315 | 1300 | 700 | 1150 |
(1)“萃取”时,锆元素可与萃取剂形成多种络合物,写出生成
 的离子方程式:
的离子方程式:(2)“沉淀”后,“废液”中
 ,则“废液”中
,则“废液”中
(3)“沸腾氯化”时,
 转化为
转化为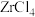 ,同时生成一种还原性气体,该反应的化学方程式为
,同时生成一种还原性气体,该反应的化学方程式为(4)①“还原”的主要目的是
②FeCl3沸点远低于
 的可能原因为
的可能原因为(5)某种掺杂CaO的
 晶胞如图所示,Ca位于晶胞的面心。
晶胞如图所示,Ca位于晶胞的面心。
②已知该晶胞为立方晶胞,晶胞中O与Zr的最小间距为anm,设
 为阿伏加德罗常数的值,该晶体的密度为
为阿伏加德罗常数的值,该晶体的密度为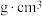 (列出计算式)。
(列出计算式)。
您最近一年使用:0次
名校
8 .  是一种用途极广的稀土材料,可广泛应用于多种研究领域。由
是一种用途极广的稀土材料,可广泛应用于多种研究领域。由 矿制备
矿制备 的工艺流程如下图所示:
的工艺流程如下图所示:
(1) 为镧系的稀土元素,在元素周期表中的位置是
为镧系的稀土元素,在元素周期表中的位置是_______ ,在周期表中共有_______ 种稀土元素。
(2) 是
是_______ (填“复盐”或“混盐”),将 矿粉采用如下图所示方式焙烧的优点是
矿粉采用如下图所示方式焙烧的优点是_______ 。_______ 。
(4)溶解度关系:
_______ 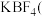 填“
填“ ”或“
”或“ ”)。
”)。
(5)实验室模拟操作N时,检验 是否沉淀完全的操作是
是否沉淀完全的操作是_______ 。若恰好沉淀完全时,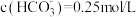 ,则溶液的
,则溶液的
_______ 。已知: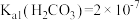 、
、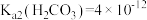 、
、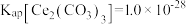 。
。
(6)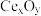 是一种常见的催化剂,用太阳光照射
是一种常见的催化剂,用太阳光照射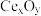 ,当
,当 时,电子吸收能量由M跃迁至N,并形成
时,电子吸收能量由M跃迁至N,并形成 和
和 ,
, 和
和 分别在催化剂表面进行反应,其反应过程如下图所示,则
分别在催化剂表面进行反应,其反应过程如下图所示,则 具有
具有_______ 性(填“氧化”或“还原”,下同),Y为_______ 产物。 具有与
具有与 相似的晶胞结构,若
相似的晶胞结构,若 晶体的密度为
晶体的密度为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则
,则 晶胞的边长为
晶胞的边长为_______ fm。
 是一种用途极广的稀土材料,可广泛应用于多种研究领域。由
是一种用途极广的稀土材料,可广泛应用于多种研究领域。由 矿制备
矿制备 的工艺流程如下图所示:
的工艺流程如下图所示:
(1)
 为镧系的稀土元素,在元素周期表中的位置是
为镧系的稀土元素,在元素周期表中的位置是(2)
 是
是 矿粉采用如下图所示方式焙烧的优点是
矿粉采用如下图所示方式焙烧的优点是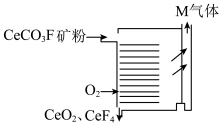
(4)溶解度关系:

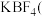 填“
填“ ”或“
”或“ ”)。
”)。(5)实验室模拟操作N时,检验
 是否沉淀完全的操作是
是否沉淀完全的操作是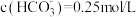 ,则溶液的
,则溶液的
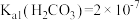 、
、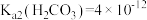 、
、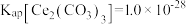 。
。(6)
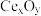 是一种常见的催化剂,用太阳光照射
是一种常见的催化剂,用太阳光照射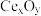 ,当
,当 时,电子吸收能量由M跃迁至N,并形成
时,电子吸收能量由M跃迁至N,并形成 和
和 ,
, 和
和 分别在催化剂表面进行反应,其反应过程如下图所示,则
分别在催化剂表面进行反应,其反应过程如下图所示,则 具有
具有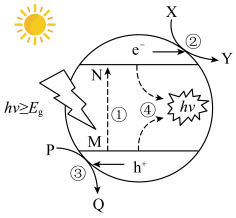
 具有与
具有与 相似的晶胞结构,若
相似的晶胞结构,若 晶体的密度为
晶体的密度为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则
,则 晶胞的边长为
晶胞的边长为
您最近一年使用:0次
解题方法
9 . CrCl3易溶于水和乙醇,难溶于乙醚,在潮湿空气中易形成CrCl3·6H2O,高温下易被O2氧化。
(1)制备无水CrCl3.实验室用Cr2O3和CCl4在高温下制备无水CrCl3的实验装置如下(加热、夹持及尾气处理装置略去):___________ 。
②若实验过程中管式炉发生堵塞,出现的实验现象是___________ 。
③补充完整实验结束时的操作:停止加热管式炉,撤去水浴装置,___________ ,打开管式炉取出产品。
(2)测定无水CrCl3样品的纯度。准确称取0.2000g样品,配成250mL溶液。取25.00mL溶液于碘量瓶中,加热至沸腾后,加适量NaOH溶液,生成 沉淀。冷却后,加足量H2O2至沉淀完全转化为Na2CrO4加热煮沸一段时间,冷却后加入稀H2SO4,再加入足量KI溶液,充分反应后生成Cr3+和I2.用0.02500mol⋅L-1Na2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液12.00mL。已知:
沉淀。冷却后,加足量H2O2至沉淀完全转化为Na2CrO4加热煮沸一段时间,冷却后加入稀H2SO4,再加入足量KI溶液,充分反应后生成Cr3+和I2.用0.02500mol⋅L-1Na2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液12.00mL。已知:  。
。
① 与H2O2反应的离子方程式为
与H2O2反应的离子方程式为___________ 。
②样品中无水CrCl3的质量分数为___________ (写出计算过程)。
(3)补充完整用含铬污泥[含 、
、 及不溶于酸的杂质]制备CrCl3⋅6H2O晶体的实验方案:向含铬污泥中缓慢加入盐酸使固体充分反应,过滤,
及不溶于酸的杂质]制备CrCl3⋅6H2O晶体的实验方案:向含铬污泥中缓慢加入盐酸使固体充分反应,过滤,___________ ,抽滤,干燥,得到CrCl3·6H2O晶体。[已知: 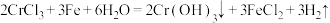 。实验中须使用的试剂:铁粉、盐酸、硝酸酸化的硝酸银溶液、蒸馏水、乙醚]
。实验中须使用的试剂:铁粉、盐酸、硝酸酸化的硝酸银溶液、蒸馏水、乙醚]
(1)制备无水CrCl3.实验室用Cr2O3和CCl4在高温下制备无水CrCl3的实验装置如下(加热、夹持及尾气处理装置略去):
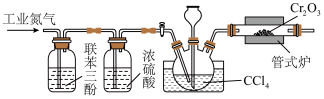
②若实验过程中管式炉发生堵塞,出现的实验现象是
③补充完整实验结束时的操作:停止加热管式炉,撤去水浴装置,
(2)测定无水CrCl3样品的纯度。准确称取0.2000g样品,配成250mL溶液。取25.00mL溶液于碘量瓶中,加热至沸腾后,加适量NaOH溶液,生成
 沉淀。冷却后,加足量H2O2至沉淀完全转化为Na2CrO4加热煮沸一段时间,冷却后加入稀H2SO4,再加入足量KI溶液,充分反应后生成Cr3+和I2.用0.02500mol⋅L-1Na2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液12.00mL。已知:
沉淀。冷却后,加足量H2O2至沉淀完全转化为Na2CrO4加热煮沸一段时间,冷却后加入稀H2SO4,再加入足量KI溶液,充分反应后生成Cr3+和I2.用0.02500mol⋅L-1Na2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液12.00mL。已知:  。
。①
 与H2O2反应的离子方程式为
与H2O2反应的离子方程式为②样品中无水CrCl3的质量分数为
(3)补充完整用含铬污泥[含
 、
、 及不溶于酸的杂质]制备CrCl3⋅6H2O晶体的实验方案:向含铬污泥中缓慢加入盐酸使固体充分反应,过滤,
及不溶于酸的杂质]制备CrCl3⋅6H2O晶体的实验方案:向含铬污泥中缓慢加入盐酸使固体充分反应,过滤,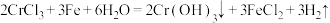 。实验中须使用的试剂:铁粉、盐酸、硝酸酸化的硝酸银溶液、蒸馏水、乙醚]
。实验中须使用的试剂:铁粉、盐酸、硝酸酸化的硝酸银溶液、蒸馏水、乙醚]
您最近一年使用:0次
10 . 以钛白副产品(含 及少量
及少量 )和
)和 为原料制备的超微细
为原料制备的超微细 ,可广泛用于新型电池材料、感光材料的生产。
,可广泛用于新型电池材料、感光材料的生产。
已知:①25℃时,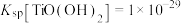 ;
;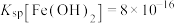 ;
;
② 不溶于水,溶于硫酸。
不溶于水,溶于硫酸。
③沉淀速度过快,沉淀的粒径会变大,包裹的杂质会变多。
(1) 的制备。将一定量的钛白副产品用热水溶解,在搅拌下加入还原铁粉,反应后pH为4~5,过滤得到
的制备。将一定量的钛白副产品用热水溶解,在搅拌下加入还原铁粉,反应后pH为4~5,过滤得到 溶液。在搅拌下先后加入氨水和草酸溶液,经
溶液。在搅拌下先后加入氨水和草酸溶液,经 调节pH、过滤、水洗、烘干后得到超微细FeC2O4·2H2O。
调节pH、过滤、水洗、烘干后得到超微细FeC2O4·2H2O。
①加入还原铁粉的作用是___________ ;
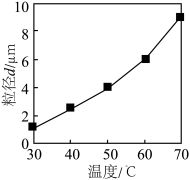
②温度对沉淀粒径的影响如图,加入氨水和草酸溶液过程需控制温度在40℃的原因是___________ ;___________ 。 的结构。
的结构。 晶体为片层结构,层内每个
晶体为片层结构,层内每个 与2个
与2个 和2个
和2个 相连,形成1个铁氧八面体。在图中补全该结构
相连,形成1个铁氧八面体。在图中补全该结构___________ 。 晶体层与层之间的作用力为
晶体层与层之间的作用力为___________ 。 的性质。将
的性质。将 在氮气的氛围中加热分解。加热过程中固体残留率[固体残留率=
在氮气的氛围中加热分解。加热过程中固体残留率[固体残留率= ]随温度的变化如图所示,B点时,固体只含有一种铁的氧化物,则AB段发生反应的化学方程式:
]随温度的变化如图所示,B点时,固体只含有一种铁的氧化物,则AB段发生反应的化学方程式:___________ 。
 及少量
及少量 )和
)和 为原料制备的超微细
为原料制备的超微细 ,可广泛用于新型电池材料、感光材料的生产。
,可广泛用于新型电池材料、感光材料的生产。已知:①25℃时,
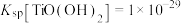 ;
;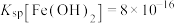 ;
;②
 不溶于水,溶于硫酸。
不溶于水,溶于硫酸。③沉淀速度过快,沉淀的粒径会变大,包裹的杂质会变多。
(1)
 的制备。将一定量的钛白副产品用热水溶解,在搅拌下加入还原铁粉,反应后pH为4~5,过滤得到
的制备。将一定量的钛白副产品用热水溶解,在搅拌下加入还原铁粉,反应后pH为4~5,过滤得到 溶液。在搅拌下先后加入氨水和草酸溶液,经
溶液。在搅拌下先后加入氨水和草酸溶液,经 调节pH、过滤、水洗、烘干后得到超微细FeC2O4·2H2O。
调节pH、过滤、水洗、烘干后得到超微细FeC2O4·2H2O。①加入还原铁粉的作用是
②温度对沉淀粒径的影响如图,加入氨水和草酸溶液过程需控制温度在40℃的原因是
 的结构。
的结构。 晶体为片层结构,层内每个
晶体为片层结构,层内每个 与2个
与2个 和2个
和2个 相连,形成1个铁氧八面体。在图中补全该结构
相连,形成1个铁氧八面体。在图中补全该结构 晶体层与层之间的作用力为
晶体层与层之间的作用力为
 的性质。将
的性质。将 在氮气的氛围中加热分解。加热过程中固体残留率[固体残留率=
在氮气的氛围中加热分解。加热过程中固体残留率[固体残留率= ]随温度的变化如图所示,B点时,固体只含有一种铁的氧化物,则AB段发生反应的化学方程式:
]随温度的变化如图所示,B点时,固体只含有一种铁的氧化物,则AB段发生反应的化学方程式: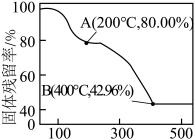
您最近一年使用:0次





