解题方法
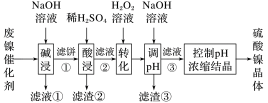
1 . 某油脂厂废弃的油脂加氢镍催化剂主要含金属Ni、Al、Fe及其氧化物,还有少量其他不溶性物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体(NiSO4·7H2O):
回答下列问题:
(1)“碱浸”中NaOH的两个作用分别是______ 。为回收金属,用稀硫酸将“滤液①”调为中性,生成沉淀。写出该反应的离子方程式______ 。
(2)“滤液②”中含有的金属离子是______ 。
(3)若工艺流程改为先“调pH”后“转化”,即,“滤液③”中可能含有的杂质离子为______ 。
(4)如果“转化”后的溶液中Ni2+浓度为1.0mol·L-1,则“调pH”应控制的pH范围是______ 。
(5)硫酸镍在强碱溶液中用NaClO氧化,可沉淀出能用作镍镉电池正极材料的NiOOH。写出该反应的离子方程式______ 。
(6)将分离出硫酸镍晶体后的母液收集、循环使用,其意义是______ 。

| 金属离子 | Ni2+ | Al3+ | Fe3+ | Fe2+ |
| 开始沉淀时 (c=0.01mol·L-1)的pH | 7.2 | 3.7 | 2.2 | 7.5 |
| 沉淀完全时 (c=1.0×10-5mol·L-1)的pH | 8.7 | 4.7 | 3.2 | 9.0 |
(1)“碱浸”中NaOH的两个作用分别是
(2)“滤液②”中含有的金属离子是
(3)若工艺流程改为先“调pH”后“转化”,即,“滤液③”中可能含有的杂质离子为
(4)如果“转化”后的溶液中Ni2+浓度为1.0mol·L-1,则“调pH”应控制的pH范围是
(5)硫酸镍在强碱溶液中用NaClO氧化,可沉淀出能用作镍镉电池正极材料的NiOOH。写出该反应的离子方程式
(6)将分离出硫酸镍晶体后的母液收集、循环使用,其意义是
您最近一年使用:0次
名校
解题方法
2 . 氮、硫的氧化物都会引起环境问题,越来越引起人们的重视。如图是氮、硫元素的各种价态与物质类别的对应关系:
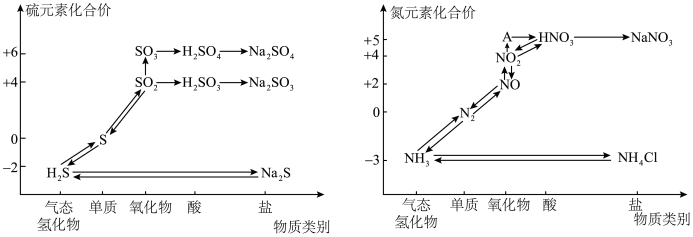
(1)根据 A 对应的化合价和物质类别,A 为___________ (写分子式),从氮元素的化合价能否发生变化的角度判断,图中既有氧化性又有还原性的含氮化合物有___________ 。
(2)氮气的结构决定了氮气能够在空气中稳定存在,实验室可用加热 NaNO2与NH4Cl 的混合溶液制备N2,请写出反应的化学方程式___________ 。
(3)浓、稀硝酸的性质既相似又有差别,若要除去铁制品表面的铜镀层应选择___________ ,反应的离子方程式为___________ 。
(4)工业生产中利用氨水吸收SO2 和NO2 ,原理如图所示:
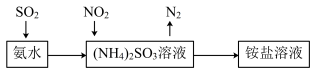
NO2 被吸收过程的离子方程式是___________ 。

(1)根据 A 对应的化合价和物质类别,A 为
(2)氮气的结构决定了氮气能够在空气中稳定存在,实验室可用加热 NaNO2与NH4Cl 的混合溶液制备N2,请写出反应的化学方程式
(3)浓、稀硝酸的性质既相似又有差别,若要除去铁制品表面的铜镀层应选择
(4)工业生产中利用氨水吸收SO2 和NO2 ,原理如图所示:

NO2 被吸收过程的离子方程式是
您最近一年使用:0次
解题方法
3 . 配平下列反应的化学方程式:
(1)_______ _______
_______ _______
_______ _______
_______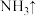 。
。_______ 。
(2)_______ _______
_______ _______
_______ _______
_______ _______
_______ 。
。_______ 。
(3)_______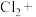 _______
_______ _______
_______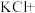 _______
_______ _______
_______ 。
。_______ 。
(4)_______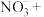 _______
_______ _______
_______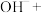 _______
_______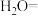 _______
_______ _______
_______ 。
。_______ 。
(1)_______
 _______
_______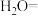 _______
_______ _______
_______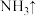 。
。(2)_______
 _______
_______ _______
_______ _______
_______ _______
_______ 。
。(3)_______
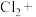 _______
_______ _______
_______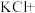 _______
_______ _______
_______ 。
。(4)_______
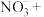 _______
_______ _______
_______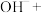 _______
_______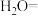 _______
_______ _______
_______ 。
。
您最近一年使用:0次
名校
解题方法
4 . 在强碱性条件下发生如下反应: (未配平),下列说法错误的是
(未配平),下列说法错误的是
 (未配平),下列说法错误的是
(未配平),下列说法错误的是A. 是氧化产物 是氧化产物 |
B. 的化学计量数之比是3∶2 的化学计量数之比是3∶2 |
C.配平后X是“ ” ” |
D.每生成1个 就会有3个电子发生转移 就会有3个电子发生转移 |
您最近一年使用:0次
2022-10-23更新
|
155次组卷
|
2卷引用:湖南省衡阳县四中2022-2023学年高二上学期开学摸底考试化学试题(B卷)
名校
5 . 硝酸铜是一种重要的化工原料,可由工业含铜废料制备,含铜废料的主要成分为Cu、CuS、CuSO4等,制备流程如图所示:
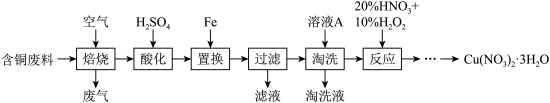
回答下列问题:
(1)“焙烧”时,CuS与空气中的O2反应生成CuO和SO2,该反应的化学方程式为____ 。
(2)①“淘洗”所用时溶液A可以是____ 。(填标号)。
a.稀硝酸 b.浓硝酸 c.稀硫酸 d.㳖硫酸
②如何证明“淘洗”已完全____ 。
(3)“反应”阶段所用的试剂是20%的HNO3溶液和10%的H2O2溶液,反应过程中无红棕色气体生成。
①理论上反应所消耗的H2O2和HNO3的物质的量之比为_____ 。
②若不加10%的H2O2溶液,只用20%的HNO3溶液,随着反应的进行,温度上升并出现大量红棕色气体,反应的离子方程式为____ 。
(4)某工厂用m1kg上述工业含铜废料(含铜元素80%)制备Cu(NO3)2•3H2O,最终得到产品m2kg,产率为____ 。

回答下列问题:
(1)“焙烧”时,CuS与空气中的O2反应生成CuO和SO2,该反应的化学方程式为
(2)①“淘洗”所用时溶液A可以是
a.稀硝酸 b.浓硝酸 c.稀硫酸 d.㳖硫酸
②如何证明“淘洗”已完全
(3)“反应”阶段所用的试剂是20%的HNO3溶液和10%的H2O2溶液,反应过程中无红棕色气体生成。
①理论上反应所消耗的H2O2和HNO3的物质的量之比为
②若不加10%的H2O2溶液,只用20%的HNO3溶液,随着反应的进行,温度上升并出现大量红棕色气体,反应的离子方程式为
(4)某工厂用m1kg上述工业含铜废料(含铜元素80%)制备Cu(NO3)2•3H2O,最终得到产品m2kg,产率为
您最近一年使用:0次
名校
6 . 回答下列问题:
(1)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色,溶液先变为浅绿色的离子方程式是____ ,又变为棕黄色的原因是____ (用离子方程式解释)。
(2)工业上把海水先进行氧化,再吸收溴,达到富集溴的目的。吸收工艺常用的方法是先用热空气吹出Br2,再用SO2吸收Br2。写出SO2吸收Br2反应的化学方程式为____ 。
(3)氮氧化物的治理是当前生态环境保护中的重要课题之一。从原理上看,NH3可用于治理NO2,该反应在催化剂条件下可实现,写出化学方程式____ 。
(4)一种新型催化剂能使NO和CO发生反应2NO+2CO 2CO2+N2。为验证温度和催化剂的比表面积对化学反应速率的影响规律,某同学设计了如表三组实验。回答下列问题:
2CO2+N2。为验证温度和催化剂的比表面积对化学反应速率的影响规律,某同学设计了如表三组实验。回答下列问题:
①上述实验中a=_____ ,b=_____ 。
②上述实验中,能验证温度对化学反应速率影响规律的一组实验是_____ (填实验编号)。
(1)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色,溶液先变为浅绿色的离子方程式是
(2)工业上把海水先进行氧化,再吸收溴,达到富集溴的目的。吸收工艺常用的方法是先用热空气吹出Br2,再用SO2吸收Br2。写出SO2吸收Br2反应的化学方程式为
(3)氮氧化物的治理是当前生态环境保护中的重要课题之一。从原理上看,NH3可用于治理NO2,该反应在催化剂条件下可实现,写出化学方程式
(4)一种新型催化剂能使NO和CO发生反应2NO+2CO
 2CO2+N2。为验证温度和催化剂的比表面积对化学反应速率的影响规律,某同学设计了如表三组实验。回答下列问题:
2CO2+N2。为验证温度和催化剂的比表面积对化学反应速率的影响规律,某同学设计了如表三组实验。回答下列问题:| 试验编号 | T(℃) | NO初始浓度(mol/L) | CO初始浓度(mol/L) | 催化剂的比表面积(m2/g) |
| I | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| II | 280 | 1.20×10-3 | b | 124 |
| III | 350 | a | 5.80×10-3 | 82 |
②上述实验中,能验证温度对化学反应速率影响规律的一组实验是
您最近一年使用:0次
解题方法
7 . 氮及其化合物在生产生活中有重要作用,请根据题意回答下列有关问题:
Ⅰ.工业上制取硝酸铵的流程图如下:

(1) 合金网上发生的化学反应方程式为
合金网上发生的化学反应方程式为_______ 。
(2)吸收塔中通入空气的目的是_______ 。
(3)生产硝酸的过程中常会产生尾气污染空气,可用NH3还原法去除尾气中的氮氧化物。请配平相关反应的方程式_____
_______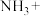 _______
_______ —_______
—_______ _______
_______ 。
。
Ⅱ.化肥工业产生的氨氮废水(主要含 ),可造成水体富营养化。某研究团队设计处理氨氮废水流程如下:
),可造成水体富营养化。某研究团队设计处理氨氮废水流程如下:

(4)过程①生成的氨可赶出并回收。请写出加入NaOH溶液时的离子方程式_______ 。
(5)过程②中控制溶液为酸性,在微生物作用下实现 ,请写出该过程的离子方程式
,请写出该过程的离子方程式_______ 。
(6)过程③:一定条件下向废水中加入 ,实现
,实现 ,称为反硝化过程。其中
,称为反硝化过程。其中 的作用为
的作用为_______ 。
Ⅰ.工业上制取硝酸铵的流程图如下:

(1)
 合金网上发生的化学反应方程式为
合金网上发生的化学反应方程式为(2)吸收塔中通入空气的目的是
(3)生产硝酸的过程中常会产生尾气污染空气,可用NH3还原法去除尾气中的氮氧化物。请配平相关反应的方程式
_______
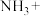 _______
_______ —_______
—_______ _______
_______ 。
。Ⅱ.化肥工业产生的氨氮废水(主要含
 ),可造成水体富营养化。某研究团队设计处理氨氮废水流程如下:
),可造成水体富营养化。某研究团队设计处理氨氮废水流程如下:
(4)过程①生成的氨可赶出并回收。请写出加入NaOH溶液时的离子方程式
(5)过程②中控制溶液为酸性,在微生物作用下实现
 ,请写出该过程的离子方程式
,请写出该过程的离子方程式(6)过程③:一定条件下向废水中加入
 ,实现
,实现 ,称为反硝化过程。其中
,称为反硝化过程。其中 的作用为
的作用为
您最近一年使用:0次
8 . 宏观辨识与微观探析是化学学科核心素养之一,下列离子方程式书写不正确的是
A.在 溶液中加入稀硫酸: 溶液中加入稀硫酸: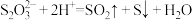 |
B.向 溶液中滴加 溶液中滴加 溶液: 溶液: |
C.工业上用绿矾处理废水中的 : :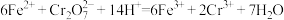 |
D.用酸性 溶液检测空气中 溶液检测空气中 的含量: 的含量: |
您最近一年使用:0次
名校
9 . 海洋中蕴含着丰富的化学元素,是人类资源的宝库。
Ⅰ.海带中含有碘元素。从海带中提取碘的实验过程如下图所示:

(1)实验步骤①会用到下列仪器中的_______ (填字母)。
a.酒精灯 b.漏斗 c.坩埚 d.泥三角
(2)步骤④中反应的离子方程式为_______ 。
(3)请设计一种检验水溶液中是否含有碘单质的方法:_______ 。
Ⅱ.镁及其合金是一种用途很广的金属材料,目前世界上60%的镁是从海水中提取的。主要步骤如下:
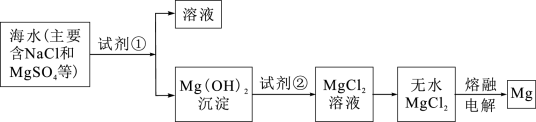
(4)为了使 转化为
转化为 ,试剂①可以选用
,试剂①可以选用_______ (填化学式)。
(5) 的电子式为
的电子式为_______ ,无水 在熔融状态下,通电后会产生Mg和
在熔融状态下,通电后会产生Mg和 ,该反应的化学方程式为
,该反应的化学方程式为_______ 。
Ⅲ.海水提溴:主要工业生产流程如下图所示。
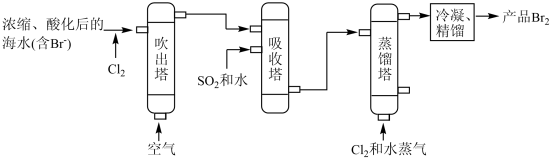
(6)海水中的 被
被 氧化的离子方程式是
氧化的离子方程式是_______ 。
(7)吸收塔中 将
将 转化为HBr的化学方程式是
转化为HBr的化学方程式是_______ 。
(8)工业上也可用 溶液吸收吹出的
溶液吸收吹出的 。补全以下化学方程式:
。补全以下化学方程式:_______ 。
_______ _______
_______ _______NaBr+_______
_______NaBr+_______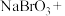 _______
_______
Ⅰ.海带中含有碘元素。从海带中提取碘的实验过程如下图所示:

(1)实验步骤①会用到下列仪器中的
a.酒精灯 b.漏斗 c.坩埚 d.泥三角
(2)步骤④中反应的离子方程式为
(3)请设计一种检验水溶液中是否含有碘单质的方法:
Ⅱ.镁及其合金是一种用途很广的金属材料,目前世界上60%的镁是从海水中提取的。主要步骤如下:

(4)为了使
 转化为
转化为 ,试剂①可以选用
,试剂①可以选用(5)
 的电子式为
的电子式为 在熔融状态下,通电后会产生Mg和
在熔融状态下,通电后会产生Mg和 ,该反应的化学方程式为
,该反应的化学方程式为Ⅲ.海水提溴:主要工业生产流程如下图所示。

(6)海水中的
 被
被 氧化的离子方程式是
氧化的离子方程式是(7)吸收塔中
 将
将 转化为HBr的化学方程式是
转化为HBr的化学方程式是(8)工业上也可用
 溶液吸收吹出的
溶液吸收吹出的 。补全以下化学方程式:
。补全以下化学方程式:_______
 _______
_______ _______NaBr+_______
_______NaBr+_______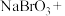 _______
_______
您最近一年使用:0次
名校
10 . 碳酸锶(SrCO3)是一种重要的工业原料,广泛用于生产锶铁氧体磁性材料。一种以菱锶矿(含80~90%SrCO3,少量MgCO3、CaCO3、BaCO3等)制备高纯碳酸锶的工艺流程如下:

(1)元素Sr在元素周期表的位置_______ 。
(2)菱锶矿、焦炭混合粉碎的目的是_______ 。
(3)“立窑煅烧”中SrCO3与焦炭反应的化学方程式为_______ 。
(4)“浸取”中用热水浸取而不用冷水的原因是_______ ;
(5)“沉锶”中反应的化学方程式为_______ 。

| 温度/℃ | 10 | 20 | 30 | 40 | 60 | 80 | 90 | 100 |
| 溶解度/(g/100g) | 1.25 | 1.77 | 2.64 | 3.95 | 8.42 | 20.2 | 44.5 | 91.2 |
(1)元素Sr在元素周期表的位置
(2)菱锶矿、焦炭混合粉碎的目的是
(3)“立窑煅烧”中SrCO3与焦炭反应的化学方程式为
(4)“浸取”中用热水浸取而不用冷水的原因是
(5)“沉锶”中反应的化学方程式为
您最近一年使用:0次



