名校
1 . I.神舟十七号载人航天飞船于2023年10月26日成功发射,飞船搭载的是中国研制的长征二号F遥十七运载火箭,采用四氧化二氮(N2O4)和偏二甲肼(C2H8N2)作为推进剂,二者反应生成二氧化碳、水蒸气和氮气。
(1)偏二甲肼的摩尔质量为___________ 。
(2)四氧化二氮能与水反应生成亚硝酸和___________ (写化学式)。
(3)四氧化二氮和偏二甲肼反应的化学方程式为:2N2O4+C2H8N2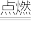 2CO2+3N2+4H2O,若反应生成3mol N2,则转移的电子的物质的量是
2CO2+3N2+4H2O,若反应生成3mol N2,则转移的电子的物质的量是___________ 。
(4)已知N2、CO2混合气体的质量共10.0g,在标准状况下的体积为6.72L,则混合气体中CO2的质量为___________ 。
II.二氧化氯(ClO2)是一种黄绿色到橙黄色的气体,是国际上公认的安全、无毒的绿色消毒剂。已知:工业上制备二氧化氯的方法之一是用甲醇在酸性介质中与氯酸钠反应。二氧化氯能与许多化学物质发生爆炸性反应,遇水则生成次氯酸、氯气和氧气。
(5)将二氧化氯通入紫色石蕊试液中,溶液褪色的理由是___________ 。
(6)设NA为阿伏加德罗常数的值,现有10g质量分数为64%的甲醇(CH3OH)水溶液,则该溶液所含氢原子数目为___________ 。
(7)假设CO2和ClO2在标准状况下均为气体,则反应CH3OH+NaClO3+H2SO4 → CO2↑+ClO2↑+Na2SO4 +H2O(未配平)中转移的电子数目为0.6NA时,该反应产生标准状况下气体的体积为___________ 。
(1)偏二甲肼的摩尔质量为
(2)四氧化二氮能与水反应生成亚硝酸和
(3)四氧化二氮和偏二甲肼反应的化学方程式为:2N2O4+C2H8N2
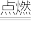 2CO2+3N2+4H2O,若反应生成3mol N2,则转移的电子的物质的量是
2CO2+3N2+4H2O,若反应生成3mol N2,则转移的电子的物质的量是(4)已知N2、CO2混合气体的质量共10.0g,在标准状况下的体积为6.72L,则混合气体中CO2的质量为
II.二氧化氯(ClO2)是一种黄绿色到橙黄色的气体,是国际上公认的安全、无毒的绿色消毒剂。已知:工业上制备二氧化氯的方法之一是用甲醇在酸性介质中与氯酸钠反应。二氧化氯能与许多化学物质发生爆炸性反应,遇水则生成次氯酸、氯气和氧气。
(5)将二氧化氯通入紫色石蕊试液中,溶液褪色的理由是
(6)设NA为阿伏加德罗常数的值,现有10g质量分数为64%的甲醇(CH3OH)水溶液,则该溶液所含氢原子数目为
(7)假设CO2和ClO2在标准状况下均为气体,则反应CH3OH+NaClO3+H2SO4 → CO2↑+ClO2↑+Na2SO4 +H2O(未配平)中转移的电子数目为0.6NA时,该反应产生标准状况下气体的体积为
您最近一年使用:0次
解题方法
2 . Ⅰ.铁及其化合物在生产生活中有极其重要的用途。 可用作补铁剂,使用时建议与维生素C同服,同学甲猜测维生素C可将
可用作补铁剂,使用时建议与维生素C同服,同学甲猜测维生素C可将 转化为
转化为 ,以利于人体吸收。为了验证这一猜想,设计了如下实验:
,以利于人体吸收。为了验证这一猜想,设计了如下实验:
(1)由上述实验能否得出“维生素C可将 转化为
转化为 ”的结论?请说明理由:
”的结论?请说明理由:______ 。
Ⅱ.高铁酸钾( )是一种高效多功能的新型非氯绿色消毒剂,为暗紫色有光泽粉末,极易溶于水而形成暗紫色溶液,静置后会分解并释放出大量氧气,同时生成KOH和
)是一种高效多功能的新型非氯绿色消毒剂,为暗紫色有光泽粉末,极易溶于水而形成暗紫色溶液,静置后会分解并释放出大量氧气,同时生成KOH和 胶体。工业上常用于制备高铁酸钾的方法有电解法、次氯酸盐氧化法和熔融法等。
胶体。工业上常用于制备高铁酸钾的方法有电解法、次氯酸盐氧化法和熔融法等。
(2)熔融法:在苛性碱存在的环境中,铁盐被过氧化钠高温氧化成高铁酸钠: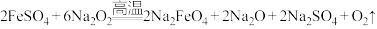 ,再加入适量饱和KOH溶液反应得到
,再加入适量饱和KOH溶液反应得到 。上述反应在熔融状态下进行,而不在水溶液中进行的原因是
。上述反应在熔融状态下进行,而不在水溶液中进行的原因是______ 。
(3)高铁酸钾可通过次氯酸钾氧化 溶液来制备。次氯酸钾的制备装置如图所示。
溶液来制备。次氯酸钾的制备装置如图所示。
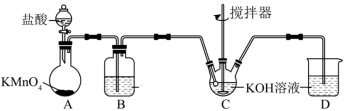
回答下列问题:
①装置A中 与盐酸反应生成
与盐酸反应生成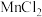 和
和 ,其化学方程式为
,其化学方程式为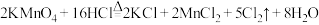 。
。
a.请用双线桥法标出电子转移方向与数目_______ 。
b.上述反应中的HCl体现了什么性质?_______ 。
②将制备的 通过装置B可除去杂质HCl,B中的溶液为
通过装置B可除去杂质HCl,B中的溶液为_____ 。
③ 和KOH溶液在较高温度下反应生成
和KOH溶液在较高温度下反应生成 。在不改变KOH溶液的浓度和体积的条件下,控制反应在0℃~5℃进行,实验中可采取的措施是
。在不改变KOH溶液的浓度和体积的条件下,控制反应在0℃~5℃进行,实验中可采取的措施是______ 。
④若实验制得的次氯酸钾溶液中 (N代表微粒个数),则
(N代表微粒个数),则
_______ 。
⑤装置D的作用是_______ 。
⑥次氯酸盐氧化法是在碱性条件下,KClO饱和溶液可将 转化为
转化为 ,写出反应的离子方程式:
,写出反应的离子方程式:________ 。
 可用作补铁剂,使用时建议与维生素C同服,同学甲猜测维生素C可将
可用作补铁剂,使用时建议与维生素C同服,同学甲猜测维生素C可将 转化为
转化为 ,以利于人体吸收。为了验证这一猜想,设计了如下实验:
,以利于人体吸收。为了验证这一猜想,设计了如下实验:| 实验方案 | 实验现象 |
取适量 溶液于试管中,加入维生素C片,振荡溶解后,滴加酸性高锰酸钾溶液 溶液于试管中,加入维生素C片,振荡溶解后,滴加酸性高锰酸钾溶液 | 紫色褪去 |
(1)由上述实验能否得出“维生素C可将
 转化为
转化为 ”的结论?请说明理由:
”的结论?请说明理由:Ⅱ.高铁酸钾(
 )是一种高效多功能的新型非氯绿色消毒剂,为暗紫色有光泽粉末,极易溶于水而形成暗紫色溶液,静置后会分解并释放出大量氧气,同时生成KOH和
)是一种高效多功能的新型非氯绿色消毒剂,为暗紫色有光泽粉末,极易溶于水而形成暗紫色溶液,静置后会分解并释放出大量氧气,同时生成KOH和 胶体。工业上常用于制备高铁酸钾的方法有电解法、次氯酸盐氧化法和熔融法等。
胶体。工业上常用于制备高铁酸钾的方法有电解法、次氯酸盐氧化法和熔融法等。(2)熔融法:在苛性碱存在的环境中,铁盐被过氧化钠高温氧化成高铁酸钠:
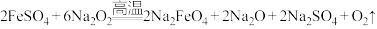 ,再加入适量饱和KOH溶液反应得到
,再加入适量饱和KOH溶液反应得到 。上述反应在熔融状态下进行,而不在水溶液中进行的原因是
。上述反应在熔融状态下进行,而不在水溶液中进行的原因是(3)高铁酸钾可通过次氯酸钾氧化
 溶液来制备。次氯酸钾的制备装置如图所示。
溶液来制备。次氯酸钾的制备装置如图所示。
回答下列问题:
①装置A中
 与盐酸反应生成
与盐酸反应生成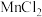 和
和 ,其化学方程式为
,其化学方程式为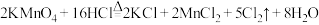 。
。a.请用双线桥法标出电子转移方向与数目
b.上述反应中的HCl体现了什么性质?
②将制备的
 通过装置B可除去杂质HCl,B中的溶液为
通过装置B可除去杂质HCl,B中的溶液为③
 和KOH溶液在较高温度下反应生成
和KOH溶液在较高温度下反应生成 。在不改变KOH溶液的浓度和体积的条件下,控制反应在0℃~5℃进行,实验中可采取的措施是
。在不改变KOH溶液的浓度和体积的条件下,控制反应在0℃~5℃进行,实验中可采取的措施是④若实验制得的次氯酸钾溶液中
 (N代表微粒个数),则
(N代表微粒个数),则
⑤装置D的作用是
⑥次氯酸盐氧化法是在碱性条件下,KClO饱和溶液可将
 转化为
转化为 ,写出反应的离子方程式:
,写出反应的离子方程式:
您最近一年使用:0次
解题方法
3 . 某同学利用钠与硫酸铜溶液进行实验,并对其现象进行分析,研究其产物组成。
(1)硫酸铜溶液的配制:准确称取五水硫酸铜(CuSO4·5H2O)晶体2.5000g,溶解后转移至100mL容量瓶中。
①上述实验过程中,用不到的实验仪器有____ (填标号)。

②该CuSO4溶液的浓度为__________ mo/L。
③通过理论计算,当上述硫酸铜与钠完全反应,溶液质量变化为___ g。
(2)将配好的CuSO4溶液,分3组进行实验,实验结果如下图所示:
查阅资料得知:极细的铜粉,外观呈现黑色
①a组中的蓝色沉淀成分主要是_________ 。
②将c组中黑色沉淀进行抽滤,干燥,对其成分进行初步的猜想
猜想ⅰ:金属钠将铜置换出来,以极细的铜粉存在;
猜想ⅱ:金属钠与水反应剧烈放热,______________ 。
设计一个简单的实验,证明猜想ⅰ是错误的______________ 。
(3)为进一步验证黑色固体的成分,该同学求助实验室检测,得到黑色固体中含铜化合物主要有硫酸氧化铜[Cu2O(SO4)]、碱式硫酸铜[Cu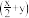 (OH)x(SO4)y]、氧化铜[CuO]三种。写出钠与硫酸铜反应生成碱式硫酸铜的化学方程式
(OH)x(SO4)y]、氧化铜[CuO]三种。写出钠与硫酸铜反应生成碱式硫酸铜的化学方程式____________ 。
(4)根据实验结果,可以得到的结论为____________ (写一条)。
(1)硫酸铜溶液的配制:准确称取五水硫酸铜(CuSO4·5H2O)晶体2.5000g,溶解后转移至100mL容量瓶中。
①上述实验过程中,用不到的实验仪器有

②该CuSO4溶液的浓度为
③通过理论计算,当上述硫酸铜与钠完全反应,溶液质量变化为
(2)将配好的CuSO4溶液,分3组进行实验,实验结果如下图所示:
| 序号 | CuSO4溶液体积/mL | 金属钠质量/g | 实验现象 |
| a | 15 | 0.01g | 迅速产生大量蓝色沉淀 |
| b | 15 | 0.1g | 蓝色沉淀和黑色沉淀共存 |
| c | 15 | 1.0g | 出现大量黑色沉淀 |
①a组中的蓝色沉淀成分主要是
②将c组中黑色沉淀进行抽滤,干燥,对其成分进行初步的猜想
猜想ⅰ:金属钠将铜置换出来,以极细的铜粉存在;
猜想ⅱ:金属钠与水反应剧烈放热,
设计一个简单的实验,证明猜想ⅰ是错误的
(3)为进一步验证黑色固体的成分,该同学求助实验室检测,得到黑色固体中含铜化合物主要有硫酸氧化铜[Cu2O(SO4)]、碱式硫酸铜[Cu
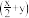 (OH)x(SO4)y]、氧化铜[CuO]三种。写出钠与硫酸铜反应生成碱式硫酸铜的化学方程式
(OH)x(SO4)y]、氧化铜[CuO]三种。写出钠与硫酸铜反应生成碱式硫酸铜的化学方程式(4)根据实验结果,可以得到的结论为
您最近一年使用:0次
解题方法
4 . “五步产盐法”起源于山西运城,其生产工艺主要以集卤蒸发为主,盐池的浓卤水经过箩、调配、储卤、结晶、铲出五个步骤即可得到纯度高且颗粒大的食盐.《天工开物》中也有类似描述,“凡引水种盐,春间即为之,久则水成赤色.待夏秋之交,南风大起,则一宵结成.……但成盐时日,与不借南风则大异也”.已知:
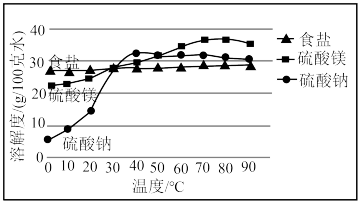
运城盐池卤水中三种主要成分溶解度随温度变化示意图
回答下列问题:
(1)为除去食盐中可能含有的少量 和
和 ,将其溶解后依次加入
,将其溶解后依次加入_________ 、 溶液后过滤,再加入适量的盐酸,蒸发结晶.
溶液后过滤,再加入适量的盐酸,蒸发结晶.
(2)运城盐池素有“夏产盐冬产硝”的说法,“夏产盐”的原理是___________________ (填操作名称,下同),“冬产硝”(主要成分为 )的原理是
)的原理是_______________ .“五步产盐法”最独特的妙处之一是在出盐前于卤水中浇洒适量淡水,由此得到的食盐晶体“质坚、粒大”且纯度较高,此法得到的食盐晶体粒大、质坚的原因是__________________________________________________ .
(3)经提纯得到的 与煤粉(主要成分为C)高温还原可制取一种重要的化工原料
与煤粉(主要成分为C)高温还原可制取一种重要的化工原料 ,同时生成无污染气体,该反应的化学方程式为
,同时生成无污染气体,该反应的化学方程式为________________________________ .
(4) 与
与 混合溶液中通入
混合溶液中通入 即可制得
即可制得 ,装置如图所示:
,装置如图所示:
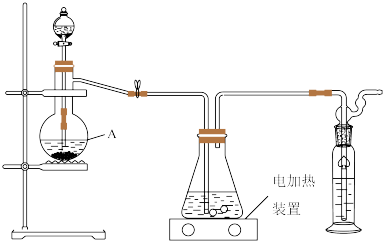
实验过程如下:打开分液漏斗活塞慢慢滴入70%的硫酸溶液,使产生的气体均匀通入 与
与 混合溶液,随着气体的通入逐渐有大量硫单质析出.继续通入气体,反应约一小时,溶液pH约等于7时(注意不要小于7),停止通气.
混合溶液,随着气体的通入逐渐有大量硫单质析出.继续通入气体,反应约一小时,溶液pH约等于7时(注意不要小于7),停止通气.
①仪器A的名称是____________ .
②锥形瓶内的反应大致可分为三步进行:
第一步:
第二步:
第三步:生成 反应的化学方程式为
反应的化学方程式为_________________ ,该实验过程中 的比例太低会导致产率过低的原因是
的比例太低会导致产率过低的原因是_________________________ .

运城盐池卤水中三种主要成分溶解度随温度变化示意图
回答下列问题:
(1)为除去食盐中可能含有的少量
 和
和 ,将其溶解后依次加入
,将其溶解后依次加入 溶液后过滤,再加入适量的盐酸,蒸发结晶.
溶液后过滤,再加入适量的盐酸,蒸发结晶.(2)运城盐池素有“夏产盐冬产硝”的说法,“夏产盐”的原理是
 )的原理是
)的原理是(3)经提纯得到的
 与煤粉(主要成分为C)高温还原可制取一种重要的化工原料
与煤粉(主要成分为C)高温还原可制取一种重要的化工原料 ,同时生成无污染气体,该反应的化学方程式为
,同时生成无污染气体,该反应的化学方程式为(4)
 与
与 混合溶液中通入
混合溶液中通入 即可制得
即可制得 ,装置如图所示:
,装置如图所示:
实验过程如下:打开分液漏斗活塞慢慢滴入70%的硫酸溶液,使产生的气体均匀通入
 与
与 混合溶液,随着气体的通入逐渐有大量硫单质析出.继续通入气体,反应约一小时,溶液pH约等于7时(注意不要小于7),停止通气.
混合溶液,随着气体的通入逐渐有大量硫单质析出.继续通入气体,反应约一小时,溶液pH约等于7时(注意不要小于7),停止通气.①仪器A的名称是
②锥形瓶内的反应大致可分为三步进行:
第一步:

第二步:

第三步:生成
 反应的化学方程式为
反应的化学方程式为 的比例太低会导致产率过低的原因是
的比例太低会导致产率过低的原因是
您最近一年使用:0次
5 . 金属镓有“电子工业脊梁”的美誉,镓与铝的化学性质类似.从刚玉渣(含钛、镓的低硅铁合金,还含有少量氧化铝)回收镓的一种流程如图所示:
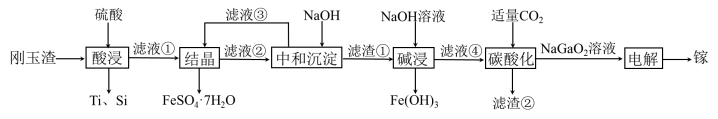
回答下列问题:
(1)镓原子结构示意图为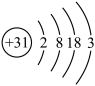 ,则其在元素周期表第
,则其在元素周期表第_________ 周期__________ 族。
(2)“酸浸”过程中禁止明火加热,原因是___________________________ ;为提高镓的浸出率,可采用的措施是__________________ (填一种即可)。
(3)“结晶”过程中得到 的操作主要为
的操作主要为__________________________ 。
(4)滤渣②的主要成分为_________________ 。
(5)“碳酸化”过程中不能通入过量 的原因为
的原因为______________________ (用离子方程式表示)。
(6)氮化镓具有优异的光电性能.工业上常采用在1100℃条件下,利用Ga与 反应可制备
反应可制备 ,该反应的化学方程式为
,该反应的化学方程式为_____________________________ 。
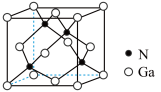
(7) 晶体的一种立方晶胞如图所示,已知晶胞参数为
晶体的一种立方晶胞如图所示,已知晶胞参数为 ,
, 的摩尔质量为
的摩尔质量为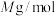 ,则该晶体的密度为
,则该晶体的密度为___________  (列出计算式,设
(列出计算式,设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。

回答下列问题:
(1)镓原子结构示意图为
 ,则其在元素周期表第
,则其在元素周期表第(2)“酸浸”过程中禁止明火加热,原因是
(3)“结晶”过程中得到
 的操作主要为
的操作主要为(4)滤渣②的主要成分为
(5)“碳酸化”过程中不能通入过量
 的原因为
的原因为(6)氮化镓具有优异的光电性能.工业上常采用在1100℃条件下,利用Ga与
 反应可制备
反应可制备 ,该反应的化学方程式为
,该反应的化学方程式为(7)
 晶体的一种立方晶胞如图所示,已知晶胞参数为
晶体的一种立方晶胞如图所示,已知晶胞参数为 ,
, 的摩尔质量为
的摩尔质量为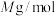 ,则该晶体的密度为
,则该晶体的密度为 (列出计算式,设
(列出计算式,设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
您最近一年使用:0次
名校
解题方法
6 . (一)工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下:
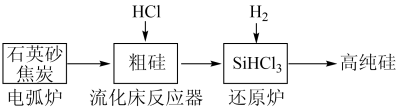
(1)工业上用石英砂和焦炭在电弧炉中高温加热到1600℃-1800℃生成粗硅的化学方程式为:___________ 。
(2)在流化床反应的产物中,SiHCl3大约占85%,还有SiCl4、SiH2Cl2、SiH3Cl等,粗硅生成SiHCl3的化学反应为:Si+3HCl SiHCl3+H2,生成物SiHCl3的结构式为:
SiHCl3+H2,生成物SiHCl3的结构式为:___________ 。
(二)某化学兴趣小组利用下列图示装置探究氨气的性质。
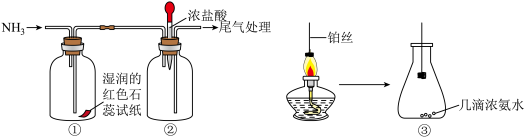
(3)①中湿润的红色石蕊试纸变蓝的原因:___________ (用化学方程式表示)。
(4)向②中滴入浓盐酸,现象为:___________ 。
(5)将灼热的铂丝伸入③中锥形瓶,可观察到铂丝保持红热,有红棕色气体及少量白烟生成。该过程会同时发生多个反应,写出NH3和O2催化氧化的化学方程式:___________ ,瓶中红棕色气体为___________ (填化学式)。
(三)某氨氮废水( 、
、 )的生物法处理流程如图所示:
)的生物法处理流程如图所示:

(6)检验氨氮废水中含有 的方法是:
的方法是:___________ 。
(7)过程Ⅱ在硝化细菌作用下实现 的转化,称为硝化过程。在碱性条件下实现上述硝化过程的总反应的离子方程式为:
的转化,称为硝化过程。在碱性条件下实现上述硝化过程的总反应的离子方程式为:___________ 。

(1)工业上用石英砂和焦炭在电弧炉中高温加热到1600℃-1800℃生成粗硅的化学方程式为:
(2)在流化床反应的产物中,SiHCl3大约占85%,还有SiCl4、SiH2Cl2、SiH3Cl等,粗硅生成SiHCl3的化学反应为:Si+3HCl
 SiHCl3+H2,生成物SiHCl3的结构式为:
SiHCl3+H2,生成物SiHCl3的结构式为:(二)某化学兴趣小组利用下列图示装置探究氨气的性质。

(3)①中湿润的红色石蕊试纸变蓝的原因:
(4)向②中滴入浓盐酸,现象为:
(5)将灼热的铂丝伸入③中锥形瓶,可观察到铂丝保持红热,有红棕色气体及少量白烟生成。该过程会同时发生多个反应,写出NH3和O2催化氧化的化学方程式:
(三)某氨氮废水(
 、
、 )的生物法处理流程如图所示:
)的生物法处理流程如图所示:
(6)检验氨氮废水中含有
 的方法是:
的方法是:(7)过程Ⅱ在硝化细菌作用下实现
 的转化,称为硝化过程。在碱性条件下实现上述硝化过程的总反应的离子方程式为:
的转化,称为硝化过程。在碱性条件下实现上述硝化过程的总反应的离子方程式为:
您最近一年使用:0次
名校
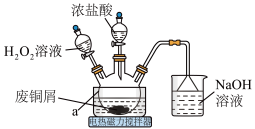
7 . CuCl2是常见的化学试剂,某小组利用废铜屑“湿法”制备CuCl2·2H2O并开展相关探究。
回答下列问题:
(1)仪器a的名称为___________ 。
(2)上述方法制备CuCl2的离子方程式为___________ 。
(3)为得到纯净的CuCl2·2H2O晶体,反应完全后要进行的操作是:除去其他可能的金属离子后,过滤,向滤液中持续通入 气体,加热蒸发浓缩,
气体,加热蒸发浓缩,___________ ,过滤,洗涤,低温干燥。持续通入 气体的目的是
气体的目的是___________ 。
(4)实验中,H2O2的实际用量要大于理论用量,可能因素为:原因1:___________ ;原因2:生成的CuCl2催化了H2O2的分解。
(5)该小组对“原因2”进行拓展探究。为验证CuCl2对H2O2分解的催化作用,该小组向5支盛有10mL5%H2O2的试管中滴加不同溶液,实验记录如下表(忽略溶液体积的微小变化;已知一定条件下,还原产物的浓度越小,氧化剂的氧化性越强):
①实验Ⅳ过程中观察到有白色沉淀(经检验为CuCl)生成,反应的机理表示为
第一步:H2O2+2Cu2++2Cl-=O2↑+2CuCl+2H+;
第二步:___________ (写离子方程式)。
②已知化学反应速率第一步<第二步,则气泡产生速率实验Ⅳ比实验Ⅲ加快的原因:___________ 。
③分析上述实验,下列说法正确的是___________ (填字母)。
A.实验Ⅰ的目的是证明仅有NaCl对H2O2分解没有催化作用
B. 对H2O2分解有显著催化作用
对H2O2分解有显著催化作用
C.Cl-增强了Cu2+对H2O2分解的催化效果,且Cl-浓度越大催化效果越强
④写出一种H2O2的用途___________ 。
| 温度 | 15℃以下 | 15~25.7℃ | 26~42℃ | 42℃以上 |
| 结晶水合物 | CuCl2·4H2O | CuCl2·3H2O | CuCl2·2H2O | CuCl2·H2O |
(1)仪器a的名称为
(2)上述方法制备CuCl2的离子方程式为
(3)为得到纯净的CuCl2·2H2O晶体,反应完全后要进行的操作是:除去其他可能的金属离子后,过滤,向滤液中持续通入
 气体,加热蒸发浓缩,
气体,加热蒸发浓缩, 气体的目的是
气体的目的是(4)实验中,H2O2的实际用量要大于理论用量,可能因素为:原因1:
(5)该小组对“原因2”进行拓展探究。为验证CuCl2对H2O2分解的催化作用,该小组向5支盛有10mL5%H2O2的试管中滴加不同溶液,实验记录如下表(忽略溶液体积的微小变化;已知一定条件下,还原产物的浓度越小,氧化剂的氧化性越强):
| 实验 | Ⅰ | Ⅱ | Ⅲ | Ⅳ | Ⅴ |
| 滴加试剂 | 2滴1mol/LNaCl | 2滴1mol/LNa2SO4 | 2滴1mol/LCuSO4 | 2滴1mol/LCuSO4和2滴1mol/LNaCl | 2滴1mol/LCuSO4和4滴1mol/LNaCl |
| 现象 | 无气泡产生 | 无气泡产生 | 均产生气泡,且气泡速率从Ⅲ到Ⅴ依次加快 | ||
第一步:H2O2+2Cu2++2Cl-=O2↑+2CuCl+2H+;
第二步:
②已知化学反应速率第一步<第二步,则气泡产生速率实验Ⅳ比实验Ⅲ加快的原因:
③分析上述实验,下列说法正确的是
A.实验Ⅰ的目的是证明仅有NaCl对H2O2分解没有催化作用
B.
 对H2O2分解有显著催化作用
对H2O2分解有显著催化作用C.Cl-增强了Cu2+对H2O2分解的催化效果,且Cl-浓度越大催化效果越强
④写出一种H2O2的用途
您最近一年使用:0次
名校
8 . 锂电池是目前应用广泛的新型电池,一种回收钴酸锂废旧电池(主要成分为LiCoO2,同时含有少量Fe、Al、C单质)的流程如下图所示。
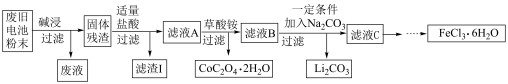
已知:Fe3+能与C2O 结合成[Fe(C2O4)3]3-,[Fe(C2O4)3]3-在强酸性环境下重新转化为Fe3+
结合成[Fe(C2O4)3]3-,[Fe(C2O4)3]3-在强酸性环境下重新转化为Fe3+
请回答下列问题:
(1)由滤液A制取CoC2O4·2H2O的过程发生的___________ (填“是”或“不是”)氧化还原反应,CoC2O4·2H2O中C的化合价为___________ ,滤渣I的主要成份为___________ 。
(2)用过量的NaOH溶液进行“碱浸”,“碱浸”的目的是___________ 。
写出该过程发生的化学反应方程式___________ 。
(3)加入适量盐酸,LiCoO2溶解后生成的Co3+能将Fe2+氧化为Fe3+,请写出该反应的离子方程式___________ 。
(4)请设计实验方案检验滤液C中的Cl-。___________
(5)高铁酸钠(Na2FeO4 ,其中铁为+6价)是一种高效多功能水处理剂。工业上用次氯酸钠和氯化铁为原料来制取高铁酸钠,该反应的离子方程式为:_________
___________ClO- +___________Fe3++___________=___________FeO +___________Cl- +___________H2O,请配平该方程式。
+___________Cl- +___________H2O,请配平该方程式。

已知:Fe3+能与C2O
 结合成[Fe(C2O4)3]3-,[Fe(C2O4)3]3-在强酸性环境下重新转化为Fe3+
结合成[Fe(C2O4)3]3-,[Fe(C2O4)3]3-在强酸性环境下重新转化为Fe3+请回答下列问题:
(1)由滤液A制取CoC2O4·2H2O的过程发生的
(2)用过量的NaOH溶液进行“碱浸”,“碱浸”的目的是
写出该过程发生的化学反应方程式
(3)加入适量盐酸,LiCoO2溶解后生成的Co3+能将Fe2+氧化为Fe3+,请写出该反应的离子方程式
(4)请设计实验方案检验滤液C中的Cl-。
(5)高铁酸钠(Na2FeO4 ,其中铁为+6价)是一种高效多功能水处理剂。工业上用次氯酸钠和氯化铁为原料来制取高铁酸钠,该反应的离子方程式为:
___________ClO- +___________Fe3++___________=___________FeO
 +___________Cl- +___________H2O,请配平该方程式。
+___________Cl- +___________H2O,请配平该方程式。
您最近一年使用:0次
2024-01-16更新
|
236次组卷
|
3卷引用:广东省茂名市七校2023-2024学年高一上学期12月联考化学试题
名校
解题方法
9 . 过氧化氢是重要的化工产品,广泛应用于绿色化学合成,医疗消毒等领域。
(1) 的
的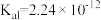 ,
, 的酸性
的酸性___________  (填“>”、“<”或“=”;研究表明,过氧化氢溶液中
(填“>”、“<”或“=”;研究表明,过氧化氢溶液中 的浓度越大,
的浓度越大, 的分解速率越快。常温下,一定浓度的
的分解速率越快。常温下,一定浓度的 ,若
,若 增大,则
增大,则 分解速率增大,原因是
分解速率增大,原因是___________ 。
(2)早期制备方法:
①II为可逆反应,促进该反应正向进行的措施是___________ 。(写一条)
②Ⅲ中生成 ,反应的化学方程式是
,反应的化学方程式是___________ 。
(3) 可对烟气中
可对烟气中 、
、 进行协同脱除。
进行协同脱除。
①电解 溶液制备
溶液制备 气体的装置如图所示。
气体的装置如图所示。 通过阳离子交换膜向阴极室迁移,电解时阴极的电极反应为
通过阳离子交换膜向阴极室迁移,电解时阴极的电极反应为___________ 。
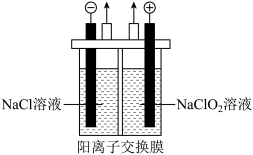
②保持其他条件不变,调节烟气中 初始浓度,将烟气按一定流速通入反应器与
初始浓度,将烟气按一定流速通入反应器与 反应,测得
反应,测得 、
、 氧化率随
氧化率随 初始浓度的变化如图所示。
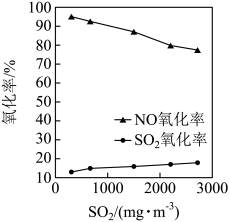
初始浓度的变化如图所示。 氧化率始终低于NO氧化率的原因可能是
氧化率始终低于NO氧化率的原因可能是________ 。
(4)甲醇( )是重要的化工原料及能源物质,如图是甲醇燃料电池工作原理示意图。
)是重要的化工原料及能源物质,如图是甲醇燃料电池工作原理示意图。
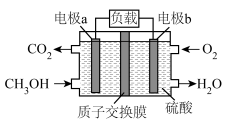
①a电极是电池的___________ (填“正”或“负”)极。
②b电极的电极反应式为___________ 。
(5)现有25℃时等浓度的5种溶液:A. ;B.
;B.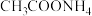 ;C.
;C.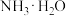 ;D.
;D.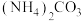 ;E.
;E.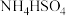 ,这5种溶液中
,这5种溶液中 浓度由大到小的顺序排列是:
浓度由大到小的顺序排列是:___________ (填字母)。
(1)
 的
的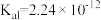 ,
, 的酸性
的酸性 (填“>”、“<”或“=”;研究表明,过氧化氢溶液中
(填“>”、“<”或“=”;研究表明,过氧化氢溶液中 的浓度越大,
的浓度越大, 的分解速率越快。常温下,一定浓度的
的分解速率越快。常温下,一定浓度的 ,若
,若 增大,则
增大,则 分解速率增大,原因是
分解速率增大,原因是(2)早期制备方法:

①II为可逆反应,促进该反应正向进行的措施是
②Ⅲ中生成
 ,反应的化学方程式是
,反应的化学方程式是(3)
 可对烟气中
可对烟气中 、
、 进行协同脱除。
进行协同脱除。①电解
 溶液制备
溶液制备 气体的装置如图所示。
气体的装置如图所示。 通过阳离子交换膜向阴极室迁移,电解时阴极的电极反应为
通过阳离子交换膜向阴极室迁移,电解时阴极的电极反应为
②保持其他条件不变,调节烟气中
 初始浓度,将烟气按一定流速通入反应器与
初始浓度,将烟气按一定流速通入反应器与 反应,测得
反应,测得 、
、 氧化率随
氧化率随 初始浓度的变化如图所示。
初始浓度的变化如图所示。 氧化率始终低于NO氧化率的原因可能是
氧化率始终低于NO氧化率的原因可能是
(4)甲醇(
 )是重要的化工原料及能源物质,如图是甲醇燃料电池工作原理示意图。
)是重要的化工原料及能源物质,如图是甲醇燃料电池工作原理示意图。
①a电极是电池的
②b电极的电极反应式为
(5)现有25℃时等浓度的5种溶液:A.
 ;B.
;B.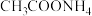 ;C.
;C.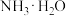 ;D.
;D.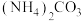 ;E.
;E.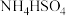 ,这5种溶液中
,这5种溶液中 浓度由大到小的顺序排列是:
浓度由大到小的顺序排列是:
您最近一年使用:0次
名校
10 . 钠和铁都是重要的金属元素,被广泛应用于冶金、建筑等领域,有着重要的工业利用价值。
I.物质类别和核心元素的价态是学习元素及其化合物性质的两个重要视角。下图是钠及其化合物 的“价−类”二维图。
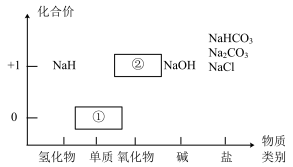
请回答下列问题:
(1)写出NaHCO3在水中电离的离子方程式________ 。
(2)银白色固体①应保存在______ 中;①可直接转化为淡黄色固体②,写出该反应的化学方程式_______ 。
(3)氢化钠(NaH)是一种储氢材料,室温下能结合CO2制氢:4NaH+3CO2=2Na2CO3+C+2H2。
①该反应中氧化产物和还原产物的物质的量之比为__________ 。
②由氢元素价态可知,NaH常用作_______ (填“氧化剂”或“还原剂”)。
II.绿矾(七水合硫酸亚铁,FeSO4·7H2O)能够用于处理工业废水中具有强氧化性的离子重铬酸根(Cr2O72−),反应原理为: Fe2++ Cr2O72−+ H+ = Fe3++ Cr3++ H2O
(4)填写空格,完成该反应方程式的配平________ 。
(5)该反应中______ 元素被氧化,还原产物是________ 。
I.物质类别和核心元素的价态是学习元素及其化合物性质的两个重要视角。下图是

请回答下列问题:
(1)写出NaHCO3在水中电离的离子方程式
(2)银白色固体①应保存在
(3)氢化钠(NaH)是一种储氢材料,室温下能结合CO2制氢:4NaH+3CO2=2Na2CO3+C+2H2。
①该反应中氧化产物和还原产物的物质的量之比为
②由氢元素价态可知,NaH常用作
II.绿矾(七水合硫酸亚铁,FeSO4·7H2O)能够用于处理工业废水中具有强氧化性的离子重铬酸根(Cr2O72−),反应原理为: Fe2++ Cr2O72−+ H+ = Fe3++ Cr3++ H2O
(4)填写空格,完成该反应方程式的配平
(5)该反应中
您最近一年使用:0次



