名校
解题方法
1 . 溴及其化合物在生产中有广泛应用。工业上常用“吹出法”从海水中提溴,工艺流程示意图如下。
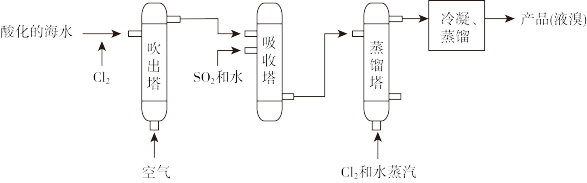
下列说法不正确 的是

下列说法
| A.“吹出法”主要包括氧化、吹出、吸收、蒸馏和冷凝等环节 |
| B.海水中Br- 经氧化、吹出、吸收后,可实现溴的富集 |
| C.该工艺流程可证明还原性:Br- >SO2>Cl- |
| D.“吸收塔”内也可用Na2CO3溶液吸收吹出的Br2 |
您最近一年使用:0次
2022-04-04更新
|
630次组卷
|
2卷引用:福建省仙游第一中学2021-2022学年高一上学期期末考试化学试题
名校
2 . 某班同学用如下实验探究 、
、 的性质。(已知
的性质。(已知 遇
遇 溶液生成蓝色沉淀)回答下列问题:
溶液生成蓝色沉淀)回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1 的溶液。在
的溶液。在 溶液中需加入少量铁屑,其目的是
溶液中需加入少量铁屑,其目的是___________ 。
(2)甲组同学取2mL 溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明
溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明 可将
可将 氧化。
氧化。 溶液与氯水反应的离子方程式为
溶液与氯水反应的离子方程式为___________ 。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2mL 溶液中先加入0.5mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是
溶液中先加入0.5mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是___________ 。
(4)丙组同学取10mL 0.1 KI溶液,加入6mL 0.1
KI溶液,加入6mL 0.1
 溶液混合。分别取2mL此溶液于3支试管中进行如下实验:
溶液混合。分别取2mL此溶液于3支试管中进行如下实验:
①第一支试管中加入1mL 充分振荡、静置,
充分振荡、静置, 层显紫色;
层显紫色;
②第二支试管中加入1滴 溶液,生成蓝色沉淀;
溶液,生成蓝色沉淀;
③第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是___________ (填离子符号);实验①和③说明:在 过量的情况下,溶液中仍含有
过量的情况下,溶液中仍含有___________ (填离子符号),由此可以证明该氧化还原反应为___________ 。
(5)丁组同学向盛有 溶液的试管中加入几滴酸化的
溶液的试管中加入几滴酸化的 溶液,溶液变成棕黄色,发生反应的离子方程式为
溶液,溶液变成棕黄色,发生反应的离子方程式为___________ 。
(6)利用如图装置探究 的稳定性。
的稳定性。___________ (填字母)。
A. 、
、 、
、
B. 、
、 、
、 、
、
C.FeO、 、
、 、
、 、
、
②III中溴水是用来检验是否有 气体生成,若有
气体生成,若有 生成,溴水将褪色。实验中,观察到溴水褪色,据此推测
生成,溴水将褪色。实验中,观察到溴水褪色,据此推测 分解最有可能被氧化的元素是
分解最有可能被氧化的元素是___________ 。
③NaOH的作用是吸收 气体,请写出用过量NaOH溶液吸收
气体,请写出用过量NaOH溶液吸收 气体的化学方程式:
气体的化学方程式:___________ 。
 、
、 的性质。(已知
的性质。(已知 遇
遇 溶液生成蓝色沉淀)回答下列问题:
溶液生成蓝色沉淀)回答下列问题:(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1
 的溶液。在
的溶液。在 溶液中需加入少量铁屑,其目的是
溶液中需加入少量铁屑,其目的是(2)甲组同学取2mL
 溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明
溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明 可将
可将 氧化。
氧化。 溶液与氯水反应的离子方程式为
溶液与氯水反应的离子方程式为(3)乙组同学认为甲组的实验不够严谨,该组同学在2mL
 溶液中先加入0.5mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是
溶液中先加入0.5mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是(4)丙组同学取10mL 0.1
 KI溶液,加入6mL 0.1
KI溶液,加入6mL 0.1
 溶液混合。分别取2mL此溶液于3支试管中进行如下实验:
溶液混合。分别取2mL此溶液于3支试管中进行如下实验:①第一支试管中加入1mL
 充分振荡、静置,
充分振荡、静置, 层显紫色;
层显紫色;②第二支试管中加入1滴
 溶液,生成蓝色沉淀;
溶液,生成蓝色沉淀;③第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是
 过量的情况下,溶液中仍含有
过量的情况下,溶液中仍含有(5)丁组同学向盛有
 溶液的试管中加入几滴酸化的
溶液的试管中加入几滴酸化的 溶液,溶液变成棕黄色,发生反应的离子方程式为
溶液,溶液变成棕黄色,发生反应的离子方程式为(6)利用如图装置探究
 的稳定性。
的稳定性。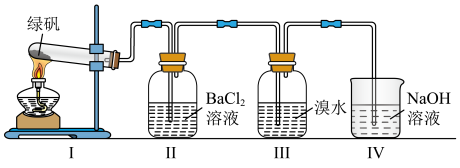
A.
 、
、 、
、
B.
 、
、 、
、 、
、
C.FeO、
 、
、 、
、 、
、
②III中溴水是用来检验是否有
 气体生成,若有
气体生成,若有 生成,溴水将褪色。实验中,观察到溴水褪色,据此推测
生成,溴水将褪色。实验中,观察到溴水褪色,据此推测 分解最有可能被氧化的元素是
分解最有可能被氧化的元素是③NaOH的作用是吸收
 气体,请写出用过量NaOH溶液吸收
气体,请写出用过量NaOH溶液吸收 气体的化学方程式:
气体的化学方程式:
您最近一年使用:0次
3 .  在工农业生产生活中都有重要的用途。某化学研究小组设计如下过程,请你参与探究,回答相关问题。
在工农业生产生活中都有重要的用途。某化学研究小组设计如下过程,请你参与探究,回答相关问题。
I. 的性质探究
的性质探究
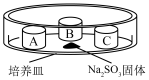
装置如下表(图)所示,培养皿中A、B、C三个塑料瓶盖内盛有不同物质。向 固体上滴加
固体上滴加 硫酸,迅速用玻璃片将培养皿盖严,实验现象记录如下。
硫酸,迅速用玻璃片将培养皿盖严,实验现象记录如下。
(1)70%浓硫酸溶液和 固体反应制备
固体反应制备 的化学方程式为
的化学方程式为________________________________ 。
(2)瓶盖A中发生反应的化学方程式为________________________________ 。
(3)瓶盖A中无明显变化,若要证明A中发生了化学反应,可先在蒸馏水中滴入少量试剂X,X是_______ (填字母)。
a. 溶液 b.
溶液 b. 溶液 c.石蕊溶液
溶液 c.石蕊溶液
(4)瓶盖_______ (填字母)中的实验现象能证明 具有还原性,反应的离子方程式为
具有还原性,反应的离子方程式为______________ 。
(5)综合上述实验信息可证明 具有还原性、
具有还原性、___________________________________ 等性质。
(6)增加瓶盖D可验证 具有氧化性,则D中盛装的试剂及现象是
具有氧化性,则D中盛装的试剂及现象是__________________________ 。
II.化石燃料燃烧会产生大量的 ,造成环境污染,某化学研究小组设计如下表列出的3种燃煤烟气脱硫方法的原理。
,造成环境污染,某化学研究小组设计如下表列出的3种燃煤烟气脱硫方法的原理。
(7)如果不对燃煤烟气脱硫,易形成硫酸型酸雨,酸雨一般指的是 小于
小于_______________ 的降雨。
(8)方法I中氨水吸收燃煤烟气中 的化学反应为:
的化学反应为: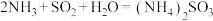 、
、__________ 。
(9)方法II中用 将
将 还原为S时,
还原为S时, 转化为
转化为_______________ (填化学式)。
(10)对方法III吸收 后的溶液加热可使吸收液再生,其反应属于基本反应类型中的
后的溶液加热可使吸收液再生,其反应属于基本反应类型中的___________ 反应。
 在工农业生产生活中都有重要的用途。某化学研究小组设计如下过程,请你参与探究,回答相关问题。
在工农业生产生活中都有重要的用途。某化学研究小组设计如下过程,请你参与探究,回答相关问题。I.
 的性质探究
的性质探究装置如下表(图)所示,培养皿中A、B、C三个塑料瓶盖内盛有不同物质。向
 固体上滴加
固体上滴加 硫酸,迅速用玻璃片将培养皿盖严,实验现象记录如下。
硫酸,迅速用玻璃片将培养皿盖严,实验现象记录如下。实验装置 | 㼛盖 | 物质 | 实验现象 |
| A | 蒸馏水 | 无明显变化 |
B |
| 溶液褪色 | |
C | 蘸有品红溶液的棉花 | 品红溶液褪色 |
(1)70%浓硫酸溶液和
 固体反应制备
固体反应制备 的化学方程式为
的化学方程式为(2)瓶盖A中发生反应的化学方程式为
(3)瓶盖A中无明显变化,若要证明A中发生了化学反应,可先在蒸馏水中滴入少量试剂X,X是
a.
 溶液 b.
溶液 b. 溶液 c.石蕊溶液
溶液 c.石蕊溶液(4)瓶盖
 具有还原性,反应的离子方程式为
具有还原性,反应的离子方程式为(5)综合上述实验信息可证明
 具有还原性、
具有还原性、(6)增加瓶盖D可验证
 具有氧化性,则D中盛装的试剂及现象是
具有氧化性,则D中盛装的试剂及现象是II.化石燃料燃烧会产生大量的
 ,造成环境污染,某化学研究小组设计如下表列出的3种燃煤烟气脱硫方法的原理。
,造成环境污染,某化学研究小组设计如下表列出的3种燃煤烟气脱硫方法的原理。方法1 | 用氨水将 转化为 转化为 ,再氧化成 ,再氧化成 |
方法2 | 用生物质热解气(主要成分 、 、 、 、 )将 )将 在高温下还原成单质硫,其他生成物均可直接排放 在高温下还原成单质硫,其他生成物均可直接排放 |
方法3 | 用 溶液吸收 溶液吸收 ,再经电解转化为 ,再经电解转化为 |
(7)如果不对燃煤烟气脱硫,易形成硫酸型酸雨,酸雨一般指的是
 小于
小于(8)方法I中氨水吸收燃煤烟气中
 的化学反应为:
的化学反应为: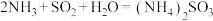 、
、(9)方法II中用
 将
将 还原为S时,
还原为S时, 转化为
转化为(10)对方法III吸收
 后的溶液加热可使吸收液再生,其反应属于基本反应类型中的
后的溶液加热可使吸收液再生,其反应属于基本反应类型中的
您最近一年使用:0次
2024-01-17更新
|
122次组卷
|
2卷引用:福建省厦门第一中学2023-2024学年高一上学期12月月考化学试题
名校
解题方法
4 . 下列操作、现象及结论都正确的是
| 选项 | 操作及现象 | 结论 |
| A | 向蓝色石蕊溶液中通入足量二氧化硫气体,可以观察到溶液先变红后褪色。 | 验证SO2的漂白性 |
| B | 用pH试纸测得:CH3COONa溶液的pH约为9,NaClO溶液的pH约为8 | HClO电离出H+的能力比CH3COOH的强 |
| C | 向FeBr2和KSCN混合溶液中滴入少量新制氯水,再加入CCl4混合振荡、静置,下层呈无色,上层呈红色。 | Fe2+的还原性大于Br- |
| D | 向碳酸钙中加入盐酸,产生的气体经饱和碳酸氢钠溶液洗气后,再通入硅酸钠溶液,出现白色沉淀 | 利用该实验可以证明非金属性:Cl>C>Si |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-11-11更新
|
326次组卷
|
2卷引用:福建省福州市八县一中2023-2024学年高三上学期11月期中化学试题
5 . 某小组探究 溶液与KI溶液的反应及其速率,实验过程和现象如表。
溶液与KI溶液的反应及其速率,实验过程和现象如表。
已知:ⅰ. 具有强氧化性,能完全电离,
具有强氧化性,能完全电离, 易被还原为
易被还原为 ;
;
ⅱ.淀粉检测 的灵敏度很高,遇低浓度的
的灵敏度很高,遇低浓度的 即可快速变蓝;
即可快速变蓝;
ⅲ. 可与
可与 发生反应:
发生反应: 。
。
(1)实验1-1的目的是________________________ 。
(2) 与KI反应的离子方程式为
与KI反应的离子方程式为________________________ 。
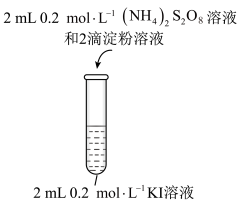
为了研究 与KI反应的速率,小组同学分别向两支试管中依次加入下列试剂,并记录变色时间,如表。
与KI反应的速率,小组同学分别向两支试管中依次加入下列试剂,并记录变色时间,如表。
(3)实验2-1不能用于测定 与KI反应的速率,原因有无
与KI反应的速率,原因有无 时反应生成少量
时反应生成少量 后淀粉立即变蓝,无法确定
后淀粉立即变蓝,无法确定 与
与 反应的浓度变化外,还有
反应的浓度变化外,还有____________ 。
(4)加入 溶液后溶液变蓝的时间明显增长,甲同学对此提出两种猜想。
溶液后溶液变蓝的时间明显增长,甲同学对此提出两种猜想。
猜想1: 先与
先与 反应,使
反应,使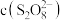 降低;
降低;
猜想2: 先与KI反应,
先与KI反应, ,
,
①甲同学提出猜想1的依据:由信息ⅲ推测, 的还原性
的还原性______ (填“强于”或“弱于”)KI的。
②乙同学根据现有数据证明猜想1不成立,理由是__________________ 。
③补全猜想2:________________________________________________ 。
(5)查阅文献表明猜想2成立。根据实验2-2的数据,计算30s内的平均反应速率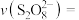
____________  (写出计算式)。
(写出计算式)。
(6)实验2-2中,30s内未检测到 与
与 反应,可能原因是
反应,可能原因是______ 。(写出2条)。
 溶液与KI溶液的反应及其速率,实验过程和现象如表。
溶液与KI溶液的反应及其速率,实验过程和现象如表。已知:ⅰ.
 具有强氧化性,能完全电离,
具有强氧化性,能完全电离, 易被还原为
易被还原为 ;
;ⅱ.淀粉检测
 的灵敏度很高,遇低浓度的
的灵敏度很高,遇低浓度的 即可快速变蓝;
即可快速变蓝;ⅲ.
 可与
可与 发生反应:
发生反应: 。
。编号 | 1-1 | 1-2 |
实验操作 |
|
|
现象 | 无明显现象 | 溶液立即变蓝 |
(2)
 与KI反应的离子方程式为
与KI反应的离子方程式为为了研究
 与KI反应的速率,小组同学分别向两支试管中依次加入下列试剂,并记录变色时间,如表。
与KI反应的速率,小组同学分别向两支试管中依次加入下列试剂,并记录变色时间,如表。编号 |
|
| 蒸馏水/mL | 0.4%的淀粉溶液/滴 |
| 变色时间/s |
2-1 | 2 | 0 | 2.8 | 2 | 0.2 | 立即 |
2-2 | 2 | 0.8 | 0.2 | 2 | 2 | 30 |
 与KI反应的速率,原因有无
与KI反应的速率,原因有无 时反应生成少量
时反应生成少量 后淀粉立即变蓝,无法确定
后淀粉立即变蓝,无法确定 与
与 反应的浓度变化外,还有
反应的浓度变化外,还有(4)加入
 溶液后溶液变蓝的时间明显增长,甲同学对此提出两种猜想。
溶液后溶液变蓝的时间明显增长,甲同学对此提出两种猜想。猜想1:
 先与
先与 反应,使
反应,使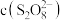 降低;
降低;猜想2:
 先与KI反应,
先与KI反应, ,
,①甲同学提出猜想1的依据:由信息ⅲ推测,
 的还原性
的还原性②乙同学根据现有数据证明猜想1不成立,理由是
③补全猜想2:
(5)查阅文献表明猜想2成立。根据实验2-2的数据,计算30s内的平均反应速率
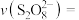
 (写出计算式)。
(写出计算式)。(6)实验2-2中,30s内未检测到
 与
与 反应,可能原因是
反应,可能原因是
您最近一年使用:0次
13-14高三上·北京海淀·期中
名校
6 . 已知下列实验事实:
① 固体既能溶于KOH溶液得到
固体既能溶于KOH溶液得到 溶液,又能溶于硫酸得到
溶液,又能溶于硫酸得到 溶液;
溶液;
②向 溶液中滴加
溶液中滴加 溶液,再酸化,可得
溶液,再酸化,可得 溶液;
溶液;
③将 溶液滴加到淀粉和KI的混合溶液中,溶液变蓝。
溶液滴加到淀粉和KI的混合溶液中,溶液变蓝。
下列判断不正确的是
①
 固体既能溶于KOH溶液得到
固体既能溶于KOH溶液得到 溶液,又能溶于硫酸得到
溶液,又能溶于硫酸得到 溶液;
溶液;②向
 溶液中滴加
溶液中滴加 溶液,再酸化,可得
溶液,再酸化,可得 溶液;
溶液;③将
 溶液滴加到淀粉和KI的混合溶液中,溶液变蓝。
溶液滴加到淀粉和KI的混合溶液中,溶液变蓝。下列判断不正确的是
A.化合物 中Cr元素为+3价 中Cr元素为+3价 |
B.实验①证明 是两性氧化物 是两性氧化物 |
C.实验②证明 既有氧化性又有还原性 既有氧化性又有还原性 |
D.实验③证明氧化性: |
您最近一年使用:0次
2022-11-29更新
|
319次组卷
|
37卷引用:2015届福建省厦门双十中学高三上学期期中化学试卷
(已下线)2015届福建省厦门双十中学高三上学期期中化学试卷2016届福建省大田县第一中学高三上学期期中考试化学试卷2017届福建省南安一中高三暑假阶段性考试化学试卷(已下线)2014届北京市海淀区高三上学期期中考试化学试卷(已下线)2015届江西省新余一中高三上学期第三次模拟化学试卷2015届河北省冀州中学高三上学期期中化学A试卷2015届四川省高三“联测促改”活动第二轮测试理综化学试卷2016届河南省西华县第一高级中学高三上学期10月联考化学试卷2015-2016学年江苏省镇江中学高一上学期期中考试化学试卷2016届河南省洛阳市高三上学期12月统考化学试卷2015-2016学年河北石家庄一中高一下学情反馈一化学卷2017届山东省淄博市淄川一中高三上学期第一次月考化学试卷2017届河北省定州中学高三上学期第二次月考化学试卷2016-2017学年河北省武邑中学高二上学期第二次月考化学试卷2017届山东省莱州一中高三上第一次质检化学试卷黑龙江省牡丹江市第一高级中学2016-2017学年高二6月月考化学试题苏教版2017届高三单元精练检测二化学试题黑龙江省牡丹江市第一高级中学2016-2017学年高二下学期期末考试化学试题北京市清华大学附属中学2016-2017学年高一下学期期中考试化学试题江西省抚州市临川区第一中学2018届高三上学期期中考试化学试题黑龙江省哈尔滨市第六中学2017-2018学年高一12月月考化学试题黑龙江省哈尔滨六中2017-2018学年高一12月月考化学试卷(已下线)北京四中2018届上学期高三年级期中考试化学试卷天津市滨海新区大港油田一中2019届高三上学期期中考试化学试题【全国百强校】北京市北京四中2019届高三上学期期中考试化学试题河北省沧州市泊头市第一中学2020届高三上学期第二次月考化学试题云南省曲靖二中2020届高三第一次月考理综化学试题(已下线)【南昌新东方】江西省九江市第一中学2015-2016学年高一上学期第二次(12月)月考化学试题(已下线)【南昌新东方】江西省九江一中2015-2016学年高一上学期第二次月考化学试卷北京师范大学附属实验中学 2019-2020 学年高一下学期 AR 层线上测试化学试题广东省珠海市第二中学2021届高三10月月考化学试题江西省兴国三中2021届高三上学期第一次月考化学试题安徽省泗县第一中学2022届高三上学期开学考试化学试题江西省樟树航天中学高三年级2021-2022学年高三上学期10月调研考试化学试题重庆南开中学2022-2023学年高一上学期期中考试化学试题广东省惠州市惠阳区中山中学2021-2022学年高一上学期第三次月考质量检测化学试题(已下线)第4讲 氧化还原反应的基本概念与规律
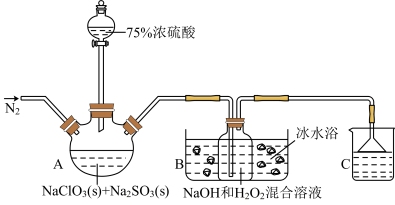
7 . 用于灭活新冠病毒的二氧化氯稳定性较差(纯 易分解爆炸),故用
易分解爆炸),故用 和NaOH混合溶液将其吸收转化为
和NaOH混合溶液将其吸收转化为 保存。现利用如下装置(夹持装置略去)及试剂制备
保存。现利用如下装置(夹持装置略去)及试剂制备 。
。
已知:① 熔点―59℃、沸点11℃,在碱性环境中发生反应:
熔点―59℃、沸点11℃,在碱性环境中发生反应: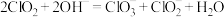 ;
;
②温度高于60℃时, 分解成
分解成 和NaCl。
和NaCl。
回答下列问题:
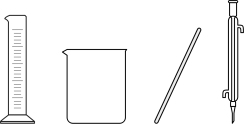
(1)配制75%浓硫酸,下列仪器中不需要的是_______ (填仪器名称)。
(2)A为 的发生装置,生成
的发生装置,生成 的离子方程式为
的离子方程式为_______ 。
(3)实验过程中持续通入 的作用是
的作用是_______ 。
(4)装置B中 和NaOH需按照一定比例混合配成溶液与
和NaOH需按照一定比例混合配成溶液与 反应制取
反应制取 ,
, 作
作_______ (填“氧化剂”或“还原剂”);此装置需要采用冰水浴,可能的原因为_______ (任写一点)。
(5)装置C烧杯中的试剂是_______ 。
(6)某同学认为实验过程中会产生 ,推测产品中可能含
,推测产品中可能含 杂质,请设计简单实验证明
杂质,请设计简单实验证明_______ 。
(7)某研究性学习小组用制取的 作漂白剂。0.5mol
作漂白剂。0.5mol 的氧化能力(得电子数)相当于
的氧化能力(得电子数)相当于_______ g  的氧化能力。
的氧化能力。
 易分解爆炸),故用
易分解爆炸),故用 和NaOH混合溶液将其吸收转化为
和NaOH混合溶液将其吸收转化为 保存。现利用如下装置(夹持装置略去)及试剂制备
保存。现利用如下装置(夹持装置略去)及试剂制备 。
。
已知:①
 熔点―59℃、沸点11℃,在碱性环境中发生反应:
熔点―59℃、沸点11℃,在碱性环境中发生反应: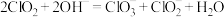 ;
;②温度高于60℃时,
 分解成
分解成 和NaCl。
和NaCl。回答下列问题:
(1)配制75%浓硫酸,下列仪器中不需要的是

(2)A为
 的发生装置,生成
的发生装置,生成 的离子方程式为
的离子方程式为(3)实验过程中持续通入
 的作用是
的作用是(4)装置B中
 和NaOH需按照一定比例混合配成溶液与
和NaOH需按照一定比例混合配成溶液与 反应制取
反应制取 ,
, 作
作(5)装置C烧杯中的试剂是
(6)某同学认为实验过程中会产生
 ,推测产品中可能含
,推测产品中可能含 杂质,请设计简单实验证明
杂质,请设计简单实验证明(7)某研究性学习小组用制取的
 作漂白剂。0.5mol
作漂白剂。0.5mol 的氧化能力(得电子数)相当于
的氧化能力(得电子数)相当于 的氧化能力。
的氧化能力。
您最近一年使用:0次
2022-09-11更新
|
214次组卷
|
2卷引用:福建省漳州市2023届高三毕业班9月第一次教学质量检测化学试卷
名校
解题方法
8 . 某实验小组探究少量Cl2和FeBr2反应的过程。
(1)配制FeBr2溶液:
i.配制50 mL 1.0 mol/L FeBr2溶液;
ii.上述溶液呈淡黄色。取少量此溶液,向其中滴入KSCN溶液,变为浅红色。
①配制50mL 1.0 mol/LFeBr2溶液需要的玻璃仪器是烧杯、玻璃棒、量筒、_______ 、_______ 。
②由ii可知,此FeBr2 溶液呈淡黄色的原因是其中含有_______ ,解释溶液呈淡黄色的原因:_______ 。
(2)氯气和FeBr2反应实验操作及现象如下:
据此甲同学得出结论:少量Cl2既能和Fe2+又能和Br-发生氧化还原反应。

i.Cl2和Fe2+发生反应的离子方程式是_______ 。
ii.乙同学认为上述实验不能证明Cl2和Br-发生反应,理由是_______ 。
iii.乙同学改进实验如下:在上述FeBr2溶液中加入过量铁粉,取上清液2 mL,向其中滴加3滴饱和氯水后,再加入CCl4,振荡后静置,观察现象。乙得出结论:少量Cl2只与Fe2+反应,不与Br-反应。乙得出该结论依据的实验现象是_______ 。
(3)丙同学继续设计实验,探究反应过程:
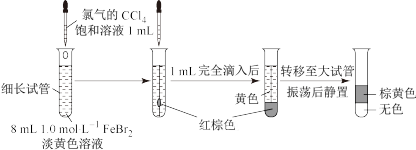
i.转移到大试管前CCl4液体中呈红棕色的物质是_______ 。
ii.丙通过此实验可得出结论:_______ 。
(1)配制FeBr2溶液:
i.配制50 mL 1.0 mol/L FeBr2溶液;
ii.上述溶液呈淡黄色。取少量此溶液,向其中滴入KSCN溶液,变为浅红色。
①配制50mL 1.0 mol/LFeBr2溶液需要的玻璃仪器是烧杯、玻璃棒、量筒、
②由ii可知,此FeBr2 溶液呈淡黄色的原因是其中含有
(2)氯气和FeBr2反应实验操作及现象如下:
据此甲同学得出结论:少量Cl2既能和Fe2+又能和Br-发生氧化还原反应。

i.Cl2和Fe2+发生反应的离子方程式是
ii.乙同学认为上述实验不能证明Cl2和Br-发生反应,理由是
iii.乙同学改进实验如下:在上述FeBr2溶液中加入过量铁粉,取上清液2 mL,向其中滴加3滴饱和氯水后,再加入CCl4,振荡后静置,观察现象。乙得出结论:少量Cl2只与Fe2+反应,不与Br-反应。乙得出该结论依据的实验现象是
(3)丙同学继续设计实验,探究反应过程:

i.转移到大试管前CCl4液体中呈红棕色的物质是
ii.丙通过此实验可得出结论:
您最近一年使用:0次
9 . 工业上利用含镍废料(主要成分为镍、铝、氧化铁、石墨等)提取Ni2O3,工艺流程如下:

已知:①Fe3+不能氧化Ni2+。
②各物质的溶度积: ,Ksp[Fe(OH)3]=4.0×10-38,
,Ksp[Fe(OH)3]=4.0×10-38, ,
, 。
。
(1)为了除去含镍废料表面的矿物油污,可选用___________ (填标号)浸泡。
A.热纯碱溶液 B.NaOH溶液 C.酒精
(2)镍的浸出率与温度的关系如图所示,温度高于40℃时镍的浸出率开始下降,主要原因可能是___________ 。

(3)室温下,“浸出”所得溶液中Fe3+的浓度为0.2 mol/L,当溶液的pH从1.0调到2.0时,沉铁率为___________ (忽略因调pH溶液体积的变化)。
(4)滤渣2的主要成分是___________ 。
(5)证明“沉镍”中Ni2+已经完全沉淀的实验步骤及现象为___________ 。
(6)“沉镍”生成NiC2O4·2H2O沉淀,则“沉淀转化”的化学方程式为___________ 。
(7)“氧化”的离子方程式为___________ 。

已知:①Fe3+不能氧化Ni2+。
②各物质的溶度积:
 ,Ksp[Fe(OH)3]=4.0×10-38,
,Ksp[Fe(OH)3]=4.0×10-38, ,
, 。
。(1)为了除去含镍废料表面的矿物油污,可选用
A.热纯碱溶液 B.NaOH溶液 C.酒精
(2)镍的浸出率与温度的关系如图所示,温度高于40℃时镍的浸出率开始下降,主要原因可能是

(3)室温下,“浸出”所得溶液中Fe3+的浓度为0.2 mol/L,当溶液的pH从1.0调到2.0时,沉铁率为
(4)滤渣2的主要成分是
(5)证明“沉镍”中Ni2+已经完全沉淀的实验步骤及现象为
(6)“沉镍”生成NiC2O4·2H2O沉淀,则“沉淀转化”的化学方程式为
(7)“氧化”的离子方程式为
您最近一年使用:0次
名校
解题方法
10 . 下列物质中,可与Fe3+反应且能证明Fe3+具有氧化性的是
| A.KSCN | B.NaOH | C.H2SO4 | D.Fe |
您最近一年使用:0次
2021-12-30更新
|
316次组卷
|
3卷引用:福建省厦门第一中学2021-2022学年高一上学期12月月考化学试题

 酸性溶液
酸性溶液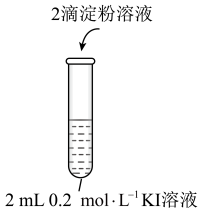
 KI溶液/mL
KI溶液/mL


