1 . 我国的冶金工业十分发达,钢铁年产量已达到十亿吨,占世界产量的一半以上,同时有色金属产量也超过了七千万吨。
(1)铜是人类最早使用的金属,其电阻率小、延展性好,常用于制作电路板,在使用氯化铁溶液蚀刻铜制电路板时,发生反应的化学方程式为___________ 。
(2)铝与 溶液反应的化学方程式为
溶液反应的化学方程式为___________ ;铝的化学性质较活泼,但在空气中不会完全锈蚀,其原因是___________ 。
(3)电镀是一种常见的金属处理工艺,然而在生产过程中,电镀厂会产生大量的高毒性废水,将其直接排放会造成严重的污染。因此,废水的处理是电镀行业面临的主要问题之一。
①在电镀之前,镀件需要用酸性 溶液浸泡清洗。清洗废液的处理需要去除其中的悬浮颗粒物,并加入足量的
溶液浸泡清洗。清洗废液的处理需要去除其中的悬浮颗粒物,并加入足量的 固体,将
固体,将 还原为
还原为 ,则还原过程中发生反应的离子方程式为
,则还原过程中发生反应的离子方程式为___________ ,当有 被完全处理时,理论上需要加入
被完全处理时,理论上需要加入 的质量为
的质量为___________ 。
②为了减缓镀件表面的金属沉积速率,得到均匀、光滑的镀层,电解液中除重金属盐外,还需要加入剧毒的 。已知
。已知 中各原子均满足8电子稳定结构,则
中各原子均满足8电子稳定结构,则 的电子式为
的电子式为___________ 。在碱性的废电解液中通入氯气可以将 氧化,并生成两种无毒的氧化产物(其中一种为大气中占比最多的成分),则反应的离子方程式为
氧化,并生成两种无毒的氧化产物(其中一种为大气中占比最多的成分),则反应的离子方程式为___________ 。
(1)铜是人类最早使用的金属,其电阻率小、延展性好,常用于制作电路板,在使用氯化铁溶液蚀刻铜制电路板时,发生反应的化学方程式为
(2)铝与
 溶液反应的化学方程式为
溶液反应的化学方程式为(3)电镀是一种常见的金属处理工艺,然而在生产过程中,电镀厂会产生大量的高毒性废水,将其直接排放会造成严重的污染。因此,废水的处理是电镀行业面临的主要问题之一。
①在电镀之前,镀件需要用酸性
 溶液浸泡清洗。清洗废液的处理需要去除其中的悬浮颗粒物,并加入足量的
溶液浸泡清洗。清洗废液的处理需要去除其中的悬浮颗粒物,并加入足量的 固体,将
固体,将 还原为
还原为 ,则还原过程中发生反应的离子方程式为
,则还原过程中发生反应的离子方程式为 被完全处理时,理论上需要加入
被完全处理时,理论上需要加入 的质量为
的质量为②为了减缓镀件表面的金属沉积速率,得到均匀、光滑的镀层,电解液中除重金属盐外,还需要加入剧毒的
 。已知
。已知 中各原子均满足8电子稳定结构,则
中各原子均满足8电子稳定结构,则 的电子式为
的电子式为 氧化,并生成两种无毒的氧化产物(其中一种为大气中占比最多的成分),则反应的离子方程式为
氧化,并生成两种无毒的氧化产物(其中一种为大气中占比最多的成分),则反应的离子方程式为
您最近一年使用:0次
名校
解题方法
2 . 硫代硫酸钠 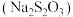 在工业生产、医药制造业中被广泛应用,工业普遍使用
在工业生产、医药制造业中被广泛应用,工业普遍使用 与硫黄
与硫黄 共煮得到。
共煮得到。
(1)除了以上原料可以制备 ,根据“价-类”二维图信息分析,还有合理的是___________。
,根据“价-类”二维图信息分析,还有合理的是___________。
(2)如图:向圆底烧瓶中加入浓硫酸并加热,烧瓶中反应的化学方程式:___________ ;过程主要表现了浓硫酸的哪些性质___________ 。
(3)直到反应完毕,最后发现烧瓶中还有一定量的 和
和 剩余,问题讨论:为什么有一定量的余酸还未能使
剩余,问题讨论:为什么有一定量的余酸还未能使 完全溶解。你认为原因是
完全溶解。你认为原因是___________ ,足量下列药品能够用来证明反应结束后的烧瓶中的确有余酸的是___________ ,___________ 。(填两类不同的化学物质)
A.Fe B.BaCl2溶液 C.Ag D.Na2CO3溶液
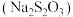 在工业生产、医药制造业中被广泛应用,工业普遍使用
在工业生产、医药制造业中被广泛应用,工业普遍使用 与硫黄
与硫黄 共煮得到。
共煮得到。(1)除了以上原料可以制备
 ,根据“价-类”二维图信息分析,还有合理的是___________。
,根据“价-类”二维图信息分析,还有合理的是___________。A. | B.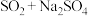 | C. | D.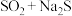 |
(2)如图:向圆底烧瓶中加入浓硫酸并加热,烧瓶中反应的化学方程式:
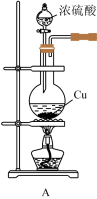
(3)直到反应完毕,最后发现烧瓶中还有一定量的
 和
和 剩余,问题讨论:为什么有一定量的余酸还未能使
剩余,问题讨论:为什么有一定量的余酸还未能使 完全溶解。你认为原因是
完全溶解。你认为原因是A.Fe B.BaCl2溶液 C.Ag D.Na2CO3溶液
您最近一年使用:0次
名校
3 . 请根据硫元素的价类二维图,回答下列问题:___________ (填化学式)。
(2)宋代著名法医学家宋慈的 洗冤集录
洗冤集录 中有关于“银针验毒”的记载,银针主要用于检验是否有含硫元素的有毒物质。其反应原理之一为:Ag + X + O2 →Ag2S + H2O(反应未配平),已知:Ag2S为一种不溶于水的灰黑色固体。以下有关说法
中有关于“银针验毒”的记载,银针主要用于检验是否有含硫元素的有毒物质。其反应原理之一为:Ag + X + O2 →Ag2S + H2O(反应未配平),已知:Ag2S为一种不溶于水的灰黑色固体。以下有关说法错误 的是___________(填字母)。
(3)Y转化为Z可以选择下列试剂___________ 。
A.酸性KMnO4溶液 B.FeCl2溶液 C.NaOH溶液 D.X的水溶液
写出你所选试剂将Y转化为Z的离子方程式___________ 。
(4)若N是CuSO4,某同学设计了甲和乙两种方法制备:
甲: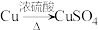 乙:
乙:
①写出甲方法反应的化学方程式:___________ 。
②甲和乙方法更合理的是___________ (填“甲”或“乙”),理由是___________ (答两点)。
(5)已知空气中SO2的最大允许排放浓度不得超过0.02 mg•L-1,可通过下列装置定量分析空气中SO2的含量。___________ mg•L-1(结果精确到0.001)。

(2)宋代著名法医学家宋慈的
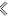 洗冤集录
洗冤集录 中有关于“银针验毒”的记载,银针主要用于检验是否有含硫元素的有毒物质。其反应原理之一为:Ag + X + O2 →Ag2S + H2O(反应未配平),已知:Ag2S为一种不溶于水的灰黑色固体。以下有关说法
中有关于“银针验毒”的记载,银针主要用于检验是否有含硫元素的有毒物质。其反应原理之一为:Ag + X + O2 →Ag2S + H2O(反应未配平),已知:Ag2S为一种不溶于水的灰黑色固体。以下有关说法| A.当银针变黑时,说明所检验的物质中可能有毒 |
| B.银针验毒时,Ag被氧化 |
| C.X在上述验毒反应中作还原剂 |
| D.上述验毒反应中氧化剂和还原剂的物质的量之比为4∶1 |
(3)Y转化为Z可以选择下列试剂
A.酸性KMnO4溶液 B.FeCl2溶液 C.NaOH溶液 D.X的水溶液
写出你所选试剂将Y转化为Z的离子方程式
(4)若N是CuSO4,某同学设计了甲和乙两种方法制备:
甲:
 乙:
乙:
①写出甲方法反应的化学方程式:
②甲和乙方法更合理的是
(5)已知空气中SO2的最大允许排放浓度不得超过0.02 mg•L-1,可通过下列装置定量分析空气中SO2的含量。
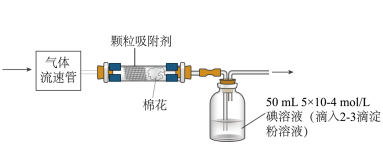
您最近一年使用:0次
2024-04-29更新
|
223次组卷
|
2卷引用:四川省南充高级中学2023-2024学年高一下学期3月月考化学试题
名校
4 . 氢化钠(NaH)是一种常用的储氢剂,遇水后放出氢气并生成一种碱,该反应的还原剂为___________ 。(写化学式)
您最近一年使用:0次
5 . 科学家经过研究发现中国霾星中性,其主要原因如图所示:_______ 。
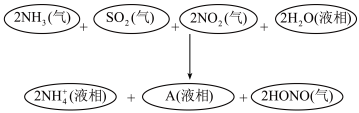
您最近一年使用:0次
名校
解题方法
6 . 含氯消毒剂在生产生活中被广泛用于杀菌、消毒和漂白。
(1)氯水具有漂白性,其中起漂白作用的物质是
(2)氯水需要避光保存,原因是
(3)通常将Cl2与NaOH或
 反应制成便于保存的消毒液或漂白粉。Cl2与NaOH溶液反应的离子方程式为
反应制成便于保存的消毒液或漂白粉。Cl2与NaOH溶液反应的离子方程式为(4)漂白粉[成分为
 、
、 和CaCl2]可用于鱼塘的消毒,防治水生生物细菌性疾病。使用注意事项如下:
和CaCl2]可用于鱼塘的消毒,防治水生生物细菌性疾病。使用注意事项如下:a.不宜用金属容器盛装
b.勿与酸性物质混用
c.水体中铵盐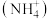 含量高,使用时产生NH3
含量高,使用时产生NH3
d.水体中亚硝酸盐(NO2)含量高,会降低其消毒效果
①注意事项a说明漂白粉具有
②为了验证注意事项b,向漂白粉中滴加稀硫酸,产生黄绿色气体,被还原的微粒是
③注意事项c中NH3产生的原因是
④从物质性质的角度解释注意事项d中漂白粉消毒效果降低的原因 浓度较高的鱼塘使用漂白粉,会使水中
浓度较高的鱼塘使用漂白粉,会使水中 含量升高,池水富营养化。)
含量升高,池水富营养化。)
您最近一年使用:0次
7 . 将KI、NaBr、NaCl、K2S、(NH4)2SO3的溶液及氯水和碘水放入一烧杯中,若反应完毕后氯有剩余,则溶液中含量最大的离子是___________ ,一定不存在的离子是___________ 。
您最近一年使用:0次
8 .  与一定量的水形成晶体
与一定量的水形成晶体 ,Q在一定条件下可转化为R:
,Q在一定条件下可转化为R:

回答下列问题:
(1)元素B位于元素周期表的第______ 周期,第______ 族。其常见化合价应为______ 价。B的原子结构示意图是______ 。
(2) 的电子式为
的电子式为______ ,每个R的阴离子中含有极性键的数目为______ 。 的形成过程,可用电子式表示为
的形成过程,可用电子式表示为______ 。上述Q和R的转化属于______ 变化(填“物理”或“化学”)。
(3)HF气体的稳定性______ HCl气体(填“>”或“<”)。已知 ,该反应的还原剂是
,该反应的还原剂是______ ,氧化产物是______ 。
(4)若不慎将KOH溶液沾到皮肤上,应立即用大量水冲洗,然后涂上1%的硼酸。已知硼酸( )在水溶液中呈现酸性的原因是:
)在水溶液中呈现酸性的原因是: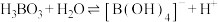 。则按照酸类物质常用的分类方法,硼酸应属于
。则按照酸类物质常用的分类方法,硼酸应属于______ 元酸。它与KOH溶液反应的离子方程式为____________ 。
 与一定量的水形成晶体
与一定量的水形成晶体 ,Q在一定条件下可转化为R:
,Q在一定条件下可转化为R:
回答下列问题:
(1)元素B位于元素周期表的第
(2)
 的电子式为
的电子式为 的形成过程,可用电子式表示为
的形成过程,可用电子式表示为(3)HF气体的稳定性
 ,该反应的还原剂是
,该反应的还原剂是(4)若不慎将KOH溶液沾到皮肤上,应立即用大量水冲洗,然后涂上1%的硼酸。已知硼酸(
 )在水溶液中呈现酸性的原因是:
)在水溶液中呈现酸性的原因是: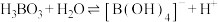 。则按照酸类物质常用的分类方法,硼酸应属于
。则按照酸类物质常用的分类方法,硼酸应属于
您最近一年使用:0次
名校
解题方法
9 . 硫酸亚铁是重要的化工原料,以硫酸亚铁为原料可以获得下列物质:
(1)保存硫酸亚铁溶液时,为防止 溶液氧化变质,常在硫酸亚铁溶液加入少量
溶液氧化变质,常在硫酸亚铁溶液加入少量_______ 。
(2)制备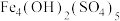 的两个步骤中,第①步反应的离子方程式为
的两个步骤中,第①步反应的离子方程式为_______ 。
(3)制备 ;向
;向 溶液中加入过量的
溶液中加入过量的 溶液,生成
溶液,生成 沉淀同时有气体放出,此气体可使澄清石灰水变浑浊。该反应的离子方程式为
沉淀同时有气体放出,此气体可使澄清石灰水变浑浊。该反应的离子方程式为_______ 。
(4)检验 中不同价态的铁元素,选用的试剂是
中不同价态的铁元素,选用的试剂是_______ (填字母代号)。
a.稀硝酸 b.稀硫酸 c.硫氰化钾溶液 d.高锰酸钾溶液 e.氢氧化钠溶液
(5)已知在酸性环境中几种离子之间会发生如下转化:
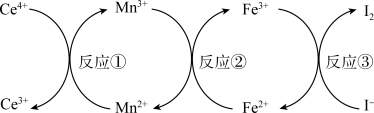
则按离子的还原性从弱到强排列,顺序应该是_______ 。
(1)保存硫酸亚铁溶液时,为防止
 溶液氧化变质,常在硫酸亚铁溶液加入少量
溶液氧化变质,常在硫酸亚铁溶液加入少量(2)制备
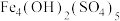 的两个步骤中,第①步反应的离子方程式为
的两个步骤中,第①步反应的离子方程式为(3)制备
 ;向
;向 溶液中加入过量的
溶液中加入过量的 溶液,生成
溶液,生成 沉淀同时有气体放出,此气体可使澄清石灰水变浑浊。该反应的离子方程式为
沉淀同时有气体放出,此气体可使澄清石灰水变浑浊。该反应的离子方程式为(4)检验
 中不同价态的铁元素,选用的试剂是
中不同价态的铁元素,选用的试剂是a.稀硝酸 b.稀硫酸 c.硫氰化钾溶液 d.高锰酸钾溶液 e.氢氧化钠溶液
(5)已知在酸性环境中几种离子之间会发生如下转化:

则按离子的还原性从弱到强排列,顺序应该是
您最近一年使用:0次
解题方法
10 . 氧化还原反应在工农业生产、日常生活中具有广泛的用途。
(1)氯碱工业的反应原理为 ,该反应中的氧化剂是
,该反应中的氧化剂是___________ 。
(2)为了防止食品变质而添加的抗氧化剂应具有___________ 性。(填“氧化”或“还原”)
(3)电子工业中常用 溶液腐蚀覆在绝缘板上的铜箔制造印刷电路板,其反应的离子方程式为
溶液腐蚀覆在绝缘板上的铜箔制造印刷电路板,其反应的离子方程式为___________ 。
(4) 可用于制备铬矾、铬颜料等,也是制造火柴头的原料之一。已知反应:
可用于制备铬矾、铬颜料等,也是制造火柴头的原料之一。已知反应: ,由此可知
,由此可知 的氧化性
的氧化性___________ (填“>”或“<”) 。该反应中氧化剂与还原剂的物质的量之比为
。该反应中氧化剂与还原剂的物质的量之比为___________ 。
(1)氯碱工业的反应原理为
 ,该反应中的氧化剂是
,该反应中的氧化剂是(2)为了防止食品变质而添加的抗氧化剂应具有
(3)电子工业中常用
 溶液腐蚀覆在绝缘板上的铜箔制造印刷电路板,其反应的离子方程式为
溶液腐蚀覆在绝缘板上的铜箔制造印刷电路板,其反应的离子方程式为(4)
 可用于制备铬矾、铬颜料等,也是制造火柴头的原料之一。已知反应:
可用于制备铬矾、铬颜料等,也是制造火柴头的原料之一。已知反应: ,由此可知
,由此可知 的氧化性
的氧化性 。该反应中氧化剂与还原剂的物质的量之比为
。该反应中氧化剂与还原剂的物质的量之比为
您最近一年使用:0次



