解题方法
1 . 中华文化博大精深,蕴含着丰富且深邃的化学知识。下列说法正确的是
| A.“凡石灰经火焚炼为用”,其反应原理可用于制备生石灰 |
B.“高奴县有洧水可燃”,“洧水”完全燃烧的产物只有 和 和 |
C.“曾青涂铁,铁赤如铜”,涉及的反应能证明氧化性: |
| D.“有硒水者,剪银塊投之,则旋而为水”,“硒水”在实验室中保存在无色瓶中 |
您最近一年使用:0次
解题方法
2 . 以碲铜废料(主要含 )为原料回收碲单质的一种工艺流程如下:
)为原料回收碲单质的一种工艺流程如下: 和二元弱酸
和二元弱酸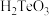
②
下列说法错误的是
 )为原料回收碲单质的一种工艺流程如下:
)为原料回收碲单质的一种工艺流程如下: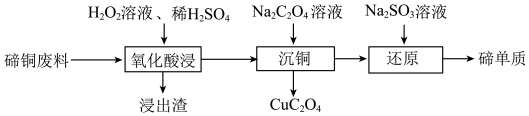
 和二元弱酸
和二元弱酸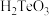
②

下列说法错误的是
A.“氧化酸浸”时, 作氧化剂 作氧化剂 |
B.“沉铜”时,需加过量 |
C.螯合物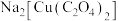 中Cu(Ⅱ)的配位数为4 中Cu(Ⅱ)的配位数为4 |
D.“还原”时,发生的主要反应为 |
您最近一年使用:0次
名校
3 . 利用废电池材料 (含炭黑及少量
(含炭黑及少量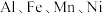 等元素)回收金属资源的工艺流程如下:
等元素)回收金属资源的工艺流程如下: 如下表:
如下表:
②电极电位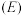 表示溶液中某微粒获得电子被还原的趋势(即氧化性);如电极反应
表示溶液中某微粒获得电子被还原的趋势(即氧化性);如电极反应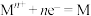 的
的 越大,表示
越大,表示 的氧化性越强。
的氧化性越强。
酸性条件: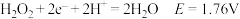 ;
;
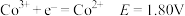
碱性条件: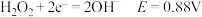 ;
;
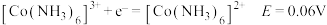
③丁二酮肟是不溶于水的固体,溶于乙醇后可与 反应生成丁二酮肟镍。
反应生成丁二酮肟镍。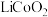 转化后的钴离子价电子排布式为
转化后的钴离子价电子排布式为______ ,滤渣1为______ 。
(2)“氧化调 "中,
"中, 转化为
转化为 ,滤渣2中还有
,滤渣2中还有______ ,调节 范围为
范围为______ 。
(3)“转化”时,加入浓氨水将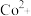 转化为
转化为 的原因是
的原因是______ ,加 目的是
目的是______ 。
(4)“沉镍”后,从滤渣3中回收丁二酮肟固体的操作是______ 。
(5)由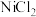 溶液制备催化剂
溶液制备催化剂 的步骤为:第一步加入尿素
的步骤为:第一步加入尿素 生成
生成 沉淀(有
沉淀(有 气体产生),第二步焙烧得到
气体产生),第二步焙烧得到 。写出第一步的离子方程式
。写出第一步的离子方程式______ 。
(6)由 制备得一种锂离子电池材料
制备得一种锂离子电池材料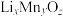 ,其晶胞分别由4个
,其晶胞分别由4个 个
个 立方单元构成。则
立方单元构成。则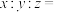
______ 。
 (含炭黑及少量
(含炭黑及少量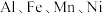 等元素)回收金属资源的工艺流程如下:
等元素)回收金属资源的工艺流程如下:
 如下表:
如下表:氢氧化物 |
|
|
|
|
完全沉淀 | 9.2 | 1.3 | 4.7 | 3.1 |
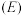 表示溶液中某微粒获得电子被还原的趋势(即氧化性);如电极反应
表示溶液中某微粒获得电子被还原的趋势(即氧化性);如电极反应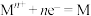 的
的 越大,表示
越大,表示 的氧化性越强。
的氧化性越强。酸性条件:
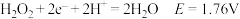 ;
;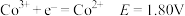
碱性条件:
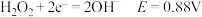 ;
;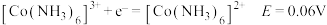
③丁二酮肟是不溶于水的固体,溶于乙醇后可与
 反应生成丁二酮肟镍。
反应生成丁二酮肟镍。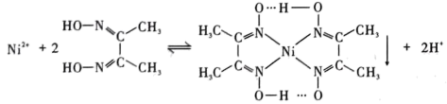
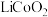 转化后的钴离子价电子排布式为
转化后的钴离子价电子排布式为(2)“氧化调
 "中,
"中, 转化为
转化为 ,滤渣2中还有
,滤渣2中还有 范围为
范围为(3)“转化”时,加入浓氨水将
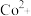 转化为
转化为 的原因是
的原因是 目的是
目的是(4)“沉镍”后,从滤渣3中回收丁二酮肟固体的操作是
(5)由
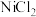 溶液制备催化剂
溶液制备催化剂 的步骤为:第一步加入尿素
的步骤为:第一步加入尿素 生成
生成 沉淀(有
沉淀(有 气体产生),第二步焙烧得到
气体产生),第二步焙烧得到 。写出第一步的离子方程式
。写出第一步的离子方程式(6)由
 制备得一种锂离子电池材料
制备得一种锂离子电池材料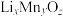 ,其晶胞分别由4个
,其晶胞分别由4个 个
个 立方单元构成。则
立方单元构成。则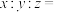

您最近一年使用:0次
7日内更新
|
90次组卷
|
2卷引用:2024届重庆市南开中学校高三下学期5月月考化学试题
4 . 锂电池的研发、使用及废电池的回收具有重要意义。
(1)比能量是指电池单位质量(或体积)输出的电能。锂金属电池放电时总反应为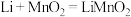 。下列关于锂金属电池说法正确的是
。下列关于锂金属电池说法正确的是___________ (填序号)。
A放电时Li作负极 B.比能量高于锌锰干电池 C.可用稀 作电解质
作电解质
(2)钴酸锂( )、磷酸铁锂(
)、磷酸铁锂( )等锂离子二次电池应用普遍。
)等锂离子二次电池应用普遍。
①钴酸锂电池放电时示意图如图1所示。放电时, 由
由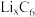 中脱嵌。写出放电至完全时
中脱嵌。写出放电至完全时 电极的电极反应式:
电极的电极反应式:___________ 。 脱嵌形成
脱嵌形成 。
。 晶胞中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构(如图2所示)。x=
晶胞中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构(如图2所示)。x=___________ 。 和NaCl溶液中使电池充分放电是电池回收工艺的首要步骤。电池在不同溶液中放电的残余电压随时间的变化如图3所示。对浸泡液中沉淀物热处理后,得到XRD示意图谱如图4所示。
和NaCl溶液中使电池充分放电是电池回收工艺的首要步骤。电池在不同溶液中放电的残余电压随时间的变化如图3所示。对浸泡液中沉淀物热处理后,得到XRD示意图谱如图4所示。___________ 。
②与 溶液相比,NaCl溶液的质量分数由5%增大至10%时,电池残余电压降低速率更快。依据图4XRD图谱,分析其主要原因:
溶液相比,NaCl溶液的质量分数由5%增大至10%时,电池残余电压降低速率更快。依据图4XRD图谱,分析其主要原因:___________ 。
(4)将放电完全的钴酸锂电池正极材料粉碎后进行酸浸处理。实验测得,在相同条件下,使用盐酸作浸取剂可使钴转化为 ,转化率达到99%,但工业生产使用
,转化率达到99%,但工业生产使用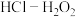 混合物作浸取剂。
混合物作浸取剂。
①写出盐酸作浸取剂发生酸浸反应的化学反应方程式:___________ 。
②工业生产时在盐酸中加入 ,
, 的作用是
的作用是___________ 。
(1)比能量是指电池单位质量(或体积)输出的电能。锂金属电池放电时总反应为
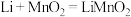 。下列关于锂金属电池说法正确的是
。下列关于锂金属电池说法正确的是A放电时Li作负极 B.比能量高于锌锰干电池 C.可用稀
 作电解质
作电解质(2)钴酸锂(
 )、磷酸铁锂(
)、磷酸铁锂( )等锂离子二次电池应用普遍。
)等锂离子二次电池应用普遍。①钴酸锂电池放电时示意图如图1所示。放电时,
 由
由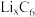 中脱嵌。写出放电至完全时
中脱嵌。写出放电至完全时 电极的电极反应式:
电极的电极反应式: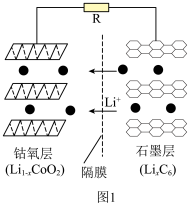
 脱嵌形成
脱嵌形成 。
。 晶胞中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构(如图2所示)。x=
晶胞中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构(如图2所示)。x=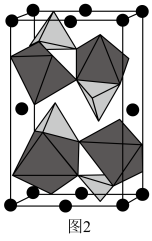
 和NaCl溶液中使电池充分放电是电池回收工艺的首要步骤。电池在不同溶液中放电的残余电压随时间的变化如图3所示。对浸泡液中沉淀物热处理后,得到XRD示意图谱如图4所示。
和NaCl溶液中使电池充分放电是电池回收工艺的首要步骤。电池在不同溶液中放电的残余电压随时间的变化如图3所示。对浸泡液中沉淀物热处理后,得到XRD示意图谱如图4所示。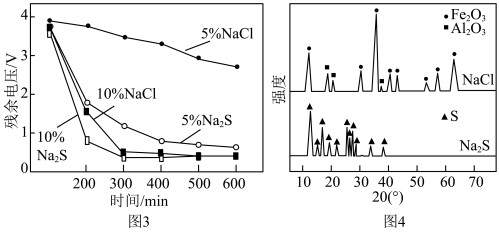
②与
 溶液相比,NaCl溶液的质量分数由5%增大至10%时,电池残余电压降低速率更快。依据图4XRD图谱,分析其主要原因:
溶液相比,NaCl溶液的质量分数由5%增大至10%时,电池残余电压降低速率更快。依据图4XRD图谱,分析其主要原因:(4)将放电完全的钴酸锂电池正极材料粉碎后进行酸浸处理。实验测得,在相同条件下,使用盐酸作浸取剂可使钴转化为
 ,转化率达到99%,但工业生产使用
,转化率达到99%,但工业生产使用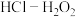 混合物作浸取剂。
混合物作浸取剂。①写出盐酸作浸取剂发生酸浸反应的化学反应方程式:
②工业生产时在盐酸中加入
 ,
, 的作用是
的作用是
您最近一年使用:0次
5 .  在催化剂中
在催化剂中 元素的作用下可以产生具有极强氧化活性的
元素的作用下可以产生具有极强氧化活性的 ,其在固态催化剂表面转化过程如图所示。
,其在固态催化剂表面转化过程如图所示。
 在催化剂中
在催化剂中 元素的作用下可以产生具有极强氧化活性的
元素的作用下可以产生具有极强氧化活性的 ,其在固态催化剂表面转化过程如图所示。
,其在固态催化剂表面转化过程如图所示。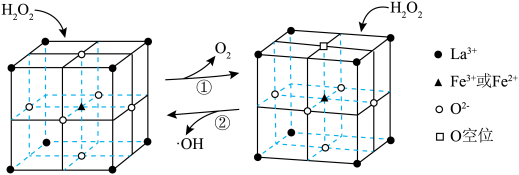
A.过程①中每转移 电子,晶胞中产生 电子,晶胞中产生 空位 空位 |
B.过程②中 在 在 空位产生 空位产生 |
C.催化过程中 的配位数不变 的配位数不变 |
D.相同条件下,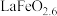 比 比 催化效果好 催化效果好 |
您最近一年使用:0次
名校
6 . 资料显示银镜用稀硝酸或 溶液清洗均可,某研究小组探究如下。
溶液清洗均可,某研究小组探究如下。
实验所用试剂: 溶液,
溶液, 溶液(向
溶液(向 溶液中加入
溶液中加入 至饱和),饱和碘水,
至饱和),饱和碘水,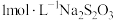 溶液。已知:
溶液。已知: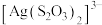 在水溶液中无色。下列说法错误的是
在水溶液中无色。下列说法错误的是
 溶液清洗均可,某研究小组探究如下。
溶液清洗均可,某研究小组探究如下。实验所用试剂:
 溶液,
溶液, 溶液(向
溶液(向 溶液中加入
溶液中加入 至饱和),饱和碘水,
至饱和),饱和碘水,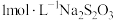 溶液。已知:
溶液。已知: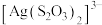 在水溶液中无色。下列说法错误的是
在水溶液中无色。下列说法错误的是
A.黄色固体为 |
B.①②实验银镜溶解速度对比说明发生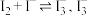 氧化性与 氧化性与 相近但溶解性更好 相近但溶解性更好 |
| C.由实验可知任一氧化剂和碘化钾的混合环境均可溶解银镜 |
D.可向①中试管底部黄色固体加入 溶液验证银镜是否溶解完全,相应的离子方程式为: 溶液验证银镜是否溶解完全,相应的离子方程式为: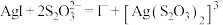 |
您最近一年使用:0次
解题方法
7 . 近日,清华大学某课题组报道了一种在碳纳米管上负载金属钴酞菁的分子催化剂(CoPc/CNT),实现了一步电化学乙烯( )制备乙二醇(EG),其可能反应机理如图所示:
)制备乙二醇(EG),其可能反应机理如图所示:
 )制备乙二醇(EG),其可能反应机理如图所示:
)制备乙二醇(EG),其可能反应机理如图所示: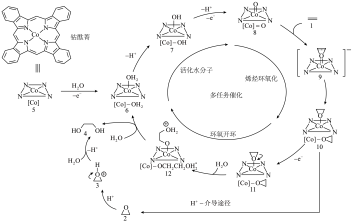
已知: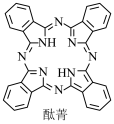 为平面形分子。
为平面形分子。
A.酞菁分子中氮原子的杂化类型为 、 、 |
| B.步骤“5→6”中钴元素被还原 |
| C.上述反应过程中没有极性键的形成 |
D.步骤“2→3→4”的总反应为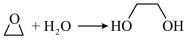 |
您最近一年使用:0次
8 . 稍过量零价铁与亚硫酸钠体系能有效降解废水中有机污染物活性红。
已知:
ⅰ.体系中产生的 、
、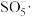 和
和 可将活性红氧化,其中
可将活性红氧化,其中 具有强氧化性
具有强氧化性
ⅱ.

ⅲ. 开始沉淀时pH=6.3,完全沉淀时pH=8.3
开始沉淀时pH=6.3,完全沉淀时pH=8.3
 开始沉淀时pH=1.5,完全沉淀时pH=2.8
开始沉淀时pH=1.5,完全沉淀时pH=2.8 体系中各含硫粒子的物质的量分数与pH的关系
体系中各含硫粒子的物质的量分数与pH的关系
下列说法不正确 的是
已知:
ⅰ.体系中产生的
 、
、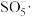 和
和 可将活性红氧化,其中
可将活性红氧化,其中 具有强氧化性
具有强氧化性ⅱ.


ⅲ.
 开始沉淀时pH=6.3,完全沉淀时pH=8.3
开始沉淀时pH=6.3,完全沉淀时pH=8.3 开始沉淀时pH=1.5,完全沉淀时pH=2.8
开始沉淀时pH=1.5,完全沉淀时pH=2.8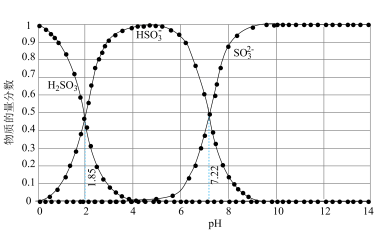
 体系中各含硫粒子的物质的量分数与pH的关系
体系中各含硫粒子的物质的量分数与pH的关系 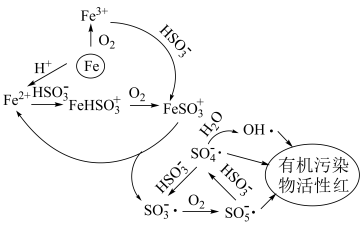
下列说法
A.由图1,25℃时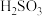 的 的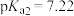 |
| B.pH=4时较pH=8时具有更好的降解效果 |
C.反应一段时间后零价铁表面产生 ,投入 ,投入 可消除 可消除 |
| D.用等物质的量的硫酸亚铁代替零价铁可提高有机物的降解率 |
您最近一年使用:0次
名校
9 . 标准电极电位指离子有效浓度为1mol/L时相对标准氢电极的电极电位差值,电对的标准电极电势 越高,其电对中氧化剂的氧化性越强。酸性介质中,以下电对的标准电极电势为:①
越高,其电对中氧化剂的氧化性越强。酸性介质中,以下电对的标准电极电势为:①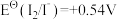 ;②
;②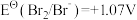 ;③
;③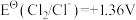 ;④
;④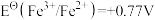 ;⑤
;⑤ ;⑥
;⑥ 。下列有关说法正确的是
。下列有关说法正确的是
 越高,其电对中氧化剂的氧化性越强。酸性介质中,以下电对的标准电极电势为:①
越高,其电对中氧化剂的氧化性越强。酸性介质中,以下电对的标准电极电势为:①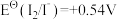 ;②
;②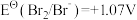 ;③
;③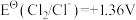 ;④
;④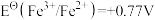 ;⑤
;⑤ ;⑥
;⑥ 。下列有关说法正确的是
。下列有关说法正确的是A.向1mol/L的HBr溶液中滴加 溶液,无明显现象发生 溶液,无明显现象发生 |
B.2mol/L的 与2mol/L的稀盐酸等体积混合有大量 与2mol/L的稀盐酸等体积混合有大量 产生 产生 |
C.在含 、 、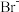 、 、 的混合溶液中若仅氧化 的混合溶液中若仅氧化 ,最佳的氧化剂是 ,最佳的氧化剂是 |
D.浓度相等时,还原性: |
您最近一年使用:0次
解题方法
10 . 斑铜矿(主要成分是Cu5FeS4,含少量SiO2)是自然界中最丰富的含铜矿物之一,以斑铜矿为原料可实现如下转化。
②Cu+酸性条件发生自身氧化还原反应生成Cu2+和Cu。
③ 加热时易失去NH3。
加热时易失去NH3。
请回答:
(1)①溶液A中加试剂X可实现FeCl3的循环利用,则试剂X是_______ 。
②固体C可通过溶解、过滤、蒸馏等操作分离出硫单质,溶解时最适宜的溶剂为_______ 。
A.水 B.NaOH溶液 C.CS2 D.酒精
(2)步骤Ⅱ需快速将固体B投入到NaCl溶液中,原因是_______ 。
(3)写出溶液D中的所有阳离子_______ 。
(4)写出反应I的离子方程式_______ 。
(5)将斑铜矿在有氧条件下用氨水浸出,可制得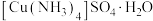 晶体,反应原理为
晶体,反应原理为 (未配平)。设计由浸出液制取
(未配平)。设计由浸出液制取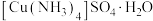 晶体的实验方案:
晶体的实验方案:_______ 。

②Cu+酸性条件发生自身氧化还原反应生成Cu2+和Cu。
③
 加热时易失去NH3。
加热时易失去NH3。请回答:
(1)①溶液A中加试剂X可实现FeCl3的循环利用,则试剂X是
②固体C可通过溶解、过滤、蒸馏等操作分离出硫单质,溶解时最适宜的溶剂为
A.水 B.NaOH溶液 C.CS2 D.酒精
(2)步骤Ⅱ需快速将固体B投入到NaCl溶液中,原因是
(3)写出溶液D中的所有阳离子
(4)写出反应I的离子方程式
(5)将斑铜矿在有氧条件下用氨水浸出,可制得
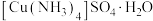 晶体,反应原理为
晶体,反应原理为 (未配平)。设计由浸出液制取
(未配平)。设计由浸出液制取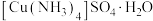 晶体的实验方案:
晶体的实验方案:
您最近一年使用:0次







