1 . 天然气在实现“双碳”目标进程中发挥着重要的作用,成为能源低碳转型的首选能源之一。
(1)开采出的天然气中含有 ,
, 会直接影响化工合成,并产生污染。T∙F菌在酸性溶液中可实现天然气的催化脱硫,其原理如图1所示。
会直接影响化工合成,并产生污染。T∙F菌在酸性溶液中可实现天然气的催化脱硫,其原理如图1所示。______ 。
②根据反应机理图可知 、S、
、S、 三种物质在酸性条件下氧化性强弱顺序为
三种物质在酸性条件下氧化性强弱顺序为______ 。
(2)甲烷重整制氢工艺与太阳能相结合可有效降低碳排放,一种利用太阳能催化甲烷蒸气重整制氢的反应原理如图2所示。 ,第Ⅱ步反应生成1mol
,第Ⅱ步反应生成1mol  的焓变为
的焓变为 ,利用太阳能催化甲烷蒸气重整制氢反应的热化学方程式为
,利用太阳能催化甲烷蒸气重整制氢反应的热化学方程式为_______ (用 、
、 表示)。
表示)。
②第Ⅰ、Ⅱ步反应的 随温度的变化如图3所示,升高温度,第Ⅱ步反应平衡
随温度的变化如图3所示,升高温度,第Ⅱ步反应平衡______ (填“向左”“向右”或“不”)移动。
_____ 。
(3) 超干重整
超干重整 可催化生产合成气:
可催化生产合成气:
 。在体积为2L的恒容密闭容器中,充入2mol
。在体积为2L的恒容密闭容器中,充入2mol  和3mol
和3mol  ,加入催化剂并加热至
,加入催化剂并加热至 发生反应,容器内的总压强
发生反应,容器内的总压强 随时间t的变化如图4所示。
随时间t的变化如图4所示。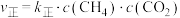 ,
,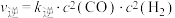 ,其中
,其中 、
、 为仅与温度有关的速率常数,平衡后若将温度由
为仅与温度有关的速率常数,平衡后若将温度由 升高到
升高到 ,则速率常数增大的倍数:
,则速率常数增大的倍数:
_____  (填“<”“>”或“=”)。
(填“<”“>”或“=”)。
②0~10min用 表示的平均反应速率为
表示的平均反应速率为______  。
。
(1)开采出的天然气中含有
 ,
, 会直接影响化工合成,并产生污染。T∙F菌在酸性溶液中可实现天然气的催化脱硫,其原理如图1所示。
会直接影响化工合成,并产生污染。T∙F菌在酸性溶液中可实现天然气的催化脱硫,其原理如图1所示。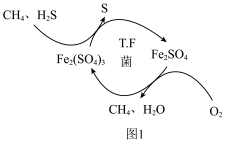
②根据反应机理图可知
 、S、
、S、 三种物质在酸性条件下氧化性强弱顺序为
三种物质在酸性条件下氧化性强弱顺序为(2)甲烷重整制氢工艺与太阳能相结合可有效降低碳排放,一种利用太阳能催化甲烷蒸气重整制氢的反应原理如图2所示。
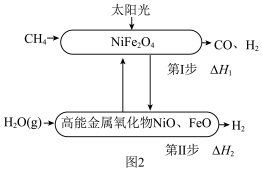
 ,第Ⅱ步反应生成1mol
,第Ⅱ步反应生成1mol  的焓变为
的焓变为 ,利用太阳能催化甲烷蒸气重整制氢反应的热化学方程式为
,利用太阳能催化甲烷蒸气重整制氢反应的热化学方程式为 、
、 表示)。
表示)。②第Ⅰ、Ⅱ步反应的
 随温度的变化如图3所示,升高温度,第Ⅱ步反应平衡
随温度的变化如图3所示,升高温度,第Ⅱ步反应平衡

(3)
 超干重整
超干重整 可催化生产合成气:
可催化生产合成气:
 。在体积为2L的恒容密闭容器中,充入2mol
。在体积为2L的恒容密闭容器中,充入2mol  和3mol
和3mol  ,加入催化剂并加热至
,加入催化剂并加热至 发生反应,容器内的总压强
发生反应,容器内的总压强 随时间t的变化如图4所示。
随时间t的变化如图4所示。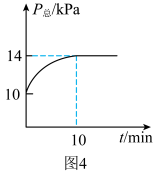
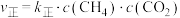 ,
,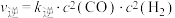 ,其中
,其中 、
、 为仅与温度有关的速率常数,平衡后若将温度由
为仅与温度有关的速率常数,平衡后若将温度由 升高到
升高到 ,则速率常数增大的倍数:
,则速率常数增大的倍数:
 (填“<”“>”或“=”)。
(填“<”“>”或“=”)。②0~10min用
 表示的平均反应速率为
表示的平均反应速率为 。
。
您最近一年使用:0次
名校
2 . 某兴趣小组探究高锰酸钾和氨水的反应,实验如下:
注:实验中c(KMnO4) = 0.01 mol·L-1。
下列说法不正确 的是
| 序号 | 试剂 | 实验现象 |
| ① | 2 mL KMnO4溶液 + 1 mL 10 mol·L-1氨水+0.5 mL蒸馏水 | 溶液完全褪色所需时间:③<②<①。实验均产生棕褐色固体(经检验为MnO2),都伴有少量气泡产生(经检验为N2)。 |
| ② | 2 mL KMnO4溶液 + 1 mL 10 mol·L-1氨水 + 0.5 mL 1 mol·L-1稀硫酸 | |
| ③ | 2 mL KMnO4溶液 + 1 mL 10 mol·L-1氨水 + 0.5 mL 1 mol·L-1 Na2SO4溶液 | |
| ④ | 2 mL KMnO4溶液 + 1 mL 5 mol·L-1 (NH4)2SO4溶液 + 0.5 mL蒸馏水 | 无明显变化 |
下列说法
A.实验①中发生了反应2 MnO + 2NH3 = 2MnO2 + N2↑ + 2OH- + 2H2O + 2NH3 = 2MnO2 + N2↑ + 2OH- + 2H2O |
B.溶液完全褪色所需时间② < ①的主要原因:c(H+)增大,MnO 的氧化性增强 的氧化性增强 |
C.对比实验③④可得出,还原性:NH3 > NH |
| D.在实验④的试剂中,逐滴加入浓NaOH溶液,可观察到溶液褪色 |
您最近一年使用:0次
2024-04-01更新
|
639次组卷
|
5卷引用:江西省宜春市宜丰中学2023-2024学年高一下学期4月期中考试化学试题
江西省宜春市宜丰中学2023-2024学年高一下学期4月期中考试化学试题北京市丰台区2023-2024学年高三下学期综合练习(一)化学试题(已下线)通关练03 常考化学实验基础知识-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)北京市北京师范大学燕化附属中学2023-2024学年高一下学期期中考试化学试卷 山东省潍坊一中2023-2024学年高一下学期期中模拟检测化学试题
名校
3 . 用 溶液与
溶液与 (
( 元素为-1价)溶液反应制备纳米零价铁的化学方程式为
元素为-1价)溶液反应制备纳米零价铁的化学方程式为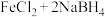
 。下列有关说法正确的是
。下列有关说法正确的是
 溶液与
溶液与 (
( 元素为-1价)溶液反应制备纳米零价铁的化学方程式为
元素为-1价)溶液反应制备纳米零价铁的化学方程式为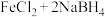
 。下列有关说法正确的是
。下列有关说法正确的是A. 与 与 均属于副族元素 均属于副族元素 | B.若生成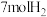 ,其中 ,其中 是氧化产物 是氧化产物 |
C. 是还原剂 是还原剂 | D.每生成 转移 转移 电子 电子 |
您最近一年使用:0次
4 .  下,某反应体系只存在如下8种物质:
下,某反应体系只存在如下8种物质: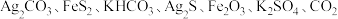 和
和 ,其中,甲既是氧化剂,又是还原剂,乙是还原产物,丙和丁是氧化产物,甲、乙、丙、丁四种物质的物质的量
,其中,甲既是氧化剂,又是还原剂,乙是还原产物,丙和丁是氧化产物,甲、乙、丙、丁四种物质的物质的量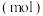 与时间关系如图所示。设
与时间关系如图所示。设 为阿伏加德罗常数的值。下列叙述正确的是
为阿伏加德罗常数的值。下列叙述正确的是
 下,某反应体系只存在如下8种物质:
下,某反应体系只存在如下8种物质: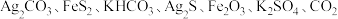 和
和 ,其中,甲既是氧化剂,又是还原剂,乙是还原产物,丙和丁是氧化产物,甲、乙、丙、丁四种物质的物质的量
,其中,甲既是氧化剂,又是还原剂,乙是还原产物,丙和丁是氧化产物,甲、乙、丙、丁四种物质的物质的量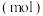 与时间关系如图所示。设
与时间关系如图所示。设 为阿伏加德罗常数的值。下列叙述正确的是
为阿伏加德罗常数的值。下列叙述正确的是
A.甲代表 ,丁为碱性氧化物 ,丁为碱性氧化物 |
B.还原产物、氧化产物的物质的量之比 |
C. 甲完全反应转移电子数为 甲完全反应转移电子数为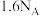 |
D.在该反应中,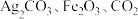 的化学计量数之比为 的化学计量数之比为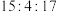 |
您最近一年使用:0次
5 . 某小组拟探究氯气的性质,设计如图实验(尾气处理装置略)。下列叙述错误的是
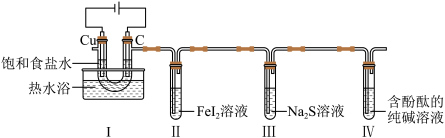
A.Ⅰ中逸出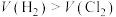 的原因是部分 的原因是部分 与碱、水反应及溶液中的 与碱、水反应及溶液中的 被氧化 被氧化 |
B.用 、KSCN溶液可确认Ⅱ中 、KSCN溶液可确认Ⅱ中 是否被氧化 是否被氧化 |
| C.Ⅲ中溶液变浑浊,则说明氯的非金属性比硫的强 |
D.Ⅳ中溶液由红色变为无色,说明 有漂白性 有漂白性 |
您最近一年使用:0次
名校
解题方法
6 . Ⅰ.如图为铁及其化合物的“价—类”二维图。

(1)填写二维图中缺失的类别①________ 和化学式②___________ 。
(2)从物质类别上看, 属于盐,可能与
属于盐,可能与_______ 发生反应(填序号);
从化合价角度看,体现 氧化性,可能与
氧化性,可能与______ 反应(填序号)。
① ②KI溶液 ③NaOH溶液 ④
②KI溶液 ③NaOH溶液 ④ 溶液 ⑤
溶液 ⑤ 溶液
溶液
Ⅱ.某工厂用 溶液腐蚀镀有铜的绝缘板生产印刷电路,一种从腐蚀废液回收金属铜并获得氯化铁晶体的工艺流程如图。请根据流程,回答下列问题。(提示:为充分除去杂质,所加试剂均为过量)
溶液腐蚀镀有铜的绝缘板生产印刷电路,一种从腐蚀废液回收金属铜并获得氯化铁晶体的工艺流程如图。请根据流程,回答下列问题。(提示:为充分除去杂质,所加试剂均为过量)
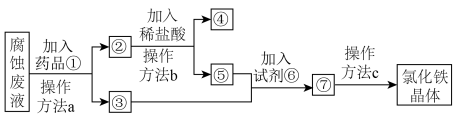
(3)腐蚀废液中加入药品①后,发生反应的离子方程式为___________ 。
(4)④代表的物质是___________ (用化学式表示)。
(5)操作方法a、b、c中是过滤的是________ (填序号)。
(6)若取2 mL溶液⑤加入试管中,然后滴加氢氧化钠溶液,产生白色沉淀,_________ (补全现象),此过程设计氧化还原反应的方程式为________ 。
(7)工业中常用高铁酸钾( )作为高效、多功能的自来水处理剂。湿法制备高铁酸钾的反应体系中有六种微粒:
)作为高效、多功能的自来水处理剂。湿法制备高铁酸钾的反应体系中有六种微粒: 、
、 、
、 、
、 、
、 、
、 。写出并配平湿法制高铁酸钾的离子反应方程式:
。写出并配平湿法制高铁酸钾的离子反应方程式:___________ 。

(1)填写二维图中缺失的类别①
(2)从物质类别上看,
 属于盐,可能与
属于盐,可能与从化合价角度看,体现
 氧化性,可能与
氧化性,可能与①
 ②KI溶液 ③NaOH溶液 ④
②KI溶液 ③NaOH溶液 ④ 溶液 ⑤
溶液 ⑤ 溶液
溶液Ⅱ.某工厂用
 溶液腐蚀镀有铜的绝缘板生产印刷电路,一种从腐蚀废液回收金属铜并获得氯化铁晶体的工艺流程如图。请根据流程,回答下列问题。(提示:为充分除去杂质,所加试剂均为过量)
溶液腐蚀镀有铜的绝缘板生产印刷电路,一种从腐蚀废液回收金属铜并获得氯化铁晶体的工艺流程如图。请根据流程,回答下列问题。(提示:为充分除去杂质,所加试剂均为过量)
(3)腐蚀废液中加入药品①后,发生反应的离子方程式为
(4)④代表的物质是
(5)操作方法a、b、c中是过滤的是
(6)若取2 mL溶液⑤加入试管中,然后滴加氢氧化钠溶液,产生白色沉淀,
(7)工业中常用高铁酸钾(
 )作为高效、多功能的自来水处理剂。湿法制备高铁酸钾的反应体系中有六种微粒:
)作为高效、多功能的自来水处理剂。湿法制备高铁酸钾的反应体系中有六种微粒: 、
、 、
、 、
、 、
、 、
、 。写出并配平湿法制高铁酸钾的离子反应方程式:
。写出并配平湿法制高铁酸钾的离子反应方程式:
您最近一年使用:0次
2024-02-12更新
|
120次组卷
|
2卷引用:江西省宜春市宜丰中学2023-2024学年高一上学期1月月考化学试题
7 . 实验中常用离子反应:2Mn2++5NaBiO3+14H+=2MnO2+5Bi2++5Na++7H2O来检验Mn2+。下列叙述错误的是
| A.钠盐不一定易溶于水 | B.还原性:Mn2+>Bi3+ |
| C.生成1molNa+转移5mol电子 | D.氧化产物与氧化剂的物质的量之比为2:5 |
您最近一年使用:0次
8 . 杭州亚运会零碳甲醇(CH3OH)点燃火炬惊艳世界。推广甲醇是实现碳中和目标的重要途径。下列说法错误的是
| A. CH3OH属于非电解质 |
| B.1mol CH3OH完全燃烧生成CO2和H2O,转移6mol e- |
| C.CH3OH燃烧时,甲醇是氧化剂,CO2是还原产物 |
| D.CH3OH燃烧产生的CO2可以和H2通过热催化合成甲醇,该过程中CO2被还原 |
您最近一年使用:0次
2023-12-05更新
|
119次组卷
|
3卷引用:江西省上饶市婺源天佑中学2023-2024学年高一上学期12月考试化学试题
名校
9 . 重金属对水资源的污染性极大。电镀废水中的铬主要以 为+6价
为+6价 的形式存在。可采用以下方案除去电镀废水中的
的形式存在。可采用以下方案除去电镀废水中的 。
。

使用不同的还原剂[可选用 (300元/吨)、
(300元/吨)、 (2100元/吨)](其中
(2100元/吨)](其中 被还原为+3价),除铬率随
被还原为+3价),除铬率随 的变化如图所示。
的变化如图所示。

回答下列问题:
(1)“还原”步骤中,若使用 和
和 作还原剂,其氧化产物分别是
作还原剂,其氧化产物分别是______ 、______ (填字母)。
a. b.
b. c.
c. d.
d.
(2)配平下列反应物的化学计量数:______ 。
_____ +_____
+_____ =_____
=_____ +_____
+_____
相同质量的两种还原剂,______ 转移的电子数更多。
(3)当溶液中存在大量 时,使用
时,使用 还原
还原 的离子方程式为
的离子方程式为______ 。
(4)综合考虑工业成本,工业上更适合采用______ 作为还原剂进行除铬。
(5)已知 (可写成
(可写成 )是一种最简单的铁氧体,煅烧得到的金属氢氧化物沉淀可得到铁氧体,其组成可表示为
)是一种最简单的铁氧体,煅烧得到的金属氢氧化物沉淀可得到铁氧体,其组成可表示为 ,其中
,其中 为+3价,则该铁氧体中
为+3价,则该铁氧体中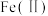 与
与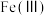 的个数之比为
的个数之比为______ ,该铁氧体写成金属氧化物的形式可表示为______ (氧化物系数化为最简整数)。
 为+6价
为+6价 的形式存在。可采用以下方案除去电镀废水中的
的形式存在。可采用以下方案除去电镀废水中的 。
。
使用不同的还原剂[可选用
 (300元/吨)、
(300元/吨)、 (2100元/吨)](其中
(2100元/吨)](其中 被还原为+3价),除铬率随
被还原为+3价),除铬率随 的变化如图所示。
的变化如图所示。
回答下列问题:
(1)“还原”步骤中,若使用
 和
和 作还原剂,其氧化产物分别是
作还原剂,其氧化产物分别是a.
 b.
b. c.
c. d.
d.
(2)配平下列反应物的化学计量数:
_____
 +_____
+_____ =_____
=_____ +_____
+_____
相同质量的两种还原剂,
(3)当溶液中存在大量
 时,使用
时,使用 还原
还原 的离子方程式为
的离子方程式为(4)综合考虑工业成本,工业上更适合采用
(5)已知
 (可写成
(可写成 )是一种最简单的铁氧体,煅烧得到的金属氢氧化物沉淀可得到铁氧体,其组成可表示为
)是一种最简单的铁氧体,煅烧得到的金属氢氧化物沉淀可得到铁氧体,其组成可表示为 ,其中
,其中 为+3价,则该铁氧体中
为+3价,则该铁氧体中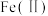 与
与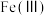 的个数之比为
的个数之比为
您最近一年使用:0次
2023-12-02更新
|
116次组卷
|
3卷引用:江西省鹰潭市2023-2024学年高一上学期11月期中化学试题
10 . 氯元素的价类二维图如图所示,下列说法正确的是
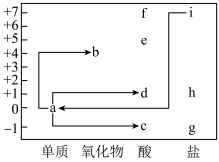

A.i的分子式为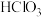 |
B.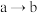 :需加入氧化剂 :需加入氧化剂 |
C.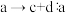 既是氧化剂又是还原剂, 既是氧化剂又是还原剂, 为氧化产物 为氧化产物 |
| D.d在光照条件下发生分解反应可得到a |
您最近一年使用:0次
2023-12-02更新
|
239次组卷
|
3卷引用:江西省鹰潭市2023-2024学年高一上学期11月期中化学试题
江西省鹰潭市2023-2024学年高一上学期11月期中化学试题江西省部分学校2023-2024学年高一上学期11月期中考试化学试题(已下线)寒假作业05 氯及其化合物-【寒假分层作业】2024年高一化学寒假培优练(人教版2019必修第一册)



