1 . Na2SO3固体在隔绝空气强热过程中质量不变。待固体冷却后溶于水,溶液的碱性比Na2SO3 溶液强,所得固体成分可能是
| A.Na2S Na2O Na2SO3 | B.Na2SO4 Na2O Na2SO3 |
| C.Na2O Na2S Na2SO4 | D.Na2S Na2SO4 Na2SO3 |
您最近一年使用:0次
名校
解题方法
2 . 我国某研究团队利用电解法处理富营养化河水的机理如图,下列说法正确的是
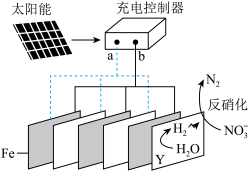

A. 极为电子流出极, 极为电子流出极, 极为电子流入极 极为电子流入极 |
B. 极发生的反应为 极发生的反应为 |
C.一段时间后,该河水的 增大 增大 |
D.反硝化过程中,还原剂与还原产物的物质的量之比为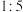 |
您最近一年使用:0次
3 . 锰及其化合物在工业生产中具有重要用途。某兴趣小组用软锰矿(主要成分是 ,含少量
,含少量 、
、 )和黄铁矿(主要成分是
)和黄铁矿(主要成分是 ,含少量)为原料制备
,含少量)为原料制备 ,实验流程如下:
,实验流程如下: 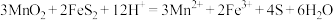
(1)与稀硫酸反应前,将黄铁矿和软锰矿混合研磨的目的是_______ 。
(2)离子反应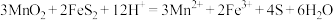 中,被氧化的元素是
中,被氧化的元素是_______ 和_______ 。
(3)步骤(Ⅰ)中分离溶液和沉淀的操作名称是_______ ,所需要的玻璃仪器除烧杯和玻璃棒外,还需要_______ 。
(4)步骤(Ⅱ)中加入NaOH溶液调节pH,是为了完全沉淀 、
、 ,写出生成
,写出生成 沉淀的离子方程式:
沉淀的离子方程式:_______ 。
(5)将步骤(Ⅲ)中发生反应的离子方程式补充完整:______ 。
 _______
_______
 ,含少量
,含少量 、
、 )和黄铁矿(主要成分是
)和黄铁矿(主要成分是 ,含少量)为原料制备
,含少量)为原料制备 ,实验流程如下:
,实验流程如下: 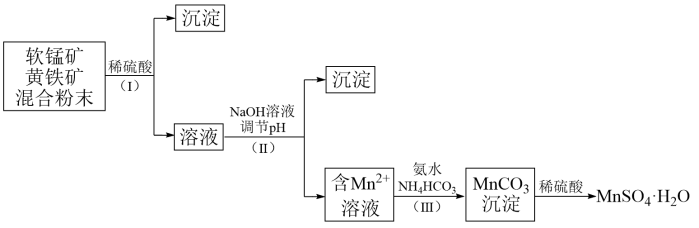
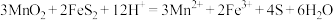
(1)与稀硫酸反应前,将黄铁矿和软锰矿混合研磨的目的是
(2)离子反应
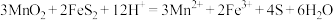 中,被氧化的元素是
中,被氧化的元素是(3)步骤(Ⅰ)中分离溶液和沉淀的操作名称是
(4)步骤(Ⅱ)中加入NaOH溶液调节pH,是为了完全沉淀
 、
、 ,写出生成
,写出生成 沉淀的离子方程式:
沉淀的离子方程式:(5)将步骤(Ⅲ)中发生反应的离子方程式补充完整:
 _______
_______
您最近一年使用:0次
2024-03-29更新
|
122次组卷
|
2卷引用:2023年6月福建省普通高中学业水平合格性考试化学试题
名校
解题方法
4 . 从宏观现象探究微观本质是重要的化学学科素养。为研究FeCl3溶液的性质,某小组同学进行了如下探究实验。
Ⅰ.配制FeCl3溶液
(1)先将FeCl3固体溶于浓盐酸,再稀释至指定浓度。浓盐酸的作用是______ 。
Ⅱ.FeCl3溶液与Na2CO3溶液反应
(2)向2mL1mol/L的Na2CO3溶液中加入2mL1mol/LFeCl3溶液,产生了红褐色沉淀和无色气体。反应的离子方程式为______ 。
Ⅲ.FeCl3溶液与Na2S溶液反应
(3)甲同学认为Fe3+和S2-的水解平衡相互促进并完全水解,实验中会观察到红褐色沉淀并闻到臭鸡蛋气味;乙同学认为会发生氧化还原反应,并预测还原产物为______ (填化学式)。两位同学实验如下:
(4)两位同学猜测实验a中的黑色沉淀可能是Fe2S3。继续实验:
根据实验b说明黑色沉淀是Fe2S3,写出实验b中Fe2S3与盐酸反应的化学方程式:______ 。
(5)①实验a中生成黑色沉淀Fe2S3的离子方程式为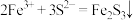 。该反应类型从四种基本反应类型看属于
。该反应类型从四种基本反应类型看属于______ 。
②实验a中Fe2S3溶解时生成的黄色固体为______ ,乙同学推测是因为随着FeCl3溶液滴加至一定量, 浓度增大,其氧化性增强,将Fe2S3氧化所致。
浓度增大,其氧化性增强,将Fe2S3氧化所致。
(6)已知: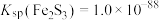 ,
,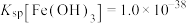 。针对实验a过程中未观察到红褐色沉淀,甲同学认为可能是产生的量比较少,被黑色所遮盖。乙同学根据
。针对实验a过程中未观察到红褐色沉淀,甲同学认为可能是产生的量比较少,被黑色所遮盖。乙同学根据 数据计算认为就算产生红褐色沉淀,也会转化为黑色沉淀,写出该转化过程的离子方程式:
数据计算认为就算产生红褐色沉淀,也会转化为黑色沉淀,写出该转化过程的离子方程式:______ 。
Ⅰ.配制FeCl3溶液
(1)先将FeCl3固体溶于浓盐酸,再稀释至指定浓度。浓盐酸的作用是
Ⅱ.FeCl3溶液与Na2CO3溶液反应
(2)向2mL1mol/L的Na2CO3溶液中加入2mL1mol/LFeCl3溶液,产生了红褐色沉淀和无色气体。反应的离子方程式为
Ⅲ.FeCl3溶液与Na2S溶液反应
(3)甲同学认为Fe3+和S2-的水解平衡相互促进并完全水解,实验中会观察到红褐色沉淀并闻到臭鸡蛋气味;乙同学认为会发生氧化还原反应,并预测还原产物为
| 实验a | 向稀Na2S溶液中逐滴加入FeCl3稀溶液,直至过量 |
| 实验现象 | 立即产生黑色沉淀并逐渐增加,无臭鸡蛋气味;FeCl3溶液过量后,黑色沉淀部分溶解,出现黄色沉淀 |
| 实验b | 将实验a中黑色沉淀过滤,并用CS2处理后洗净。向沉淀中加入6mol/L的盐酸,振荡试管 |
| 实验现象 | 加入盐酸后黑色沉淀溶解,转为乳黄色沉淀,并伴有臭鸡蛋气味 |
(5)①实验a中生成黑色沉淀Fe2S3的离子方程式为
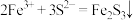 。该反应类型从四种基本反应类型看属于
。该反应类型从四种基本反应类型看属于②实验a中Fe2S3溶解时生成的黄色固体为
 浓度增大,其氧化性增强,将Fe2S3氧化所致。
浓度增大,其氧化性增强,将Fe2S3氧化所致。(6)已知:
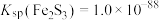 ,
,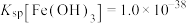 。针对实验a过程中未观察到红褐色沉淀,甲同学认为可能是产生的量比较少,被黑色所遮盖。乙同学根据
。针对实验a过程中未观察到红褐色沉淀,甲同学认为可能是产生的量比较少,被黑色所遮盖。乙同学根据 数据计算认为就算产生红褐色沉淀,也会转化为黑色沉淀,写出该转化过程的离子方程式:
数据计算认为就算产生红褐色沉淀,也会转化为黑色沉淀,写出该转化过程的离子方程式:
您最近一年使用:0次
名校
解题方法
5 . 资料显示, 能还原
能还原 、
、 ,某小组对此进行探究。
,某小组对此进行探究。
实验:将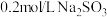 溶液滴入到物质a中,记录如下:
溶液滴入到物质a中,记录如下:
(1)用化学用语解释 溶液呈碱性的原因
溶液呈碱性的原因___________ 。
(2)经检验,I中白色沉淀是 。用酸性
。用酸性 溶液证实白色沉淀中含有
溶液证实白色沉淀中含有 ,现象是
,现象是___________ 。
(3)重新设计实验(III),证实了: 能还原
能还原 ,装置如下图所示。
,装置如下图所示。
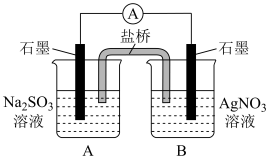
现象:i.电流表指针偏转。
ii.B中石墨电极上析出白色固体。
取出少量白色固体,洗涤后,___________ (填操作和现象),证明白色固体中含有Ag。
(4)经检验,II中的棕黄色沉淀不含 ,含有
,含有 、
、 和
和 。
。
资料: ,
, 。
。
①用稀 溶解沉淀,析出红色固体,说明棕黄色沉淀中含有
溶解沉淀,析出红色固体,说明棕黄色沉淀中含有___________ 。
②通过下列实验证实,沉淀中含有 和上层清液中仍检出了
和上层清液中仍检出了 (忽略空气的影响)。
(忽略空气的影响)。
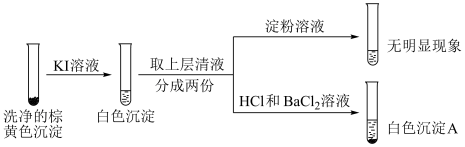
i.白色沉淀A是 。
。
ii.根据资料,上层清液加入淀粉后应该变蓝。分析现象与资料不符的原因:
原因一:KI未被氧化。则将 氧化的微粒是
氧化的微粒是___________ 。
原因二:KI被氧化,由于___________ (用离子方程式表示),所以无明显现象。
③当加入的KI过量且反应充分时,白色沉淀中不含Cu单质,上层清液中仍检出了 。结合物质组成、化学反应等解释上层清液中检出
。结合物质组成、化学反应等解释上层清液中检出 的原因
的原因___________ 。
小结:I中: 未能还原
未能还原 的原因与反应速率、离子浓度变化等因素有关。
的原因与反应速率、离子浓度变化等因素有关。
 能还原
能还原 、
、 ,某小组对此进行探究。
,某小组对此进行探究。实验:将
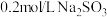 溶液滴入到物质a中,记录如下:
溶液滴入到物质a中,记录如下:| 序号 | 装置 | 物质a | 现象 |
| I | 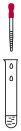 2 mL 物质a | 饱和 溶液 溶液 | 产生白色沉淀 |
| II | 0.2 mol/L  溶液 溶液 | 溶液变绿,继续滴加产生棕黄色沉淀 |
(1)用化学用语解释
 溶液呈碱性的原因
溶液呈碱性的原因(2)经检验,I中白色沉淀是
 。用酸性
。用酸性 溶液证实白色沉淀中含有
溶液证实白色沉淀中含有 ,现象是
,现象是(3)重新设计实验(III),证实了:
 能还原
能还原 ,装置如下图所示。
,装置如下图所示。
现象:i.电流表指针偏转。
ii.B中石墨电极上析出白色固体。
取出少量白色固体,洗涤后,
(4)经检验,II中的棕黄色沉淀不含
 ,含有
,含有 、
、 和
和 。
。资料:
 ,
, 。
。①用稀
 溶解沉淀,析出红色固体,说明棕黄色沉淀中含有
溶解沉淀,析出红色固体,说明棕黄色沉淀中含有②通过下列实验证实,沉淀中含有
 和上层清液中仍检出了
和上层清液中仍检出了 (忽略空气的影响)。
(忽略空气的影响)。
i.白色沉淀A是
 。
。ii.根据资料,上层清液加入淀粉后应该变蓝。分析现象与资料不符的原因:
原因一:KI未被氧化。则将
 氧化的微粒是
氧化的微粒是原因二:KI被氧化,由于
③当加入的KI过量且反应充分时,白色沉淀中不含Cu单质,上层清液中仍检出了
 。结合物质组成、化学反应等解释上层清液中检出
。结合物质组成、化学反应等解释上层清液中检出 的原因
的原因小结:I中:
 未能还原
未能还原 的原因与反应速率、离子浓度变化等因素有关。
的原因与反应速率、离子浓度变化等因素有关。
您最近一年使用:0次
名校
解题方法
6 . 化学与生产生活密切相关。下列说法错误的是
A.饱和 溶液处理锅炉水垢中的 溶液处理锅炉水垢中的 ,发生了沉淀的转化 ,发生了沉淀的转化 |
B.夏天雷雨过后空气清新,是因为放电时 和 和 合成了 合成了 |
C.神舟系列飞船返回舱使用氮化硅耐高温结构材料, 属于共价晶体 属于共价晶体 |
D. 可用于污水脱氯 可用于污水脱氯 ,是由于其具有还原性 ,是由于其具有还原性 |
您最近一年使用:0次
2024-02-24更新
|
146次组卷
|
2卷引用:陕西省西安市蓝田县城关中学大学区联考2023-2024学年高二下学期3月月考化学试题
7 . 为实现“碳中和”和“碳达峰”,科学家设计了低浓度 捕获技术,并实现资源综合利用。其原理如图所示。下列说法不正确的是
捕获技术,并实现资源综合利用。其原理如图所示。下列说法不正确的是
 捕获技术,并实现资源综合利用。其原理如图所示。下列说法不正确的是
捕获技术,并实现资源综合利用。其原理如图所示。下列说法不正确的是
A.反应①的 | B.该技术的关键是在周期表p区寻找合适的催化剂 |
| C.催化剂改变了反应②的活化能 | D.反应②中C元素既被氧化又被还原 |
您最近一年使用:0次
2024-02-14更新
|
205次组卷
|
3卷引用:湖北省恩施州高中教育联盟2023-2024学年高二上学期期末考试化学试题
解题方法
8 . Ⅰ.实验室用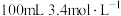 的氢氧化钠溶液吸收多余的氯气。测得吸收后的溶液中
的氢氧化钠溶液吸收多余的氯气。测得吸收后的溶液中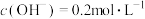 ,
, 和
和 的物质的量浓度之比为
的物质的量浓度之比为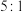 。(不考虑反应前后溶液的体积变化)。
。(不考虑反应前后溶液的体积变化)。
(1)吸收氯气所消耗的氢氧化钠物质的量为__________ 。
(2)被氧化与被还原的氯气的物质的量之比为__________ 。
Ⅱ.无水 与
与 作用会生成
作用会生成 。现有
。现有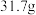 无水
无水 ,吸收
,吸收 后变成
后变成 ,试回答下列问题:
,试回答下列问题:
(3) 中
中
__________ 。
(4) 为配合物,其中
为配合物,其中 的配位数为6,经测定
的配位数为6,经测定 该配合物和足量
该配合物和足量 溶液反应得到
溶液反应得到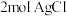 沉淀,则该配合物的化学式可表示为
沉淀,则该配合物的化学式可表示为__________ 。
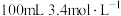 的氢氧化钠溶液吸收多余的氯气。测得吸收后的溶液中
的氢氧化钠溶液吸收多余的氯气。测得吸收后的溶液中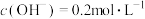 ,
, 和
和 的物质的量浓度之比为
的物质的量浓度之比为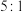 。(不考虑反应前后溶液的体积变化)。
。(不考虑反应前后溶液的体积变化)。(1)吸收氯气所消耗的氢氧化钠物质的量为
(2)被氧化与被还原的氯气的物质的量之比为
Ⅱ.无水
 与
与 作用会生成
作用会生成 。现有
。现有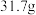 无水
无水 ,吸收
,吸收 后变成
后变成 ,试回答下列问题:
,试回答下列问题:(3)
 中
中
(4)
 为配合物,其中
为配合物,其中 的配位数为6,经测定
的配位数为6,经测定 该配合物和足量
该配合物和足量 溶液反应得到
溶液反应得到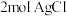 沉淀,则该配合物的化学式可表示为
沉淀,则该配合物的化学式可表示为
您最近一年使用:0次
名校
9 . 工业废气中的 的脱除是目前学术界研究的热点。
的脱除是目前学术界研究的热点。
I.某研究小组用新型 催化剂对
催化剂对 、
、 催化转化进行研究,测得一段时间内
催化转化进行研究,测得一段时间内 的转化率、
的转化率、 剩余的百分率随温度变化情况如下图所示。已知NO可发生下列反应:
剩余的百分率随温度变化情况如下图所示。已知NO可发生下列反应:
反应I: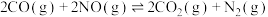

反应Ⅱ:


○:无CO且无催化剂时 直接分解成
直接分解成 的转化率
的转化率
△: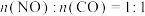 时,
时, 转化为
转化为 的转化率
的转化率
□: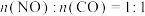 时,
时, 的剩余百分率
的剩余百分率
(1)无 且无催化剂时,在
且无催化剂时,在 以上,随着温度的升高,
以上,随着温度的升高, 的转化率不断降低,其可能原因是
的转化率不断降低,其可能原因是___________ 。
(2)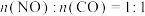 时,该催化剂脱除
时,该催化剂脱除 的最适宜温度在
的最适宜温度在___________ ℃左右。
(3) ,初始
,初始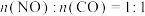 ,且不考虑除反应
,且不考虑除反应 、反应Ⅱ之外的反应时,反应相同时间后体系内
、反应Ⅱ之外的反应时,反应相同时间后体系内
___________ 。
(4)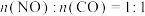 条件下,温度高于
条件下,温度高于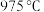 时,随着温度的升高,
时,随着温度的升高, 的转化率迅速降低,其可能原因是
的转化率迅速降低,其可能原因是___________ 。
Ⅱ.在 催化剂中,起催化作用的
催化剂中,起催化作用的 被负载于纳米
被负载于纳米 颗粒上。将含有
颗粒上。将含有 的尾气与空气、氨气按一定比例通入已知催化体系中,已知反应过程如下图所示:
的尾气与空气、氨气按一定比例通入已知催化体系中,已知反应过程如下图所示:

(5)根据上图所示反应过程,请推断过程I中 的化合价如何变化
的化合价如何变化 :反应前
:反应前___________ 价,反应后___________ 价。
(6)请写出NO被催化还原的总反应方程式___________ 。
 的脱除是目前学术界研究的热点。
的脱除是目前学术界研究的热点。I.某研究小组用新型
 催化剂对
催化剂对 、
、 催化转化进行研究,测得一段时间内
催化转化进行研究,测得一段时间内 的转化率、
的转化率、 剩余的百分率随温度变化情况如下图所示。已知NO可发生下列反应:
剩余的百分率随温度变化情况如下图所示。已知NO可发生下列反应:反应I:
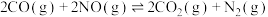

反应Ⅱ:



○:无CO且无催化剂时
 直接分解成
直接分解成 的转化率
的转化率△:
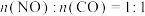 时,
时, 转化为
转化为 的转化率
的转化率□:
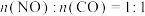 时,
时, 的剩余百分率
的剩余百分率(1)无
 且无催化剂时,在
且无催化剂时,在 以上,随着温度的升高,
以上,随着温度的升高, 的转化率不断降低,其可能原因是
的转化率不断降低,其可能原因是(2)
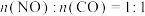 时,该催化剂脱除
时,该催化剂脱除 的最适宜温度在
的最适宜温度在(3)
 ,初始
,初始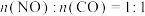 ,且不考虑除反应
,且不考虑除反应 、反应Ⅱ之外的反应时,反应相同时间后体系内
、反应Ⅱ之外的反应时,反应相同时间后体系内
(4)
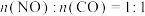 条件下,温度高于
条件下,温度高于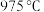 时,随着温度的升高,
时,随着温度的升高, 的转化率迅速降低,其可能原因是
的转化率迅速降低,其可能原因是Ⅱ.在
 催化剂中,起催化作用的
催化剂中,起催化作用的 被负载于纳米
被负载于纳米 颗粒上。将含有
颗粒上。将含有 的尾气与空气、氨气按一定比例通入已知催化体系中,已知反应过程如下图所示:
的尾气与空气、氨气按一定比例通入已知催化体系中,已知反应过程如下图所示:
(5)根据上图所示反应过程,请推断过程I中
 的化合价如何变化
的化合价如何变化 :反应前
:反应前(6)请写出NO被催化还原的总反应方程式
您最近一年使用:0次
解题方法
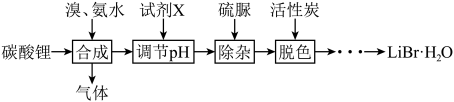
10 . 溴化锂是一种高效水汽吸收剂和空气湿度调节剂。工业上以碳酸锂为原料制备LiBr·H2O的流程如下:
已知:①Br2+H2O HBr+HBrO,Br2+3H2O
HBr+HBrO,Br2+3H2O 5HBr+HBrO3;②NH3有还原性,HBrO、HBrO3均具有强氧化性。
5HBr+HBrO3;②NH3有还原性,HBrO、HBrO3均具有强氧化性。
(1)合成时,除生成LiBr外,还产生了2种参与大气循环的气体,写出该化学方程式:___________ 。
(2)合成时,向碳酸锂中滴加溴和氨水的顺序是___________ (填字母),可能的理由是______________ 。
a.先加氨水再滴溴 b.先滴溴再加氨水 c.边滴溴边加氨水
(3)合成所得的溶液中存在过量的溴会导致溶液pH<3,可用试剂X将溶液pH调节至8~9以除去过量的溴,则X的化学式为___________ 。
(4)加入硫脲[CS(NH2)2]的作用是除去 ,反应中硫脲表现
,反应中硫脲表现___________ (填“氧化性”或“还原性”)。
(5)已知脱色后的混合液中还含有少量的 。溴化锂溶液的溶解度随温度变化曲线如图所示,请补充完整脱色后得到的溶液制备LiBr·H2O的实验方案:加入活性炭脱色后,
。溴化锂溶液的溶解度随温度变化曲线如图所示,请补充完整脱色后得到的溶液制备LiBr·H2O的实验方案:加入活性炭脱色后,___________ 。(实验中可供选择的试剂:盐酸、氢溴酸、乙醇、蒸馏水)。


已知:①Br2+H2O
 HBr+HBrO,Br2+3H2O
HBr+HBrO,Br2+3H2O 5HBr+HBrO3;②NH3有还原性,HBrO、HBrO3均具有强氧化性。
5HBr+HBrO3;②NH3有还原性,HBrO、HBrO3均具有强氧化性。(1)合成时,除生成LiBr外,还产生了2种参与大气循环的气体,写出该化学方程式:
(2)合成时,向碳酸锂中滴加溴和氨水的顺序是
a.先加氨水再滴溴 b.先滴溴再加氨水 c.边滴溴边加氨水
(3)合成所得的溶液中存在过量的溴会导致溶液pH<3,可用试剂X将溶液pH调节至8~9以除去过量的溴,则X的化学式为
(4)加入硫脲[CS(NH2)2]的作用是除去
 ,反应中硫脲表现
,反应中硫脲表现(5)已知脱色后的混合液中还含有少量的
 。溴化锂溶液的溶解度随温度变化曲线如图所示,请补充完整脱色后得到的溶液制备LiBr·H2O的实验方案:加入活性炭脱色后,
。溴化锂溶液的溶解度随温度变化曲线如图所示,请补充完整脱色后得到的溶液制备LiBr·H2O的实验方案:加入活性炭脱色后,
您最近一年使用:0次



