1 . 光照下,氧化锌纳米棒具有优异的光催化活性,可用于制备过氧化氢,反应机理如图所示( 表示电子跃迁产生的空穴)。下列叙述错误的是
表示电子跃迁产生的空穴)。下列叙述错误的是
 表示电子跃迁产生的空穴)。下列叙述错误的是
表示电子跃迁产生的空穴)。下列叙述错误的是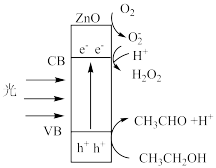
| A.反应过程中吸收了光能,说明总反应为吸热反应 |
B.中间体 含有单电子,结构不稳定、反应活性强 含有单电子,结构不稳定、反应活性强 |
C.理论上生成 和 和 的物质的量之比为1:1 的物质的量之比为1:1 |
D.乙醇发生的反应可表示为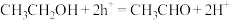 |
您最近一年使用:0次
名校
2 . 二氧化铈( )是一种应用非常广泛的稀土氧化物。现以氟碳铈矿(含
)是一种应用非常广泛的稀土氧化物。现以氟碳铈矿(含 、
、 、
、 等)为原料制备
等)为原料制备 ,其工艺流程如图所示:
,其工艺流程如图所示:
(1)“焙烧”时,通入空气的主要目的是_________________ 。
(2)滤渣的主要成分是___________________ (填化学式)。
(3)“还原、脱氟”时,先加入硫脲(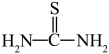 ),目的是将溶液中的
),目的是将溶液中的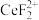 还原为
还原为 ,写出该反应的离子方程式:
,写出该反应的离子方程式:_________________ [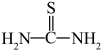 被氧化为
被氧化为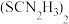 ,生成物还有HF和
,生成物还有HF和 ]。
]。
(4)“沉铈”时反应的离子方程式为__________________ 。若用 溶液代替
溶液代替 溶液,产生的后果是
溶液,产生的后果是________________ 。
(5)若常温下,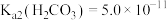 ,
,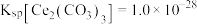 ,
, 恰好沉淀完全
恰好沉淀完全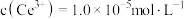 ,此时测得溶液的
,此时测得溶液的 ,则溶液中
,则溶液中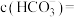
_____________  。
。
(6)二氧化铈作为一种SCR脱硝催化剂,能在 和
和 之间改变氧化状态,将
之间改变氧化状态,将 氧化为
氧化为 ,并引起氧空位的形成,得到新的铈氧化物
,并引起氧空位的形成,得到新的铈氧化物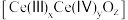 。铈氧化物发生的可能变化如图所示。当
。铈氧化物发生的可能变化如图所示。当
 氧化标准状况下
氧化标准状况下 NO后,生成新的铈氧化物中x、y、z的最简整数比为
NO后,生成新的铈氧化物中x、y、z的最简整数比为____________ 。
 )是一种应用非常广泛的稀土氧化物。现以氟碳铈矿(含
)是一种应用非常广泛的稀土氧化物。现以氟碳铈矿(含 、
、 、
、 等)为原料制备
等)为原料制备 ,其工艺流程如图所示:
,其工艺流程如图所示: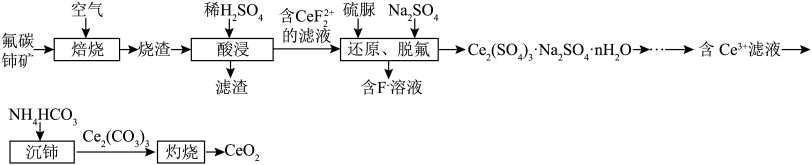
(1)“焙烧”时,通入空气的主要目的是
(2)滤渣的主要成分是
(3)“还原、脱氟”时,先加入硫脲(
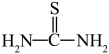 ),目的是将溶液中的
),目的是将溶液中的 还原为
还原为 ,写出该反应的离子方程式:
,写出该反应的离子方程式: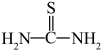 被氧化为
被氧化为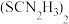 ,生成物还有HF和
,生成物还有HF和 ]。
]。(4)“沉铈”时反应的离子方程式为
 溶液代替
溶液代替 溶液,产生的后果是
溶液,产生的后果是(5)若常温下,
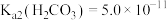 ,
,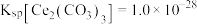 ,
, 恰好沉淀完全
恰好沉淀完全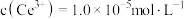 ,此时测得溶液的
,此时测得溶液的 ,则溶液中
,则溶液中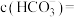
 。
。(6)二氧化铈作为一种SCR脱硝催化剂,能在
 和
和 之间改变氧化状态,将
之间改变氧化状态,将 氧化为
氧化为 ,并引起氧空位的形成,得到新的铈氧化物
,并引起氧空位的形成,得到新的铈氧化物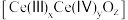 。铈氧化物发生的可能变化如图所示。当
。铈氧化物发生的可能变化如图所示。当
 氧化标准状况下
氧化标准状况下 NO后,生成新的铈氧化物中x、y、z的最简整数比为
NO后,生成新的铈氧化物中x、y、z的最简整数比为
您最近一年使用:0次
2024-05-27更新
|
112次组卷
|
3卷引用:广西桂林市第十八中学2023-2024学年高三下学期5月月考化学试卷
名校
3 . 利用废电池材料 (含炭黑及少量
(含炭黑及少量 等元素)回收金属资源的工艺流程如下:
等元素)回收金属资源的工艺流程如下: 如下表:
如下表:
②电极电位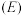 表示溶液中某微粒获得电子被还原的趋势(即氧化性);如电极反应
表示溶液中某微粒获得电子被还原的趋势(即氧化性);如电极反应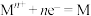 的
的 越大,表示
越大,表示 的氧化性越强。
的氧化性越强。
酸性条件: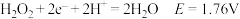 ;
;
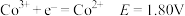
碱性条件: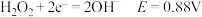 ;
;
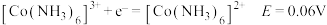
③丁二酮肟是不溶于水的固体,溶于乙醇后可与 反应生成丁二酮肟镍。
反应生成丁二酮肟镍。 转化后的钴离子价电子排布式为
转化后的钴离子价电子排布式为______ ,滤渣1为______ 。
(2)“氧化调 "中,
"中, 转化为
转化为 ,滤渣2中还有
,滤渣2中还有______ ,调节 范围为
范围为______ 。
(3)“转化”时,加入浓氨水将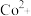 转化为
转化为 的原因是
的原因是______ ,加 目的是
目的是______ 。
(4)“沉镍”后,从滤渣3中回收丁二酮肟固体的操作是______ 。
(5)由 溶液制备催化剂
溶液制备催化剂 的步骤为:第一步加入尿素
的步骤为:第一步加入尿素 生成
生成 沉淀(有
沉淀(有 气体产生),第二步焙烧得到
气体产生),第二步焙烧得到 。写出第一步的离子方程式
。写出第一步的离子方程式______ 。
(6)由 制备得一种锂离子电池材料
制备得一种锂离子电池材料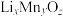 ,其晶胞分别由4个
,其晶胞分别由4个 个
个 立方单元构成。则
立方单元构成。则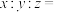
______ 。
 (含炭黑及少量
(含炭黑及少量 等元素)回收金属资源的工艺流程如下:
等元素)回收金属资源的工艺流程如下:
 如下表:
如下表:氢氧化物 |
|
|
|
|
完全沉淀 | 9.2 | 1.3 | 4.7 | 3.1 |
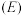 表示溶液中某微粒获得电子被还原的趋势(即氧化性);如电极反应
表示溶液中某微粒获得电子被还原的趋势(即氧化性);如电极反应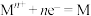 的
的 越大,表示
越大,表示 的氧化性越强。
的氧化性越强。酸性条件:
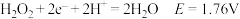 ;
;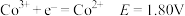
碱性条件:
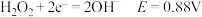 ;
;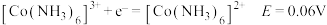
③丁二酮肟是不溶于水的固体,溶于乙醇后可与
 反应生成丁二酮肟镍。
反应生成丁二酮肟镍。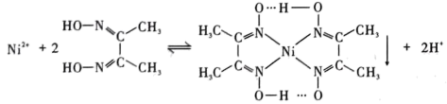
 转化后的钴离子价电子排布式为
转化后的钴离子价电子排布式为(2)“氧化调
 "中,
"中, 转化为
转化为 ,滤渣2中还有
,滤渣2中还有 范围为
范围为(3)“转化”时,加入浓氨水将
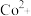 转化为
转化为 的原因是
的原因是 目的是
目的是(4)“沉镍”后,从滤渣3中回收丁二酮肟固体的操作是
(5)由
 溶液制备催化剂
溶液制备催化剂 的步骤为:第一步加入尿素
的步骤为:第一步加入尿素 生成
生成 沉淀(有
沉淀(有 气体产生),第二步焙烧得到
气体产生),第二步焙烧得到 。写出第一步的离子方程式
。写出第一步的离子方程式(6)由
 制备得一种锂离子电池材料
制备得一种锂离子电池材料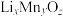 ,其晶胞分别由4个
,其晶胞分别由4个 个
个 立方单元构成。则
立方单元构成。则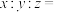

您最近一年使用:0次
2024-05-16更新
|
162次组卷
|
2卷引用:2024届重庆市南开中学校高三下学期5月月考化学试题
4 . 下列说法错误的是
| A.已知电负性:Si<H<Cl,则SiHCl3水解时发生氧化还原反应 |
| B.已知Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O,则氧化剂与还原剂物质的量之比为1:2 |
C.已知Na+KCl(熔融) K+NaCl,则可推知钠的还原性和金属性都强于钾 K+NaCl,则可推知钠的还原性和金属性都强于钾 |
| D.已知4KO2+2H2O=4KOH+3O2,则O2为氧化产物 |
您最近一年使用:0次
2024-05-11更新
|
135次组卷
|
2卷引用:河北省石家庄市第十七中学2023-2024学年高三下学期第一次月考化学试题
5 . 已知FeSO4有如图所示的转化关系,下列叙述正确的是

| A.M一定是红棕色粉末 |
| B.图中发生了3个氧化还原反应 |
| C.生成HNO3的反应中,浓硫酸表现强氧化性、难挥发性和强酸性 |
D.“褪色”的原因是SO2+Br2+2H2O=4H++ +2Br- +2Br- |
您最近一年使用:0次
解题方法
6 . 下列反应不符合哲学中“量变引起质变”观点的是
| A.锌与硫酸 | B.FeBr2溶液和氯水 |
| C.铜和硝酸 | D.氨气和氯化氢 |
您最近一年使用:0次
名校
7 . 请根据硫元素的价类二维图,回答下列问题:___________ (填化学式)。
(2)宋代著名法医学家宋慈的 洗冤集录
洗冤集录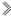 中有关于“银针验毒”的记载,银针主要用于检验是否有含硫元素的有毒物质。其反应原理之一为:Ag + X + O2 →Ag2S + H2O(反应未配平),已知:Ag2S为一种不溶于水的灰黑色固体。以下有关说法
中有关于“银针验毒”的记载,银针主要用于检验是否有含硫元素的有毒物质。其反应原理之一为:Ag + X + O2 →Ag2S + H2O(反应未配平),已知:Ag2S为一种不溶于水的灰黑色固体。以下有关说法错误 的是___________(填字母)。
(3)Y转化为Z可以选择下列试剂___________ 。
A.酸性KMnO4溶液 B.FeCl2溶液 C.NaOH溶液 D.X的水溶液
写出你所选试剂将Y转化为Z的离子方程式___________ 。
(4)若N是CuSO4,某同学设计了甲和乙两种方法制备:
甲: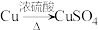 乙:
乙:
①写出甲方法反应的化学方程式:___________ 。
②甲和乙方法更合理的是___________ (填“甲”或“乙”),理由是___________ (答两点)。
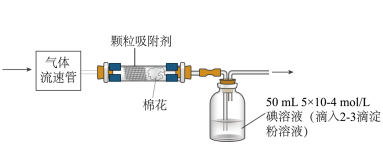
(5)已知空气中SO2的最大允许排放浓度不得超过0.02 mg•L-1,可通过下列装置定量分析空气中SO2的含量。___________ mg•L-1(结果精确到0.001)。

(2)宋代著名法医学家宋慈的
 洗冤集录
洗冤集录 中有关于“银针验毒”的记载,银针主要用于检验是否有含硫元素的有毒物质。其反应原理之一为:Ag + X + O2 →Ag2S + H2O(反应未配平),已知:Ag2S为一种不溶于水的灰黑色固体。以下有关说法
中有关于“银针验毒”的记载,银针主要用于检验是否有含硫元素的有毒物质。其反应原理之一为:Ag + X + O2 →Ag2S + H2O(反应未配平),已知:Ag2S为一种不溶于水的灰黑色固体。以下有关说法| A.当银针变黑时,说明所检验的物质中可能有毒 |
| B.银针验毒时,Ag被氧化 |
| C.X在上述验毒反应中作还原剂 |
| D.上述验毒反应中氧化剂和还原剂的物质的量之比为4∶1 |
(3)Y转化为Z可以选择下列试剂
A.酸性KMnO4溶液 B.FeCl2溶液 C.NaOH溶液 D.X的水溶液
写出你所选试剂将Y转化为Z的离子方程式
(4)若N是CuSO4,某同学设计了甲和乙两种方法制备:
甲:
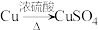 乙:
乙:
①写出甲方法反应的化学方程式:
②甲和乙方法更合理的是
(5)已知空气中SO2的最大允许排放浓度不得超过0.02 mg•L-1,可通过下列装置定量分析空气中SO2的含量。
您最近一年使用:0次
2024-04-29更新
|
227次组卷
|
2卷引用:四川省南充高级中学2023-2024学年高一下学期3月月考化学试题
名校
8 . 在酸性环境中,纳米Fe/Ni复合材料去除污染水体的N 的反应过程(Ni不参与反应)如图所示,下列说法正确的是
的反应过程(Ni不参与反应)如图所示,下列说法正确的是
 的反应过程(Ni不参与反应)如图所示,下列说法正确的是
的反应过程(Ni不参与反应)如图所示,下列说法正确的是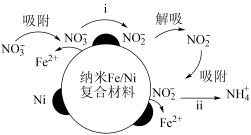
| A.反应步骤i中产生了气体 | B.反应步骤ⅱ不需要H+的参与 |
C.去除N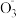 后的水体pH增大 后的水体pH增大 | D.处理过程中Fe/Ni复合材料作催化剂 |
您最近一年使用:0次
2024-04-24更新
|
149次组卷
|
2卷引用:2024届广东省普通高中学科综合素养评价高三下学期2月南粤名校联考化学试题
9 . 科学家经过研究发现中国霾星中性,其主要原因如图所示:_______ 。
您最近一年使用:0次
名校
解题方法
10 . 我国某研究团队利用电解法处理富营养化河水的机理如图,下列说法正确的是
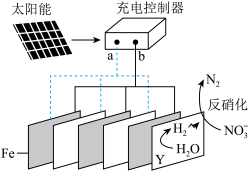

A. 极为电子流出极, 极为电子流出极, 极为电子流入极 极为电子流入极 |
B. 极发生的反应为 极发生的反应为 |
C.一段时间后,该河水的 增大 增大 |
D.反硝化过程中,还原剂与还原产物的物质的量之比为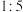 |
您最近一年使用:0次







