名校
解题方法
1 . 我国学者用氮气为氮源高效合成了活性氮物质 ,用于多种高附加值含氮化合物的合成。
,用于多种高附加值含氮化合物的合成。 可与乙醇、有机卤代物等反应,其制备及转化为物质甲的过程如下:
可与乙醇、有机卤代物等反应,其制备及转化为物质甲的过程如下:
 ,用于多种高附加值含氮化合物的合成。
,用于多种高附加值含氮化合物的合成。 可与乙醇、有机卤代物等反应,其制备及转化为物质甲的过程如下:
可与乙醇、有机卤代物等反应,其制备及转化为物质甲的过程如下: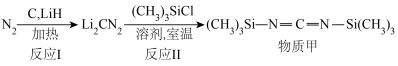
| A.反应I实现了氮的固定 | B. 中既有离子键又有共价键 中既有离子键又有共价键 |
C.反应I中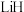 做还原剂 做还原剂 | D.物质甲中碳原子的空间运动状态为6种 |
您最近一年使用:0次
2 . 已知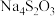 和
和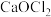 均属于混盐(由一种阳离子与两种酸根阴离子组成的盐)。下列说法
均属于混盐(由一种阳离子与两种酸根阴离子组成的盐)。下列说法不正确 的是
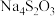 和
和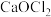 均属于混盐(由一种阳离子与两种酸根阴离子组成的盐)。下列说法
均属于混盐(由一种阳离子与两种酸根阴离子组成的盐)。下列说法A.1mo 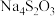 固体中共含有6mol离子 固体中共含有6mol离子 |
B.向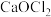 中加入足量稀硫酸会有 中加入足量稀硫酸会有 产生,被氧化与被还原的原子数相等 产生,被氧化与被还原的原子数相等 |
C.向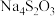 中加入足量稀硫酸时发生反应: 中加入足量稀硫酸时发生反应: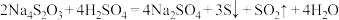 。 。 |
D. 是含有极性键的非极性分子 是含有极性键的非极性分子 |
您最近一年使用:0次
3 . 元素周期表中VIIA族元素及其化合物应用广泛。氢氟酸可用作雕刻玻璃; 可溶于苯、
可溶于苯、 等有机溶剂,极易水解;加碘盐中主要添加的是
等有机溶剂,极易水解;加碘盐中主要添加的是 ;卤素互化物(如ICl、
;卤素互化物(如ICl、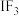 )具有强氧化性;卤化银具有感光性。下列化学反应表示正确的是
)具有强氧化性;卤化银具有感光性。下列化学反应表示正确的是
 可溶于苯、
可溶于苯、 等有机溶剂,极易水解;加碘盐中主要添加的是
等有机溶剂,极易水解;加碘盐中主要添加的是 ;卤素互化物(如ICl、
;卤素互化物(如ICl、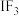 )具有强氧化性;卤化银具有感光性。下列化学反应表示正确的是
)具有强氧化性;卤化银具有感光性。下列化学反应表示正确的是A. 溶于水: 溶于水: |
B.ICl溶于NaOH溶液: |
C. 水解: 水解: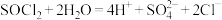 |
D. 用 用 溶液吸收: 溶液吸收: |
您最近一年使用:0次
名校
4 . 二氧化铈( )是一种应用非常广泛的稀土氧化物。现以氟碳铈矿(含
)是一种应用非常广泛的稀土氧化物。现以氟碳铈矿(含 、
、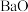 、
、 等)为原料制备
等)为原料制备 ,其工艺流程如图所示:
,其工艺流程如图所示:
(1)“焙烧”时,通入空气的主要目的是_________________ 。
(2)滤渣的主要成分是___________________ (填化学式)。
(3)“还原、脱氟”时,先加入硫脲(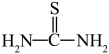 ),目的是将溶液中的
),目的是将溶液中的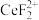 还原为
还原为 ,写出该反应的离子方程式:
,写出该反应的离子方程式:_________________ [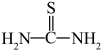 被氧化为
被氧化为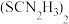 ,生成物还有HF和
,生成物还有HF和 ]。
]。
(4)“沉铈”时反应的离子方程式为__________________ 。若用 溶液代替
溶液代替 溶液,产生的后果是
溶液,产生的后果是________________ 。
(5)若常温下,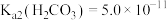 ,
,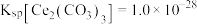 ,
, 恰好沉淀完全
恰好沉淀完全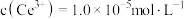 ,此时测得溶液的
,此时测得溶液的 ,则溶液中
,则溶液中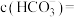
_____________  。
。
(6)二氧化铈作为一种SCR脱硝催化剂,能在 和
和 之间改变氧化状态,将
之间改变氧化状态,将 氧化为
氧化为 ,并引起氧空位的形成,得到新的铈氧化物
,并引起氧空位的形成,得到新的铈氧化物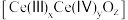 。铈氧化物发生的可能变化如图所示。当
。铈氧化物发生的可能变化如图所示。当
 氧化标准状况下
氧化标准状况下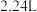 NO后,生成新的铈氧化物中x、y、z的最简整数比为
NO后,生成新的铈氧化物中x、y、z的最简整数比为____________ 。
 )是一种应用非常广泛的稀土氧化物。现以氟碳铈矿(含
)是一种应用非常广泛的稀土氧化物。现以氟碳铈矿(含 、
、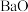 、
、 等)为原料制备
等)为原料制备 ,其工艺流程如图所示:
,其工艺流程如图所示: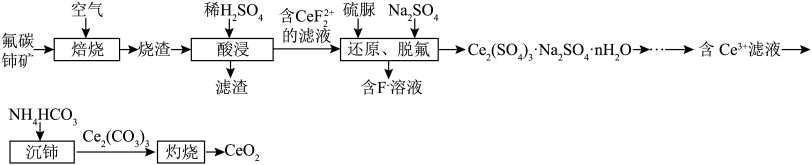
(1)“焙烧”时,通入空气的主要目的是
(2)滤渣的主要成分是
(3)“还原、脱氟”时,先加入硫脲(
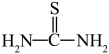 ),目的是将溶液中的
),目的是将溶液中的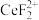 还原为
还原为 ,写出该反应的离子方程式:
,写出该反应的离子方程式: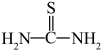 被氧化为
被氧化为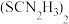 ,生成物还有HF和
,生成物还有HF和 ]。
]。(4)“沉铈”时反应的离子方程式为
 溶液代替
溶液代替 溶液,产生的后果是
溶液,产生的后果是(5)若常温下,
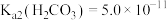 ,
,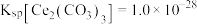 ,
, 恰好沉淀完全
恰好沉淀完全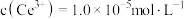 ,此时测得溶液的
,此时测得溶液的 ,则溶液中
,则溶液中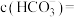
 。
。(6)二氧化铈作为一种SCR脱硝催化剂,能在
 和
和 之间改变氧化状态,将
之间改变氧化状态,将 氧化为
氧化为 ,并引起氧空位的形成,得到新的铈氧化物
,并引起氧空位的形成,得到新的铈氧化物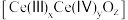 。铈氧化物发生的可能变化如图所示。当
。铈氧化物发生的可能变化如图所示。当
 氧化标准状况下
氧化标准状况下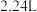 NO后,生成新的铈氧化物中x、y、z的最简整数比为
NO后,生成新的铈氧化物中x、y、z的最简整数比为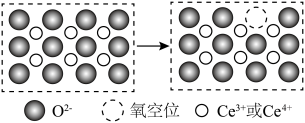
您最近一年使用:0次
2024-05-27更新
|
113次组卷
|
3卷引用:江苏省部分学校2024届高三下学期全真模拟测化学试卷
名校
5 . 二氯化二硫( )是一种常用的橡胶硫化剂,其结构如图所示。
)是一种常用的橡胶硫化剂,其结构如图所示。 极易水解:
极易水解: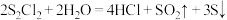 。下列说法错误的是
。下列说法错误的是
 )是一种常用的橡胶硫化剂,其结构如图所示。
)是一种常用的橡胶硫化剂,其结构如图所示。 极易水解:
极易水解: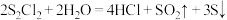 。下列说法错误的是
。下列说法错误的是
A. 中S为+1价 中S为+1价 |
B. 是由非极性键与极性键构成的极性分子 是由非极性键与极性键构成的极性分子 |
C.上述反应中 既作氧化剂又作还原剂 既作氧化剂又作还原剂 |
| D.上述反应中氧化产物与还原产物的质量比为3:1 |
您最近一年使用:0次
6 . 锂电池的研发、使用及废电池的回收具有重要意义。
(1)比能量是指电池单位质量(或体积)输出的电能。锂金属电池放电时总反应为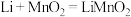 。下列关于锂金属电池说法正确的是
。下列关于锂金属电池说法正确的是___________ (填序号)。
A放电时Li作负极 B.比能量高于锌锰干电池 C.可用稀 作电解质
作电解质
(2)钴酸锂( )、磷酸铁锂(
)、磷酸铁锂( )等锂离子二次电池应用普遍。
)等锂离子二次电池应用普遍。
①钴酸锂电池放电时示意图如图1所示。放电时, 由
由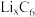 中脱嵌。写出放电至完全时
中脱嵌。写出放电至完全时 电极的电极反应式:
电极的电极反应式:___________ 。 脱嵌形成
脱嵌形成 。
。 晶胞中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构(如图2所示)。x=
晶胞中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构(如图2所示)。x=___________ 。 和NaCl溶液中使电池充分放电是电池回收工艺的首要步骤。电池在不同溶液中放电的残余电压随时间的变化如图3所示。对浸泡液中沉淀物热处理后,得到XRD示意图谱如图4所示。
和NaCl溶液中使电池充分放电是电池回收工艺的首要步骤。电池在不同溶液中放电的残余电压随时间的变化如图3所示。对浸泡液中沉淀物热处理后,得到XRD示意图谱如图4所示。___________ 。
②与 溶液相比,NaCl溶液的质量分数由5%增大至10%时,电池残余电压降低速率更快。依据图4XRD图谱,分析其主要原因:
溶液相比,NaCl溶液的质量分数由5%增大至10%时,电池残余电压降低速率更快。依据图4XRD图谱,分析其主要原因:___________ 。
(4)将放电完全的钴酸锂电池正极材料粉碎后进行酸浸处理。实验测得,在相同条件下,使用盐酸作浸取剂可使钴转化为 ,转化率达到99%,但工业生产使用
,转化率达到99%,但工业生产使用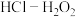 混合物作浸取剂。
混合物作浸取剂。
①写出盐酸作浸取剂发生酸浸反应的化学反应方程式:___________ 。
②工业生产时在盐酸中加入 ,
, 的作用是
的作用是___________ 。
(1)比能量是指电池单位质量(或体积)输出的电能。锂金属电池放电时总反应为
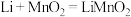 。下列关于锂金属电池说法正确的是
。下列关于锂金属电池说法正确的是A放电时Li作负极 B.比能量高于锌锰干电池 C.可用稀
 作电解质
作电解质(2)钴酸锂(
 )、磷酸铁锂(
)、磷酸铁锂( )等锂离子二次电池应用普遍。
)等锂离子二次电池应用普遍。①钴酸锂电池放电时示意图如图1所示。放电时,
 由
由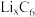 中脱嵌。写出放电至完全时
中脱嵌。写出放电至完全时 电极的电极反应式:
电极的电极反应式: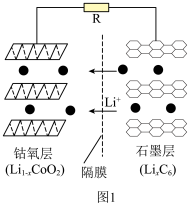
 脱嵌形成
脱嵌形成 。
。 晶胞中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构(如图2所示)。x=
晶胞中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构(如图2所示)。x=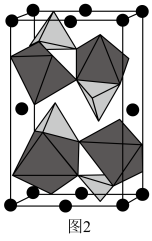
 和NaCl溶液中使电池充分放电是电池回收工艺的首要步骤。电池在不同溶液中放电的残余电压随时间的变化如图3所示。对浸泡液中沉淀物热处理后,得到XRD示意图谱如图4所示。
和NaCl溶液中使电池充分放电是电池回收工艺的首要步骤。电池在不同溶液中放电的残余电压随时间的变化如图3所示。对浸泡液中沉淀物热处理后,得到XRD示意图谱如图4所示。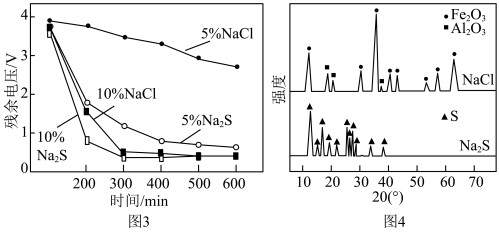
②与
 溶液相比,NaCl溶液的质量分数由5%增大至10%时,电池残余电压降低速率更快。依据图4XRD图谱,分析其主要原因:
溶液相比,NaCl溶液的质量分数由5%增大至10%时,电池残余电压降低速率更快。依据图4XRD图谱,分析其主要原因:(4)将放电完全的钴酸锂电池正极材料粉碎后进行酸浸处理。实验测得,在相同条件下,使用盐酸作浸取剂可使钴转化为
 ,转化率达到99%,但工业生产使用
,转化率达到99%,但工业生产使用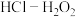 混合物作浸取剂。
混合物作浸取剂。①写出盐酸作浸取剂发生酸浸反应的化学反应方程式:
②工业生产时在盐酸中加入
 ,
, 的作用是
的作用是
您最近一年使用:0次
7 . 将 和空气的混合气体通入
和空气的混合气体通入 、
、 和
和 的混合溶液中回收S,其转化如图所示(CuS不溶于水)。下列说法正确的是
的混合溶液中回收S,其转化如图所示(CuS不溶于水)。下列说法正确的是
 和空气的混合气体通入
和空气的混合气体通入 、
、 和
和 的混合溶液中回收S,其转化如图所示(CuS不溶于水)。下列说法正确的是
的混合溶液中回收S,其转化如图所示(CuS不溶于水)。下列说法正确的是
A.基态Cu原子的电子排布式为 |
B.过程①的离子方程式为: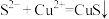 |
C.氧化性: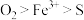 |
D.相同条件下, 和空气的比例不影响处理效果 和空气的比例不影响处理效果 |
您最近一年使用:0次
名校
解题方法
8 . 以下是一系列非金属元素间的置换反应,其中不能说明反应前的非金属单质的氧化性强于产物中非金属单质的氧化性的是
A. | B.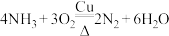 |
C. | D. |
您最近一年使用:0次
9 . 我国科学家成功利用CO2合成淀粉,使“粮食”生产从农耕种植转向工业制造成为可能,部分转化过程如下:
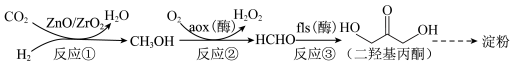
| A.反应①中1 mol CO2反应失去6 mol电子 | B.反应②中n(CH3OH):n(O2)=2:1 |
| C.反应③中发生了加成反应 | D.反应①~③在高温下反应速率会更快 |
您最近一年使用:0次
10 . 细菌可以促使铁、氮两种元素进行氧化还原反应,并耦合两种元素的循环。耦合循环中的部分转化如下图所示。_______ (填字母序号)。
a.N2转化为氨态氮 b.硝化过程 c.反硝化过程
(2)氮肥是水体中氨态氮的主要来源之一,氨气是生产氮肥的主要原料,工业合成氨的化学方程式为_______ 。
(3)硝化过程中,含氮物质发生_______ (填“氧化”或“还原”)反应。
(4)氨态氮与亚硝态氮可以在氨氧化细菌的作用下转化为氮气。该反应中,当产生0.02 mol 氮气时,转移的电子的物质的量为_______ mol。
(5)NO是大气污染气体,测定某气体样品中NO含量操作如下:将2L气样通入适量酸化的H2O2溶液中,使NO完全被氧化为 。向上述反应后溶液中加入30 mL0.1 mol·L−1FeSO4溶液(过量),充分反应后,多余Fe2+与3.5 mL、0.1 mol·L−1K2Cr2O7恰好反应。NO被H2O2氧化为
。向上述反应后溶液中加入30 mL0.1 mol·L−1FeSO4溶液(过量),充分反应后,多余Fe2+与3.5 mL、0.1 mol·L−1K2Cr2O7恰好反应。NO被H2O2氧化为 的离子方程式是
的离子方程式是______ 。上述过程中发生下列反应:3Fe2++ +4H+=NO↑+3Fe3++2H2O;
+4H+=NO↑+3Fe3++2H2O; + 6Fe2+ +14H+ =2Cr3+ +6Fe3++7H2O。则气样中NO的含量为
+ 6Fe2+ +14H+ =2Cr3+ +6Fe3++7H2O。则气样中NO的含量为_______ mg /L。(保留计算过程)
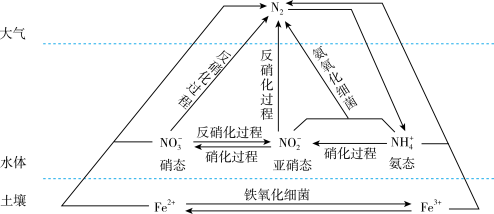
a.N2转化为氨态氮 b.硝化过程 c.反硝化过程
(2)氮肥是水体中氨态氮的主要来源之一,氨气是生产氮肥的主要原料,工业合成氨的化学方程式为
(3)硝化过程中,含氮物质发生
(4)氨态氮与亚硝态氮可以在氨氧化细菌的作用下转化为氮气。该反应中,当产生0.02 mol 氮气时,转移的电子的物质的量为
(5)NO是大气污染气体,测定某气体样品中NO含量操作如下:将2L气样通入适量酸化的H2O2溶液中,使NO完全被氧化为
 。向上述反应后溶液中加入30 mL0.1 mol·L−1FeSO4溶液(过量),充分反应后,多余Fe2+与3.5 mL、0.1 mol·L−1K2Cr2O7恰好反应。NO被H2O2氧化为
。向上述反应后溶液中加入30 mL0.1 mol·L−1FeSO4溶液(过量),充分反应后,多余Fe2+与3.5 mL、0.1 mol·L−1K2Cr2O7恰好反应。NO被H2O2氧化为 的离子方程式是
的离子方程式是 +4H+=NO↑+3Fe3++2H2O;
+4H+=NO↑+3Fe3++2H2O; + 6Fe2+ +14H+ =2Cr3+ +6Fe3++7H2O。则气样中NO的含量为
+ 6Fe2+ +14H+ =2Cr3+ +6Fe3++7H2O。则气样中NO的含量为
您最近一年使用:0次



