名校
解题方法
1 . 硫元素的几种化合物及其单质存在下列转化关系(反应条件省略)。

下列判断不正确的是

下列判断不正确的是
A.反应①中氧化剂与还原剂物质的量之比为 |
B.反应②表明 具有酸性氧化物的性质 具有酸性氧化物的性质 |
| C.反应③的原子利用率是100% |
D.反应④中稀 是氧化剂 是氧化剂 |
您最近一年使用:0次
2023-12-27更新
|
243次组卷
|
9卷引用:山东省菏泽市第一中学2023-2024学年高一上学期第三次月考化学试题
山东省菏泽市第一中学2023-2024学年高一上学期第三次月考化学试题山东省菏泽市曹县第一中学2023-2024学年高一上学期 月考化学试题辽宁省锦州市2019-2020学年高一下学期期末考试化学试题(已下线)5.1.3 不同价态含硫物质的转化-2021-2022学年高一化学课后培优练(人教版2019必修第二册)湖北省竹山县第二中学2021-2022学年高一下学期第一次月考化学试题浙江省玉环市玉城中学2021-2022学年高一下学期开学考试化学试题第五章 化工生产中的重要非金属元素(A卷·知识通关练)-【单元测试】2022-2023学年高一化学分层训练AB卷(人教版2019必修第二册)(已下线)第01练 硫及其化合物-2023年【暑假分层作业】高一化学(人教版2019必修第二册)第3课时 不同价态含硫物质的转化
名校
2 . 关于反应 ,下列说法不正确的是
,下列说法不正确的是
 ,下列说法不正确的是
,下列说法不正确的是A.该反应中 中N元素被氧化 中N元素被氧化 |
| B.氧化产物与还原产物的物质的量之比为3∶4 |
C.反应中每生成1.4mol  时转移的电子数为4.8 时转移的电子数为4.8 |
D. 发生还原反应 发生还原反应 |
您最近一年使用:0次
2023-12-01更新
|
160次组卷
|
3卷引用:山东省菏泽市鄄城县第一中学2023-2024学年高一上学期12月月考化学试题
名校
解题方法
3 . 利用空气催化氧化法除掉电石渣浆(含CaO)上层清液中的S2-并制取石膏(CaSO4•2H2O)的过程如图:
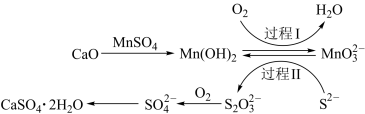
下列说法错误的是

下列说法错误的是
| A.CaSO4•2H2O属于盐类和纯净物 |
| B.过程I中氧化剂与还原剂的物质的量之比为1∶2 |
C.过程II中,反应的离子方程式为4MnO +2S2-+9H2O=S2O +2S2-+9H2O=S2O +4Mn(OH)2↓+10OH- +4Mn(OH)2↓+10OH- |
D.将10L上层清液中的S2-(S2-浓度为480mg•L-1)转化为SO ,理论上共需要0.15molO2 ,理论上共需要0.15molO2 |
您最近一年使用:0次
2023-05-07更新
|
902次组卷
|
6卷引用:山东省菏泽市郓城县第一中学(英华校区)2023-2024学年高三上学期10月阶段性考试化学试题
山东省菏泽市郓城县第一中学(英华校区)2023-2024学年高三上学期10月阶段性考试化学试题湖南省邵阳市2023届高三第三次联考(三模)化学试题(已下线)专题09 氧化还原反应(已下线)专题04 氧化还原反应-2023年高考化学真题题源解密(全国通用)吉林省长春市东北师范大学附属中学2023-2024学年高三上学期9月一模化学试题吉林省延边第一中学2023-2024学年高三上学期第二次模考化学试题
名校
4 . 关于反应 ,下列说法正确的是
,下列说法正确的是
 ,下列说法正确的是
,下列说法正确的是A. 既是氧化剂又是还原剂 既是氧化剂又是还原剂 | B.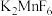 是氧化产物 是氧化产物 |
| C.氧化剂与还原剂物质的量之比为2:3 | D.生成1mol  ,转移4mol电子 ,转移4mol电子 |
您最近一年使用:0次
2023-05-06更新
|
510次组卷
|
4卷引用:山东省菏泽市郓城县第一中学(英华校区)2023-2024学年高三上学期10月阶段性考试化学试题
山东省菏泽市郓城县第一中学(英华校区)2023-2024学年高三上学期10月阶段性考试化学试题浙江省温州市2023届高三下学期5月第三次模拟适应性考试化学试题(已下线)【2023】【高三下】【模拟考】【温州三模】【高中化学】【李鼎收集】(已下线)第05练 氧化还原反应的综合考查-2023年【暑假分层作业】高二化学(2024届一轮复习通用)
名校
解题方法
5 . 向200 mL某稀硫酸和稀硝酸的混合溶液中逐渐加入铁粉,产生气体量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体)。下列说法正确的是


A.OA段发生反应的离子方程式为 |
| B.OA段和BC段生成气体的物质的量之比为2∶1 |
| C.溶液中H2SO4与HNO3的物质的量浓度之比为2∶1 |
| D.C点时溶液的溶质为FeSO4和Fe(NO3)2 |
您最近一年使用:0次
2023-01-15更新
|
280次组卷
|
3卷引用:山东省菏泽市鄄城县第一中学2022-2023学年高一上学期期末考试化学试题
6 . 已知反应: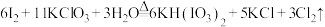 ,下列说法正确的是
,下列说法正确的是
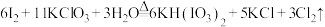 ,下列说法正确的是
,下列说法正确的是A.还原产物只有 |
| B.反应中氧化剂和还原剂的物质的量之比为6:11 |
C.可用碱石灰吸收反应产生的 制备漂白粉 制备漂白粉 |
D.产生 (标准状况) (标准状况) 时,转移 时,转移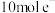 |
您最近一年使用:0次
解题方法
7 . 铁、氯元素的单质及化合物与生产、生活密切相关,请回答下列问题。
(1)铁元素与人体健康密切相关,工业盐的主要成分是NaNO2,曾多次发生过因误食NaNO2而中毒的事件,原因是NaNO2把人体内血红蛋白中的Fe2+转化为Fe3+而失去与O2结合的能力。上述事实说明NaNO2具有_______ 性,工业盐中毒后,可服用维生素C来缓解中毒状况,说明维生素C具有_______ 性。
(2)含氯消毒剂在生产生活中有着广泛的用途。
①写出实验室实中用二氧化锰与浓盐酸制取氯气的离子方程式_______ ,在制备和收集氯气的实验过程中,下列选项正确的是_______ (填字母)。
a.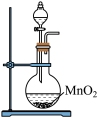 b.
b. 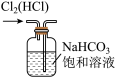 c.
c. 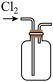 d.
d. 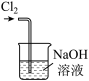
A.用装置a制取氯气 B.用装置b除去氯气中的少量氯化氢
C.用装置c收集氯气 D.用装置d吸收多余的氯气
②实验室也可以用高锰酸钾与浓盐酸制取氯气。已知KMnO4与浓盐酸反应的化学方程式如下:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O。0.1molKMnO4发生上述反应,消耗_______ molHCl,其中有_______ molHCl被氧化。分别利用二氧化锰和高锰酸钾制备等量的氯气,消耗HCl的物质的量之比为_______ 。
③实验室还可以利用如下反应制取氯气:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O。若制取标准状况下6.72L氯气,反应过程中转移电子的数目为_______ 。
④氯气通入石灰乳中可以制得漂白粉,氯气被氧化得到的产物是_______ ,还原剂与氧化剂的质量之比为_______ 。某温度下,将氯气通入NaOH溶液中,反应得到NaCl、NaClO和NaClO3的混合溶液,经测定ClO-与 的个数比为1∶3,则被氧化与被还原的氯气物质的量之比为
的个数比为1∶3,则被氧化与被还原的氯气物质的量之比为_______ 。
(1)铁元素与人体健康密切相关,工业盐的主要成分是NaNO2,曾多次发生过因误食NaNO2而中毒的事件,原因是NaNO2把人体内血红蛋白中的Fe2+转化为Fe3+而失去与O2结合的能力。上述事实说明NaNO2具有
(2)含氯消毒剂在生产生活中有着广泛的用途。
①写出实验室实中用二氧化锰与浓盐酸制取氯气的离子方程式
a.
 b.
b.  c.
c.  d.
d. 
A.用装置a制取氯气 B.用装置b除去氯气中的少量氯化氢
C.用装置c收集氯气 D.用装置d吸收多余的氯气
②实验室也可以用高锰酸钾与浓盐酸制取氯气。已知KMnO4与浓盐酸反应的化学方程式如下:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O。0.1molKMnO4发生上述反应,消耗
③实验室还可以利用如下反应制取氯气:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O。若制取标准状况下6.72L氯气,反应过程中转移电子的数目为
④氯气通入石灰乳中可以制得漂白粉,氯气被氧化得到的产物是
 的个数比为1∶3,则被氧化与被还原的氯气物质的量之比为
的个数比为1∶3,则被氧化与被还原的氯气物质的量之比为
您最近一年使用:0次
8 . 钼酸铵[(NH4)2MoO4]是生产高纯度钼制品、钼催化剂、钼颜料等的基本原料。一种以钼精矿(主要含MoS2,还含有少量SiO2、As、Sn、P、Cu、Pb、CaO)为原料制备钼酸铵的工艺流程如图所示:

已知:钼盐溶液中含钼物种之间的平衡关系为: 回答下列问题:
回答下列问题:
(1)(NH4)2MoO4中Mo元素的化合价为_______ 价。
(2)“氧化焙烧”时MoS2转化为MoO3,该反应中氧化剂与还原剂的物质的量之比为_______ ;气体A对环境的主要危害是_______ 。
(3)“除铜”时选择在60~80℃的条件下进行的原因为_______ 。
(4)“沉淀”过程中加入H2SO4调节溶液pH=2.1,则所得沉淀的化学式为_______ ,加入氨水后生成(NH4)2MoO4的化学方程式为_______ 。
(5)(NH4)6Mo7O24·4H2O的热重曲线如图所示:

已知A点失重的原因是生成H2O,则1 mol (NH4)6Mo7O24·4H2O在A点失去H2O的物质的量为_______ ,B点所得的物质为_______ (填化学式)。

已知:钼盐溶液中含钼物种之间的平衡关系为:
 回答下列问题:
回答下列问题:(1)(NH4)2MoO4中Mo元素的化合价为
(2)“氧化焙烧”时MoS2转化为MoO3,该反应中氧化剂与还原剂的物质的量之比为
(3)“除铜”时选择在60~80℃的条件下进行的原因为
(4)“沉淀”过程中加入H2SO4调节溶液pH=2.1,则所得沉淀的化学式为
(5)(NH4)6Mo7O24·4H2O的热重曲线如图所示:

已知A点失重的原因是生成H2O,则1 mol (NH4)6Mo7O24·4H2O在A点失去H2O的物质的量为
您最近一年使用:0次
2022-03-02更新
|
480次组卷
|
3卷引用:山东省菏泽市单县第二中学2022-2023学年高三下学期开学第一次模拟考试化学试题
山东省菏泽市单县第二中学2022-2023学年高三下学期开学第一次模拟考试化学试题广东省茂名市五校联盟2021-2022学年高三下学期第三次联考化学试卷(已下线)二轮专题强化练 大题突破3 无机化工流程题题型研究
9 . 探究小组在实验室里按如下流程用BaSO4制备BaCl2,下列说法正确的是
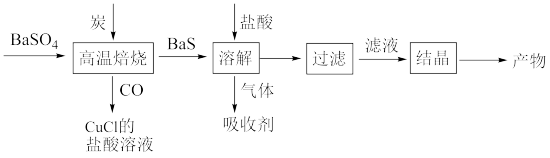

| A.炭与BaSO4的反应中,氧化剂与还原剂物质的量之比为1:2 |
| B.吸收CO所得产物Cu2Cl2·2CO·2H2O中存在配位键 |
| C.可以选择硫酸铜溶液或NaOH溶液作“吸收剂” |
| D.“高温焙烧”和“结晶”两处操作均需要蒸发皿 |
您最近一年使用:0次
解题方法
10 . F2和 Xe 在一定条件下可生成氧化性极强且极易水解的 XeF2、XeF4和 XeF6三种化合物。其中 XeF4与水可发生如下反应:6XeF4+12H2O═2XeO3+4Xe↑+24HF+3O2↑。下列判断中不正确的 是
| A.XeF2、XeF4和 XeF6都不能在空气中长期存放 |
| B.XeF6分子中 Xe 的化合价为+6 价 |
| C.XeF4按已知方式水解,反应中氧化剂和还原剂的物质的量之比为 1∶2 |
| D.XeF4按已知方式水解,反应中每生成 3molO2,转移 12mol 电子 |
您最近一年使用:0次
2021-10-19更新
|
76次组卷
|
2卷引用:山东省鄄城县实验中学2021-2022学年高三上学期第一次月考化学试卷题



