 ;
;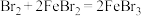 装置如下图所示。
装置如下图所示。
(1)
 与浓盐酸反应的化学方程式
与浓盐酸反应的化学方程式(2)实验时,先点燃A处的酒精灯,让Cl2充满装置,再点燃D处酒精灯,写出D中反应的化学方程式:
(3)有关上述实验的说法正确的是___________。
| A.实验开始后,D中现象:产生棕黄色烟雾 |
B.0.4mol浓盐酸与足量的 充分反应,反应中转移的电子数为 充分反应,反应中转移的电子数为 |
C.氯气可用于制漂白粉,漂白粉的有效成分为 和 和 |
D.少量氯水与 溶液反应的离子方程式为:Cl2+2Fe2+=2Fe3++ Cl- 溶液反应的离子方程式为:Cl2+2Fe2+=2Fe3++ Cl- |
(4)F装置所起的作用是
(5)用收集满氯气的D做如图1的实验:先添加适量的蒸馏水,振荡,然后用注射器滴加
 溶液,再用注射器滴加稀盐酸,用压强传感器测得集气瓶内的压强随时间变化的曲线如图2所示。下列说法正确的是___________(加入的
溶液,再用注射器滴加稀盐酸,用压强传感器测得集气瓶内的压强随时间变化的曲线如图2所示。下列说法正确的是___________(加入的 液体和盐酸溶液的体积对压强的影响忽略不计)
液体和盐酸溶液的体积对压强的影响忽略不计)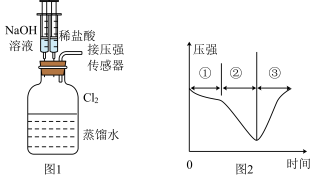
A.阶段①说明 溶于水,溶于水的 溶于水,溶于水的 全部与水反应 全部与水反应 |
B.阶段②的压强变小,说明 被 被 溶液完全吸收 溶液完全吸收 |
C.阶段③发生反应的离子方程式为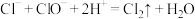 |
D.若将 换成 换成 ,所得的压强变化趋势可能与图2相似 ,所得的压强变化趋势可能与图2相似 |
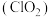 是一种新型的消毒杀剂,常用于饮用水的消毒,其消市效果优于传统的液氯消毒,除此之外,二氧化氯还具有漂白性,常用干纸浆和纸、纤维、小麦面粉、淀粉的漂白。常温常压下
是一种新型的消毒杀剂,常用于饮用水的消毒,其消市效果优于传统的液氯消毒,除此之外,二氧化氯还具有漂白性,常用干纸浆和纸、纤维、小麦面粉、淀粉的漂白。常温常压下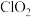 是一种带有辛辣气味的黄绿色气体,易溶于水和四氯化碳。工业上常用综合法制备
是一种带有辛辣气味的黄绿色气体,易溶于水和四氯化碳。工业上常用综合法制备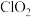 ,其工序包括制备氯酸钠,盐酸合成和
,其工序包括制备氯酸钠,盐酸合成和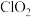 制取,主要工艺流程如图所示。
制取,主要工艺流程如图所示。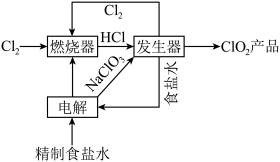
回答下列问题:
(1)工艺流程图涉及到的物质化学式或物质名称,其中能导电的是
(2)实验室模拟“燃烧器”中发生的反应,观察到的现象有
(3)“发生器”中发生反应的离子方程式为
 ,则理论上分别向装置中补充
,则理论上分别向装置中补充(4)粗盐中常常含有泥沙、
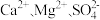 等杂质,粗盐提纯的步骤中加入稍过量的
等杂质,粗盐提纯的步骤中加入稍过量的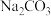 的目的是
的目的是 同时还会获取轻质燃料氢气,则离子方程式为
同时还会获取轻质燃料氢气,则离子方程式为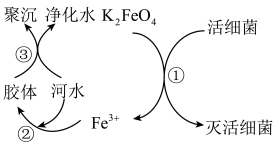
(1)K2FeO4的电离方程式
(2)根据上述原理分析,作水处理剂时,K2FeO4的作用有
(3)制备高铁酸钾常用的反应原理为:Fe(OH)3+KClO+KOH→K2FeO4+KCl+H2O(反应未配平)。
①通过该反应说明:在碱性条件下,氧化性KClO
A.大于 B.小于 C.等于 D.无法比较
②配平该反应的化学方程式,并用
世界环保联盟要求ClO2逐渐取代Cl2作为自来水消毒剂
已知:NaCl+3H2O
 NaClO3+3H2↑
NaClO3+3H2↑发生器:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
ClO2的生产流程示意图如图:
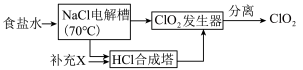
(4)该工艺中,需要补充的物质X为
(5)能参与循环的物质是
已知:ClO2是极易溶于水的气体,具有强氧化性。用如图装置探究ClO2性质。回答下列问题:
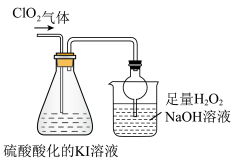
(6)锥形瓶内ClO2进气导管不伸入液面以下,原因是
(7)烧杯内液体用于吸收尾气,若反应的氧化产物是一种单质,且氧化剂与氧化产物的物质的量之比是2:1,则还原产物的化学式是
反应后向锥形瓶中加入少量四氯化碳,溶液上下分层,下层为紫红色
已知:I2+Na2S=2NaI+S
(8)若将锥形瓶内溶液改为Na2S溶液,通入ClO2后溶液无明显现象。由此可以产生两种假设:
假设a:ClO2与Na2S不反应。假设b:ClO2与Na2S反应。
①你认为哪种假设正确,阐述原因:
②请设计实验证明你的假设(仅用离子方程式表示):
I.含氯物质在生产生活中有重要作用。1774年,舍勒在研究软锰矿(主要成分是
 )的过程中,将它与浓盐酸混合加热,产生了一种黄绿色气体。1810年,戴维确认这是一种新元素组成的单质,并命名为chlorine(中文命名“氯气”)。
)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色气体。1810年,戴维确认这是一种新元素组成的单质,并命名为chlorine(中文命名“氯气”)。(1)实验室沿用舍勒的方法制取
 的化学方程式为
的化学方程式为(2)氢气在氯气中燃烧时现象是
(3)实验室制取干燥
 时,净化与收集
时,净化与收集 所需装置的接口连接顺序为
所需装置的接口连接顺序为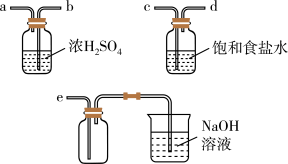
(4)其中饱和食盐水的作用为
(5)某氯水久置后不能使品红溶液褪色,可推测氯水中
 存在的操作及现象是
存在的操作及现象是II.关于
 和的热稳定性研究。
和的热稳定性研究。观察到的实验现象如下表所示:

| 物质 | 装置B中现象 | 装置C中现象 |
 | 无明显变化 | 开始断断续续产生气泡,后没有气泡,溶液保持澄清 |
 | 白色粉末变蓝色 | 开始断断续续产生气泡,后产生连续气泡,溶液变浑浊 |
(6)加热
 时,装置C中产生气泡的原因是
时,装置C中产生气泡的原因是(7)加热
 发生反应的化学方程式为
发生反应的化学方程式为(8)将(5)中久制氯水加入NaHCO3固体中反应的离子方程式为
第一阶段:制备HgO。
配制15%的NaCl溶液和30%的HgC12溶液,将二者以一定质量比混合得到5%NaCl和20%HgC12的混合液;在室温下,边搅拌边缓慢地向混合液中加入过量NaOH溶液,生成黄色沉淀;将沉淀反复洗涤数次,直至没有氯离子;真空抽滤后将沉淀物在暗处干燥,得到干燥的HgO。
(1)配制15%NaCl溶液,除用到托盘天平和烧杯、玻璃棒外,还需要的玻璃仪器有
(2)配制混合液时,15%NaCl溶液和30%HgC12溶液的质量比为
(3)检验沉淀已经洗涤至没有氯离子的操作及现象为
第二阶段:制备C12O。
制备干燥、纯净的C12;然后在干燥氮气的气流中,用C12和HgO在18~20℃条件下制备C12O;将产生的C12O气体“固化”;最后进行尾气处理。
(4)将干燥、纯净的C12通入下面装置中制备C12O并“固化”。

①制备C12O时还得到了HgC12·HgO固体,则装置I中制备反应的化学方程式为
②常用冷却剂的数据如下表。“固化”时装置II中的冷却剂为
| 物质 | O2 | CO2 | NH3 | Cl2 |
| 熔点/℃ | -218.4 | -78.5 | -77.3 | -101 |
| 沸点/℃ | -183 | 升华 | -33.35 | -34.6 |

(1)、B在A中燃烧的实验现象为
(2)、实验室可用C的浓溶液与一种黑色粉末反应制取A,该反应的离子方程式
(3)、E和F反应生成D、H和G的化学方程式为

①D气体不能用排水法收集
②实验室用E一种药品可以制取D
③右图中的a为浸有稀H2SO4的棉花
④可用D的浓溶液和生石灰为原料制取D
(1)实验目的:探究同一主族元素性质的递变规律。
(2)实验用品
仪器:试管、胶头滴管
药品:新制氯水、新制溴水、溴化钠溶液、碘化钠溶液、四氯化碳
(3)实验内容(在下表横线上填写相关内容)
| 序号 | 实验方案 | 实验现象 |
| ① | 向盛有少量溴化钠溶液的试管中滴加少量新制氯水,振荡,再加入少量四氯化碳,振荡后静置 | 液体分为两层,下层呈 |
| ② | 向盛有少量碘化钠溶液的试管中滴加少量新制溴水,振荡,再加入少量四氯化碳,振荡后静置 | 液体分为两层,下层呈 |
(4)写出上述实验②中发生反应的离子方程式:
(5)实验结论:

请回答下列问题:
(1)写出 D 的名称
(2)反应③,F 在 A 中点燃的反应现象为
(3)写出反应④的化学方程式,并用“双线桥”表示电子转移的方向和数目:
 是一种新型绿色消毒剂,主要用于饮用水处理。如图所示物质转化关系为高铁酸钠的一种制备方法及有关性质实验(部分反应产物已略去)。已知A、F为非金属单质气体,B为常见金属单质,E为生活中最常见的调味品,F在标准状况下密度为0.090g/L。
是一种新型绿色消毒剂,主要用于饮用水处理。如图所示物质转化关系为高铁酸钠的一种制备方法及有关性质实验(部分反应产物已略去)。已知A、F为非金属单质气体,B为常见金属单质,E为生活中最常见的调味品,F在标准状况下密度为0.090g/L。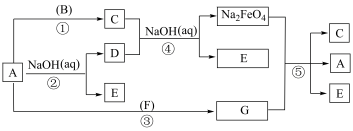
请回答下列问题:
(1)D是一种消毒液的主要成分,写出D的名称
 中Fe元素的化合价为
中Fe元素的化合价为(2)利用C的饱和溶液可以配制与C溶液不同类型分散系,可利用
(3)反应③,F在A中点燃的反应现象为:
(4)写出反应④的化学方程式:
(5)反应⑤中氧化剂和还原剂的物质的量之比为:
10 . 自来水厂常用氯气来杀菌消毒,某班学生对氯气的制取、性质、用途进行如下探究。
【查阅资料】氯气(Cl2)是黄绿色有刺激性气味的有毒气体,它的密度比空气大,可溶于水生成盐酸和次氯酸(HClO)。
【探究一】制取氯气
(1)实验室常用二氧化锰固体和浓盐酸加热制取氯气,请写出该反应的化学方程式:
(2)下图中仪器①的名称是

【探究二】氯气的性质
(3)小明用如图装置探究氯气的漂白性:

实验步骤:
I.将滴管内的蒸馏水滴到B瓶中的干燥有色布条上,布条没有褪色;
II.通入干燥的Cl2,发现A瓶中的布条没有褪色,而B瓶中的布条褪色。
①通过上述实验,小明能得到的结论是
②小颖根据查阅的资料信息,补充做了一个实验:
③小明同学认为,如图实验装置中有一个明显的缺陷,该装置的不足之处是
(4)小星用如图装置探究氯气的助燃性:

实验步骤:
I.用锌粒和稀硫酸在C装置中制取氢气,请写出该反应的化学方程式:
II.先
III.将燃着的氢气导管缓缓伸到装满氯气的集气瓶D中,观察到氢气继续燃烧并产生苍白色火焰。请写出该反应的化学方程式:
实验反思:小星发现氢气在氯气中燃烧时,集气瓶D瓶口上方有大量白雾,你认为产生白雾的可能原因是



