解题方法
1 . Na 、Fe 、C1是中学化学常见的元素。回答下列问题:
(1)含上述元素的常见化合物中,呈淡黄色的是________________ (填化学式,下同),铁与水蒸气反应后的固体产物_________________ 。
(2)工业上将氯气通入石灰乳制取漂白粉,写山该反应的化学方程式_________________ 。
(3)焰色反应的实验中,铂丝的清洗需要用到_________________ ,观察K元素燃烧时的焰色需要透过_________________ 。
(4)实验室在制备Fe(OH)2时必须隔绝空气,否则发生的现象_________________ 。
(5)MgO与碳粉和氯气在一定条件下反应可制备MgCl2。若尾气可用足量NaOH溶液完全吸收,则生成的盐为(写化学式)_________________ 。
(6)由NO、H2、CO2组成的混合气体,先通过足量的Na2O2充分反应后,再将混合气体用电火花引燃,充分反应后最终只得到质量分数为70%的硝酸,无其他气体剩余。则原混合气体中NO、H2、CO2的体积比_________________ 。
(1)含上述元素的常见化合物中,呈淡黄色的是
(2)工业上将氯气通入石灰乳制取漂白粉,写山该反应的化学方程式
(3)焰色反应的实验中,铂丝的清洗需要用到
(4)实验室在制备Fe(OH)2时必须隔绝空气,否则发生的现象
(5)MgO与碳粉和氯气在一定条件下反应可制备MgCl2。若尾气可用足量NaOH溶液完全吸收,则生成的盐为(写化学式)
(6)由NO、H2、CO2组成的混合气体,先通过足量的Na2O2充分反应后,再将混合气体用电火花引燃,充分反应后最终只得到质量分数为70%的硝酸,无其他气体剩余。则原混合气体中NO、H2、CO2的体积比
您最近一年使用:0次
名校
2 . Cl2、HCl的混合气体通入足量的NaOH溶液,充分反应后,溶液中除大量OH-外,还有Cl-、ClO-、 ClO3- ,且这三种离子的物质的量之比为9:2:1,则原混合气体中Cl2和HCl体积之比为
| A.5:2 | B.2:5 | C.3:1 | D.1:3 |
您最近一年使用:0次
2016-12-09更新
|
1494次组卷
|
7卷引用:2015-2016学年江苏省泰州市姜堰区高二上学期期中必修化学试卷
名校
3 . 将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示。下列说法不正确的是
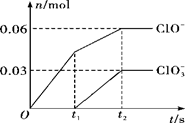

| A.Cl2和苛性钾溶液在不同温度下可能发生不同反应 |
| B.反应中转移电子数为是0.21 NA |
| C.原苛性钾溶液中KOH的物质的量无法确定 |
| D.生成物中Cl- 的物质的量为 0.21 mol |
您最近一年使用:0次
2016-12-09更新
|
539次组卷
|
4卷引用:2014-2015江西省临川市第一中学高一上学期期末化学试卷
解题方法
4 . 现有短周期元素X形成的单质A与NaOH溶液反应,有如下转化关系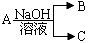 ,(若产物中有水生成则省略未表示出来)。
,(若产物中有水生成则省略未表示出来)。
(1)若常温常压下,A为气态,且B、C中均有X元素,则A与NaOH溶液反应的离子方程式为__ ;
(2)若常温常压下,A为非金属固态单质,且其在电子工业中有着重要的用途,则工业制取A化学方程式为__ ;
(3)若A为金属,C为气体,则A 与NaOH溶液反应的离子方程式为_____
(4)由(2)和(3)中两种单质形成合金在工业、建筑业中有重要的用途。一个探究性学习小组,他们拟
用该合金与足量稀硫酸的反应测定通常状况下气体摩尔体积,实验装置如下:

①装置中导管a的作用是平衡分液漏斗上下管口的压强,有利于液体滴下和____ ;
②实验中准确测得4个数据:实验前该合金的质量m1g,实验后残留固体的质量m2g,实验前后碱式滴定管中液面读数分别为V1mL、V2mL;则通常状况时气体摩尔体积Vm=_____ L·moL-1。
 ,(若产物中有水生成则省略未表示出来)。
,(若产物中有水生成则省略未表示出来)。(1)若常温常压下,A为气态,且B、C中均有X元素,则A与NaOH溶液反应的离子方程式为
(2)若常温常压下,A为非金属固态单质,且其在电子工业中有着重要的用途,则工业制取A化学方程式为
(3)若A为金属,C为气体,则A 与NaOH溶液反应的离子方程式为
(4)由(2)和(3)中两种单质形成合金在工业、建筑业中有重要的用途。一个探究性学习小组,他们拟
用该合金与足量稀硫酸的反应测定通常状况下气体摩尔体积,实验装置如下:

①装置中导管a的作用是平衡分液漏斗上下管口的压强,有利于液体滴下和
②实验中准确测得4个数据:实验前该合金的质量m1g,实验后残留固体的质量m2g,实验前后碱式滴定管中液面读数分别为V1mL、V2mL;则通常状况时气体摩尔体积Vm=
您最近一年使用:0次
2016-12-09更新
|
416次组卷
|
2卷引用:2015-2016学年福建省厦门一中高一下期中化学试卷
11-12高三下·上海浦东新·阶段练习
名校
5 . 将一定量的氯气通入30 mL浓度为10.00 mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系。下列判断不正确的是
| A.与NaOH反应的氯气一定为0.15 mol |
| B.n(Na+)∶n(Cl-) 可能为7∶3 |
| C.若反应中转移的电子为n mol,则n一定大于0.15 mol |
| D.n(NaCl)∶n(NaClO)∶n(NaClO3)可能为7∶2∶1 |
您最近一年使用:0次
9-10高一下·江苏扬州·期末
6 . 将1 mol氧气和一定量的HCl放入2L的密闭容器中,420℃时,在催化剂作用下发生反应:4HCl+O2 2Cl2+2H2O。5分钟后反应达到平衡,将容器中的混合气体通过过量NaOH溶液,消耗NaOH 2.0 mol;再将剩余气体干燥后通过焦性没食子酸的碱性溶液吸收O2,溶液增重19.2 g。
2Cl2+2H2O。5分钟后反应达到平衡,将容器中的混合气体通过过量NaOH溶液,消耗NaOH 2.0 mol;再将剩余气体干燥后通过焦性没食子酸的碱性溶液吸收O2,溶液增重19.2 g。
请回答下列问题:
(1)写出平衡时,混合气体通入NaOH溶液中所发生反应的离子方程式为_________ 。
(2)计算0~5分钟时,Cl2的平均生成速率是________ 。
(3)计算平衡时HCl的转化率是________ 。
 2Cl2+2H2O。5分钟后反应达到平衡,将容器中的混合气体通过过量NaOH溶液,消耗NaOH 2.0 mol;再将剩余气体干燥后通过焦性没食子酸的碱性溶液吸收O2,溶液增重19.2 g。
2Cl2+2H2O。5分钟后反应达到平衡,将容器中的混合气体通过过量NaOH溶液,消耗NaOH 2.0 mol;再将剩余气体干燥后通过焦性没食子酸的碱性溶液吸收O2,溶液增重19.2 g。请回答下列问题:
(1)写出平衡时,混合气体通入NaOH溶液中所发生反应的离子方程式为
(2)计算0~5分钟时,Cl2的平均生成速率是
(3)计算平衡时HCl的转化率是
您最近一年使用:0次



