名校
1 . 下列离子组在一定条件下能大量共存,且加入相应试剂后所对应的离子方程式正确的是
| 选项 | 离子组 | 加入试剂 | 加入试剂后发生反应的离子方程式 |
| A |  、 、 、 、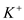 | 稀硫酸 | 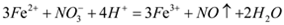 |
| B |  、 、 、 、 | 氢氧化钠溶液 | 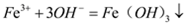 |
| C |  、 、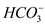 、 、 | 氢氧化钠溶液 | 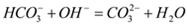 |
| D |  、 、 、 、 | 过量氢氧化钠溶液 | 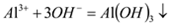 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2018-02-28更新
|
996次组卷
|
2卷引用:河南省六市2017届高三下学期第一次联考理综化学试题
名校
2 . 如图所示,将Ⅰ阀关闭,Ⅱ阀打开,让一种含氯气的气体经过甲瓶后,通入乙瓶,布条不褪色;若关闭Ⅱ阀打开Ⅰ阀,再通入这种气体,布条褪色.甲瓶中所盛的试剂可能是
①浓硫酸 ②饱和氯化钠溶液 ③NaOH溶液 ④饱和碳酸钠溶液 ⑤水
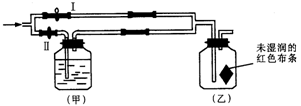
①浓硫酸 ②饱和氯化钠溶液 ③NaOH溶液 ④饱和碳酸钠溶液 ⑤水

| A.①③ | B.②⑤ | C.②③⑤ | D.①③④ |
您最近一年使用:0次
2017-10-21更新
|
699次组卷
|
4卷引用:安徽省淮北市第一中学2017-2018学年高一上学期第一次(10月)月考化学试题
名校
3 . 下列与处理方法对应的反应方程式不正确的是
| A.用石灰水中和酸性废水:H++OH-=H2O |
B.用催化法处理汽车尾气中的CO和NO:2CO+2NO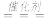 CO2+N2 CO2+N2 |
| C.用烧碱溶液去除多余的氯气:Cl2+OH-=Cl-+HClO |
D.用高温催化氧化法去除烃类废气(CxHy):CxHy+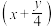 O2 O2 xCO2+ xCO2+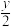 H2O H2O |
您最近一年使用:0次
4 . 实验室可以用浓盐酸与二氧化锰在加热的条件下反应生成二氯化锰与氯气,纯净的氯气和铁粉反应制取少量氯化铁固体,其反应装置示意图如图,回答下列问题:
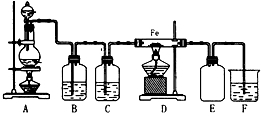
(1)A装置可制取氯气,反应前分液漏斗中药品为__ .
(2)写出A装置中制取氯气所发生的化学方程式是__ .
(3)装置B中盛放的试剂是__ .
(4)装置E的作用是__ .
(5)装置C的作用是__ .
(6)装置F中发生反应的化学方程式是__ .

(1)A装置可制取氯气,反应前分液漏斗中药品为
(2)写出A装置中制取氯气所发生的化学方程式是
(3)装置B中盛放的试剂是
(4)装置E的作用是
(5)装置C的作用是
(6)装置F中发生反应的化学方程式是
您最近一年使用:0次
名校
5 . 常温下,将Cl2缓慢通入水中至饱和,然后再滴加0.1 mol·L-1的NaOH溶液,整个过程中溶液的pH变化曲线如图所示。下列选项正确的是
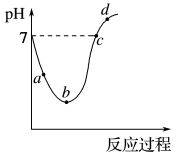

| A.a点所示的溶液中c(H+)=c(Cl-)+c(HClO)+c(OH-) |
| B.b点所示的溶液中c(H+)>c(Cl-)>c(HClO)>c(ClO-) |
| C.c点所示的溶液中c(Na+)=c(HClO)+c(ClO-) |
| D.d点所示的溶液中c(Na+)>c(ClO-)>c(Cl-)>c(HClO) |
您最近一年使用:0次
2017-06-26更新
|
1288次组卷
|
9卷引用:2017届河南省南阳一中高三上第二次月考化学试卷
2017届河南省南阳一中高三上第二次月考化学试卷苏教版高三单元精练检测八化学试题云南省玉溪第一中学2017-2018学年高二上学期期末考试化学试题【全国百强校】云南省玉溪市第一中学2018-2019学年高二上学期第二次月考化学试题夯基提能2020届高三化学选择题对题专练——选修4化学反应原理——酸碱中和滴定的综合考察及拓展应用夯基提能2020届高三化学选择题对题专练——选修4化学反应原理——酸碱中和滴定(基础过关)安徽省合肥市一六八中学2019-2020学年高二上学期期末考试化学试题福建省三明市德化一中、漳平一中、永安一中三校协作2020-2021学年高二12月联考化学试题(已下线)3.3.2 溶液中离子浓度大小的比较-同步学习必备知识
名校
6 . 按要求填空:
(1)原子核外有3个电子层,其价电子数为7的元素其最高价氧化物对应水化物化学式________ ,其单质与NaOH反应的化学方程式为____________________________________________________ 。
(2)已知X+、Y2+、Zˉ、W2ˉ四种离子均具有相同的电子层结构,则X、Y、Z、W这四种元素的原子序数由大到小的顺序是___________________ ,原子半径由大到小的顺序是__________________ 。
(3) A+、Bˉ、C、D 四种粒子(分子或离子),它们都分别含10个电子,已知它们有如下转化关系:A++Bˉ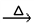 C+D↑,则A+、Bˉ的电子式:
C+D↑,则A+、Bˉ的电子式:_____________ ,______________ ;比较C和D的稳定性的强弱:_____________________ (用化学式表示)。
(4)①NH4NO3 ②NaF ③CO2 ④K2O2 ⑤NaOH ⑥CH4
以上只含有极性键的是_______ (填序号),既有离子键又有非极性键的是______ (填序号);既有离子键又有极性键的是______ (填序号)。
(5)下列原子: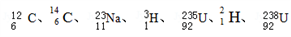 中共有
中共有____ 种元素,__ 种核素。
(6)写出下列物质或微粒的电子式:
①CO2__________ ②KCl_____________ ③H2O2_______________ ④N2_____________ ;
⑤用电子式表示MgCl2的形成过程_________________________________________________ 。
(1)原子核外有3个电子层,其价电子数为7的元素其最高价氧化物对应水化物化学式
(2)已知X+、Y2+、Zˉ、W2ˉ四种离子均具有相同的电子层结构,则X、Y、Z、W这四种元素的原子序数由大到小的顺序是
(3) A+、Bˉ、C、D 四种粒子(分子或离子),它们都分别含10个电子,已知它们有如下转化关系:A++Bˉ
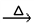 C+D↑,则A+、Bˉ的电子式:
C+D↑,则A+、Bˉ的电子式:(4)①NH4NO3 ②NaF ③CO2 ④K2O2 ⑤NaOH ⑥CH4
以上只含有极性键的是
(5)下列原子:
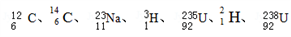 中共有
中共有(6)写出下列物质或微粒的电子式:
①CO2
⑤用电子式表示MgCl2的形成过程
您最近一年使用:0次
名校
7 . 工业上,向500℃左右的铁屑中通入Cl2生产无水氯化铁,其制备过程中均要确保无水。现模拟该过程用图示装置进行实验:
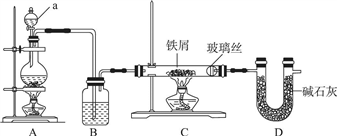
(1)仪器a的名称为________ ,装置A的圆底烧瓶中发生反应的化学方程式为________ ,为保持装置C为无水环境,装置B中加入的试剂是________ 。
(2)实验步骤:如图连接装置后,先________ (填实验操作),再装药品,然后点燃________ (填“A”或“C”)处酒精灯,当________ (填实验现象)时,再点燃________ (填“A”或“C”)处酒精灯。
(3)装置D的作用是________ ,________ 。
(4)甲同学认为进入装置C的气体中混有HCl,应在装置B前增加装有________ (填试剂名称)的洗气装置除去;乙同学认为不需要除去HCl,理由为________ 。

(1)仪器a的名称为
(2)实验步骤:如图连接装置后,先
(3)装置D的作用是
(4)甲同学认为进入装置C的气体中混有HCl,应在装置B前增加装有
您最近一年使用:0次
2017-03-11更新
|
589次组卷
|
2卷引用:2016-2017学年河北省张家口市高一上学期期末考试化学试卷
名校
解题方法
8 . 高铁酸钾(K2FeO4)具有强氧化性,可作为水处理剂和高容量电池材料。工业上生产高铁酸钾的工艺流程如下:

已知K2FeO4具有下列性质:①可溶于水,微溶于KOH溶液,难溶于异丙醇;②在0℃-5℃,强碱性溶液中比较稳定;③在Fe3+和Fe(OH)3催化作用下发生分解;④在酸性至弱碱性条件下,能与水反应生成Fe(OH)3和O2
请完成下列填空:
(1)已知Cl2与KOH在低温下可制得KClO,请写出化学反应方程式____________ 。
(2)在“反应液Ⅰ”中加KOH固体的目的是____________________ 。
(3)生产K2FeO4的化学反应方程式为________________ ,制备K2FeO4时,须将Fe(NO3)3溶液缓慢滴加到碱性的KClO浓溶液中,并且不断搅拌,采用这种混合方式的原因是___________________ 。
(4)请补充完整由“反应液Ⅱ”得到K2FeO4晶体的实验步骤。(可选用的试剂:NaOH溶液、KOH溶液、蒸馏水和异丙醇)
① 向反应液Ⅱ中加入饱和________ ,在冰水浴中静置结晶后过滤,得K2FeO4粗产品;
② 将K2FeO4粗产品溶解在___________ 中,再次在冰水浴中静置结晶后过滤,得到较纯净的K2FeO4;
③ 将K2FeO4晶体再用少量__________ 洗涤,低温真空干燥,得到高铁酸钾成品。
(5)从“反应液Ⅱ”中分离出K2FeO4晶体后,可以得到的副产品有_________ (写化学式)。

已知K2FeO4具有下列性质:①可溶于水,微溶于KOH溶液,难溶于异丙醇;②在0℃-5℃,强碱性溶液中比较稳定;③在Fe3+和Fe(OH)3催化作用下发生分解;④在酸性至弱碱性条件下,能与水反应生成Fe(OH)3和O2
请完成下列填空:
(1)已知Cl2与KOH在低温下可制得KClO,请写出化学反应方程式
(2)在“反应液Ⅰ”中加KOH固体的目的是
(3)生产K2FeO4的化学反应方程式为
(4)请补充完整由“反应液Ⅱ”得到K2FeO4晶体的实验步骤。(可选用的试剂:NaOH溶液、KOH溶液、蒸馏水和异丙醇)
① 向反应液Ⅱ中加入饱和
② 将K2FeO4粗产品溶解在
③ 将K2FeO4晶体再用少量
(5)从“反应液Ⅱ”中分离出K2FeO4晶体后,可以得到的副产品有
您最近一年使用:0次
10-11高一上·浙江杭州·期中
名校
9 . 某温度下,将氯气通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合溶液(已知氯气和NaOH在一定温度下能发生反应:3Cl2+6NaOH=5NaCl+NaClO3+3H2O),经测定ClO—与ClO3—的物质的量之比为1∶3,则氯气与氢氧化钠反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为
| A.21∶5 | B.11∶3 | C.3∶1 | D.4∶1 |
您最近一年使用:0次
2017-01-06更新
|
1171次组卷
|
7卷引用:2010年浙江省杭州市七校高一上学期期中考试化学卷
(已下线)2010年浙江省杭州市七校高一上学期期中考试化学卷(已下线)2011年河南省卫辉市第一中学高一上学期期末质量检测化学试卷2016-2017学年山西省怀仁一中高一上月考三化学卷夯基提能2020届高三化学选择题对题专练——常见无机物及其性质应用——氯及其化合物 (强化练)安徽省宣城二中2019-2020学年高一第二学期寒假网上开学考试化学试题北京市中国人民大学附属中学2021-2022学年高一上学期期中考试化学试题黑龙江省佳木斯市第一中学2021-2022学年高一上学期12月月考化学试题
10 . 下图中A~H均为中学化学中常见的物质,A、B、H是气体,它们之间有如下转化关系(反应中生成的水已略去)。
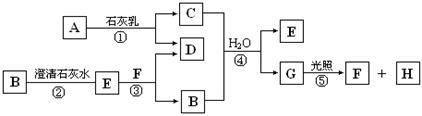
请回答以下问题:
(1)E是_________ (填化学式),G是__________ (填名称);
(2)C物质在日常生活中可作_______________ ;
(3)写出反应①的化学方程式________________ ;
C与浓盐酸反应,可以生成A气体,写出反应的化学方程式___________________ 。

请回答以下问题:
(1)E是
(2)C物质在日常生活中可作
(3)写出反应①的化学方程式
C与浓盐酸反应,可以生成A气体,写出反应的化学方程式
您最近一年使用:0次
2016-12-09更新
|
490次组卷
|
2卷引用:2016-2017学年浙江省嘉兴一中高一上期中化学试卷



