名校
解题方法
1 . “84消毒液”广泛应用于杀菌消毒,其有效成分是NaClO。实验小组制备消毒液,并利用其性质探索制备碘水的方法。
资料:i.HClO的电离常数为Ka=4.7×10-8;
H2CO3的电离常数为K1=4.3×10-7、K2=5.6×10-11。
ii.碘的化合物主要以I-和IO3-的形式存在,IO3-+5I-+6H+=3I2+3H2O。
iii.碘单质能与I-反应:I2+I- I3-(I3-低浓度时显黄色,高浓度时为棕色)。
I3-(I3-低浓度时显黄色,高浓度时为棕色)。
Ⅰ.制备消毒液(夹持装置略)
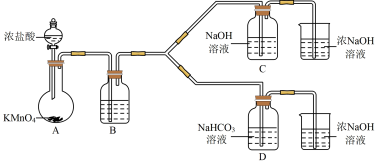
(1)制备NaClO消毒液的装置是__________ (填C或D)。
(2)制备完成后,向C装置的溶液中添加NaOH、Na2SiO3等物质,得到与某品牌成分相同的消毒液,用平衡移动原理解释NaOH的作用___________________ 。
(3)结合资料i,写出D中反应的化学方程式______________________ 。
Ⅱ.利用消毒液的性质探究碘水的制备方法
将某品牌“84消毒液”稀释10倍,各取100mL于三个烧杯中,设计如下实验方案制备碘水:
(4)对比不同方案的实验现象,得出制取碘水的最佳方法要关注的因素是________ 。
(5)针对烧杯3“滴加淀粉溶液不变蓝”的原因,提出两种假设:
假设1:过量的NaClO将反应生成的I2氧化为IO3-。
设计实验证实了假设1成立。NaClO氧化I2生成IO3-的离子方程式是_____________ 。
假设2:生成的I2在碱性溶液中不能存在。
设计实验a证实了假设2成立,实验a的操作及现象是______________________ 。
(6)某小组检验烧杯3所得溶液中含IO3-:取烧杯3所得无色溶液少许,加入稀硫酸酸化的KI溶液,反应后再滴加淀粉溶液,发现溶液变蓝。该实验方案能否证明烧杯3所得溶液中存在IO3-,说明理由______________________ 。
(7)预测烧杯1反应后加淀粉溶液的实验现象,结合方程式说明预测依据________ 。
资料:i.HClO的电离常数为Ka=4.7×10-8;
H2CO3的电离常数为K1=4.3×10-7、K2=5.6×10-11。
ii.碘的化合物主要以I-和IO3-的形式存在,IO3-+5I-+6H+=3I2+3H2O。
iii.碘单质能与I-反应:I2+I-
 I3-(I3-低浓度时显黄色,高浓度时为棕色)。
I3-(I3-低浓度时显黄色,高浓度时为棕色)。Ⅰ.制备消毒液(夹持装置略)

(1)制备NaClO消毒液的装置是
(2)制备完成后,向C装置的溶液中添加NaOH、Na2SiO3等物质,得到与某品牌成分相同的消毒液,用平衡移动原理解释NaOH的作用
(3)结合资料i,写出D中反应的化学方程式
Ⅱ.利用消毒液的性质探究碘水的制备方法
将某品牌“84消毒液”稀释10倍,各取100mL于三个烧杯中,设计如下实验方案制备碘水:
| 方案 | 操作 | 现象 | 反应后加淀粉溶液 |
| 1 | 烧杯1溶液中加入9gKI固体 | 溶液为橙黄色 | …… |
| 2 | 烧杯2溶液中加入9gKI固体再加入1mo/L盐酸10mL | 溶液颜色快速加深,呈紫红色 | 变蓝 |
| 3 | 烧杯3溶液中加入少量KI固体(小于0.5g) | 振荡后溶液保持无色 | 不变蓝 |
(5)针对烧杯3“滴加淀粉溶液不变蓝”的原因,提出两种假设:
假设1:过量的NaClO将反应生成的I2氧化为IO3-。
设计实验证实了假设1成立。NaClO氧化I2生成IO3-的离子方程式是
假设2:生成的I2在碱性溶液中不能存在。
设计实验a证实了假设2成立,实验a的操作及现象是
(6)某小组检验烧杯3所得溶液中含IO3-:取烧杯3所得无色溶液少许,加入稀硫酸酸化的KI溶液,反应后再滴加淀粉溶液,发现溶液变蓝。该实验方案能否证明烧杯3所得溶液中存在IO3-,说明理由
(7)预测烧杯1反应后加淀粉溶液的实验现象,结合方程式说明预测依据
您最近一年使用:0次
2020-05-07更新
|
450次组卷
|
4卷引用:北京市石景山区2020届高三第一次模拟化学试题
北京市石景山区2020届高三第一次模拟化学试题(已下线)北京市2019-2020学年高三各区一模化学考试分类汇编:科学探究北京首都师范大学附属中学2022届高三下学期三模化学试题北京市第八十中学2024届高三上学期10月月考化学试题
名校
解题方法
2 . 通过简单地推理或计算填空。
(1)X原子有两个电子层,K 层电子数是L层电子数的一半,X是_______ (写元素符号)元素。
(2)若某元素形成的简单离子的电子层数和最外层电子数与 Ne原子相同,其可能的离子中半径最小的是__________ (填离子符号)。
(3)元素R能够与某非金属元素 W 形成化合物 RWn,已知 RWn 分子中各原子核外最外层电子总数为26,核外电子数总和为66 ,则 W 是___________ (写元素符号)元素,n=_____________ 。
(4)位于三个不同周期的四种短周期主族元素 A、B、C、D,其部分元素特征信息如下表:
①写出常温下D的单质与A、B、C形成的化合物的稀溶液反应的化学方程式:________________ 。
②D的最高价氧化物对应的水化物与 A、B、C形成的化合物的水溶液反应的离子方程式为________________________ 。
(1)X原子有两个电子层,K 层电子数是L层电子数的一半,X是
(2)若某元素形成的简单离子的电子层数和最外层电子数与 Ne原子相同,其可能的离子中半径最小的是
(3)元素R能够与某非金属元素 W 形成化合物 RWn,已知 RWn 分子中各原子核外最外层电子总数为26,核外电子数总和为66 ,则 W 是
(4)位于三个不同周期的四种短周期主族元素 A、B、C、D,其部分元素特征信息如下表:
| 元素编号 | 元素特征信息 |
| A | 其单质是密度最小的物质 |
| B | 阴离子带两个单位负电荷,其单质是空气的主要成分之一 |
| C | 在短周期主族元素中金属性最强 |
| D | 最高价氧化物对应水化物的酸性最强 |
①写出常温下D的单质与A、B、C形成的化合物的稀溶液反应的化学方程式:
②D的最高价氧化物对应的水化物与 A、B、C形成的化合物的水溶液反应的离子方程式为
您最近一年使用:0次
名校
3 . 某温度下,将氯气通入氢氧化钠溶液中,反应得到氯化钠、次氯酸钠、氯酸钠的混合液,经测定溶液中次氯酸钠和氯酸钠的浓度之比为1:2,则氯气与氢氧化钠溶液反应时被还原的氯元素与被氧化的氯元素的物质的量之比为( )
| A.21:5 | B.4:1 | C.3:1 | D.11:3 |
您最近一年使用:0次
2020-04-02更新
|
633次组卷
|
6卷引用:湖南省师范大学附属中学2017-2018学年高一上学期期末考试化学试题
4 . 在甲、乙两个装置中,胶头滴管中吸入某种液体,烧瓶中充入(或放入)另一种物质,挤压胶头滴管,加入液体,一段时间后两装置中的气球都有明显胀大。则所用试剂分别可能依次是
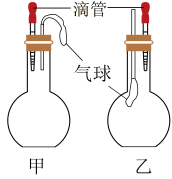

| A.甲:浓硫酸和木炭 乙:浓氨水和SO2 |
| B.甲:双氧水和MnO2乙:饱和食盐水和HCl |
| C.甲:苯酚和Na2CO3溶液 乙:NaOH溶液和Cl2 |
| D.甲:浓硫酸和蔗糖(滴有几滴水) 乙:氯化亚铁溶液和硫化氢 |
您最近一年使用:0次
解题方法
5 . 工业上将Cl2通入KOH热溶液中制取KClO3(混有KClO)。实验室模拟上述制备:向含18mol KOH的溶液中通入Cl2,充分反应后测得溶液中n(Cl-)=12mol,将此溶液低温蒸干,所得到固体中KClO3的物质的量可能为
| A.1.5mol | B.2.1mol | C.2.4 mol | D.3.0 mol |
您最近一年使用:0次
6 . 实验室利用如下装置制备氯酸钾和次氯酸钠。
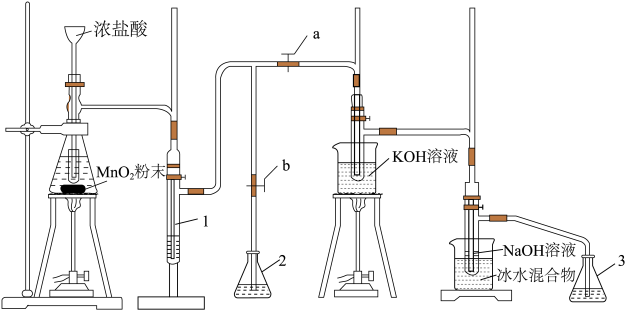
回答下列问题:
(1)滴加浓盐酸的漏斗伸入试管底部,其原因为________________________________ 。
(2)装置1中盛放的试剂为________ ;若取消此装置,对实验造成的影响为________ 。
(3)装置中生成氯酸钾的化学方程式为________________________ ,产生等物质的量的氯酸钾和次氯酸钠,转移电子的物质的量之比为________ 。
(4)装置2和3中盛放的试剂均为________ 。
(5)待生成氯酸钾和次氯酸钠的反应结束后,停止加热。接下来的操作为打开________ (填“a”或“b”,下同),关闭________ 。

回答下列问题:
(1)滴加浓盐酸的漏斗伸入试管底部,其原因为
(2)装置1中盛放的试剂为
(3)装置中生成氯酸钾的化学方程式为
(4)装置2和3中盛放的试剂均为
(5)待生成氯酸钾和次氯酸钠的反应结束后,停止加热。接下来的操作为打开
您最近一年使用:0次
2019-10-12更新
|
599次组卷
|
4卷引用:2019年广东省湛江市高三9月调研考试化学试题
2019年广东省湛江市高三9月调研考试化学试题河北省张家口市宣化区宣化第一中学2021届高三上学期9月月考化学试题(已下线)专题02 卤素元素拓展之实验大题-【微专题·大素养】备战2022年高考化学核心突破(元素拓展综合题)江苏省徐州市2023-2024学年高三第四次模拟考试化学试卷
名校
7 . 常温下①、②两个装有50mL氯气的针筒,分别抽取10mLH2O和10mL15%的NaOH溶液(如图所示),充分振荡后静置,对两针筒中所得溶液描述错误的是
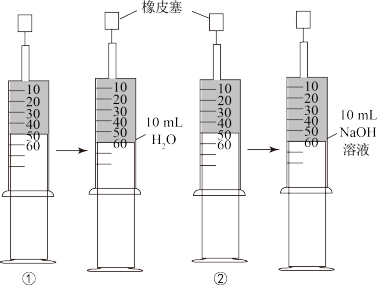

| A | B | C | D | |
| 针筒① | 有颜色 | 有漂白性 | 呈酸性 | 含Cl2分子 |
| 针筒② | 无颜色 | 无漂白性 | 呈碱性 | 无Cl2分子 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2019-06-22更新
|
355次组卷
|
2卷引用:上海市静安区2018-2019学年第二学期教学质量检测高三(二模)化学试卷
解题方法
8 . 下列指定反应的离子方程式正确的是
A.Cl2与热的NaOH溶液反应制取NaClO3: |
B.澄清石灰水与硬水中Mg(HCO3)2反应: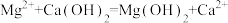 |
C.[Ag(NH3)2]OH与足量盐酸反应生成AgCl: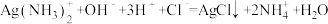 |
D.向FeSO4溶液中滴加碱性NaBH4溶液,生成纳米铁粉、H2和 : :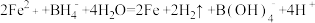 |
您最近一年使用:0次
9 . 已知:将Cl2通入适量KOH溶液,产物中可能有KC1、KClO、KC1O3,且 的值与温度高低有关。当n(KOH)=amol时,下列有关说法错误的是
的值与温度高低有关。当n(KOH)=amol时,下列有关说法错误的是
 的值与温度高低有关。当n(KOH)=amol时,下列有关说法错误的是
的值与温度高低有关。当n(KOH)=amol时,下列有关说法错误的是A.若某温度下,反应后 =11,则溶液中 =11,则溶液中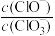 = = |
B.参加反应的氯气的物质的量等于 amol amol |
C.改变温度,反应中转移电子的物质的量ne的范围: amol≤ne≤ amol≤ne≤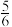 amol amol |
D.改变温度,产物中KC1O3的最大理论产量为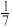 amol amol |
您最近一年使用:0次
2019-01-30更新
|
1820次组卷
|
30卷引用:2014年全国普通高等学校招生统一考试理科综合能力测试化学(全国大纲卷)
2014年全国普通高等学校招生统一考试理科综合能力测试化学(全国大纲卷)(已下线)2013-2014黑龙江省鹤岗一中高二下学期期末考试化学试卷(已下线)2015届江西省金溪一中高三暑期化学试卷(已下线)2015届甘肃省兰州一中高三9月月考化学试卷(已下线)2015届山西省山西大学附中高三上学期第四次月考化学卷2015届河南省开封市高三冲刺模拟考试(5月)化学试卷2016届湖北省仙桃中学高三8月月考(开学摸底)化学试卷2015-2016学年湖北省襄阳一中高一上学期期中测试化学试卷2016-2017学年四川省成都外国语学校高二上入学考试化学试卷黑龙江省齐齐哈尔市第八中学2018届高三第二次月考化学试题河北省定州中学2018届高三承智班上学期第二次月考化学试题安徽省六安市第一中学2018届高三上学期第三次月考化学试题【全国百强校】山东师范大学附属中学2017-2018学年高二下学期第八次学分认定(期末)考试化学试题【全国百强校】浙江省萧山中学2018-2019学年高一下学期2月份摸底考试化学试题【全国百强校】山西省山西大学附属中学2018-2019学年高一下学期2月模块诊断化学试题甘肃省甘谷第一中学2018-2019学年高一下学期子才班选拔考试化学试题(已下线)上海市同济中学2017届高三3月月考化学试题黑龙江省鹤岗市第一中学2019-2020学年高一上学期期中考试化学试题山西省应县第一中学校2019-2020学年高一上学期第四次月考化学试题夯基提能2020届高三化学选择题对题专练——氧化还原反应的实际应用(提升练)上海市奉贤区2015届高三上学期期中调研测试化学试题(已下线)小题必刷08 氧化还原反应的规律及应用——2021年高考化学一轮复习小题必刷(通用版)(已下线)【浙江新东方】89.山东省济宁市实验中学2022届高三上学期开学考试化学试题内蒙古海拉尔第二中学2021-2022学年高三上学期第一次阶段考化学试题(已下线)三轮冲刺卷2-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(上海卷)(已下线)2022年山东省高考真题变式题(单选题)(已下线)第二章 物质的量化学实验基本技能 第8练 化学计算的常用方法上海市黄浦区2015届高三4月模拟考试(二模)化学试题福建省厦门双十中学2023-2024学年高一上学期12月月考化学试题
10 . 以Cl2、NaOH、(NH2)2CO(尿素)和SO2为原料可制备N2H4·H2O(水合肼)和无水Na2SO3,其主要实验流程如下:
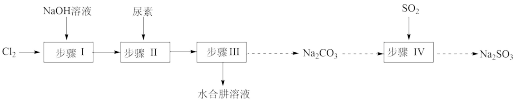
已知:①Cl2+2OH− ClO−+Cl−+H2O是放热反应。
ClO−+Cl−+H2O是放热反应。
②N2H4·H2O沸点约118 ℃,具有强还原性,能与NaClO剧烈反应生成N2。
(1)步骤Ⅰ制备NaClO溶液时,若温度超过40 ℃,Cl2与NaOH溶液反应生成NaClO3和NaCl,其离子方程式为____________________________________ ;实验中控制温度除用冰水浴外,还需采取的措施是____________________________________ 。
(2)步骤Ⅱ合成N2H4·H2O的装置如图−1所示。NaClO碱性溶液与尿素水溶液在40 ℃以下反应一段时间后,再迅速升温至110 ℃继续反应。实验中通过滴液漏斗滴加的溶液是_____________ ;使用冷凝管的目的是_________________________________ 。

(3)步骤Ⅳ用步骤Ⅲ得到的副产品Na2CO3制备无水Na2SO3(水溶液中H2SO3、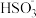 、
、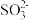 随pH的分布如图−2所示,Na2SO3的溶解度曲线如图−3所示)。
随pH的分布如图−2所示,Na2SO3的溶解度曲线如图−3所示)。
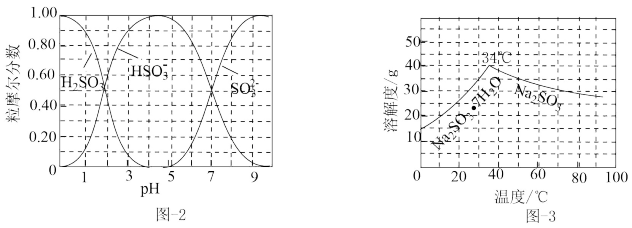
①边搅拌边向Na2CO3溶液中通入SO2制备NaHSO3溶液。实验中确定何时停止通SO2的实验操作为_________________ 。
②请补充完整由NaHSO3溶液制备无水Na2SO3的实验方案:_______________________ ,用少量无水乙醇洗涤,干燥,密封包装。

已知:①Cl2+2OH−
 ClO−+Cl−+H2O是放热反应。
ClO−+Cl−+H2O是放热反应。②N2H4·H2O沸点约118 ℃,具有强还原性,能与NaClO剧烈反应生成N2。
(1)步骤Ⅰ制备NaClO溶液时,若温度超过40 ℃,Cl2与NaOH溶液反应生成NaClO3和NaCl,其离子方程式为
(2)步骤Ⅱ合成N2H4·H2O的装置如图−1所示。NaClO碱性溶液与尿素水溶液在40 ℃以下反应一段时间后,再迅速升温至110 ℃继续反应。实验中通过滴液漏斗滴加的溶液是

(3)步骤Ⅳ用步骤Ⅲ得到的副产品Na2CO3制备无水Na2SO3(水溶液中H2SO3、
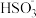 、
、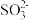 随pH的分布如图−2所示,Na2SO3的溶解度曲线如图−3所示)。
随pH的分布如图−2所示,Na2SO3的溶解度曲线如图−3所示)。
①边搅拌边向Na2CO3溶液中通入SO2制备NaHSO3溶液。实验中确定何时停止通SO2的实验操作为
②请补充完整由NaHSO3溶液制备无水Na2SO3的实验方案:
您最近一年使用:0次
2018-06-10更新
|
6332次组卷
|
17卷引用:2018年全国普通高等学校招生统一考试化学(江苏卷)
2018年全国普通高等学校招生统一考试化学(江苏卷)【全国百强校】山西省临汾第一中学2017-2018学年高二下学期期末考试化学试题江西省南昌三中2019届高二下期末考试 化学(已下线)2018年高考题及模拟题汇编 专题15 工艺流程题四川省射洪县射洪中学2018-2019学年高二上学期开学考试化学试题【全国百强校】河南省实验中学2019届高三上学期质量预测模拟(三)化学试题河南省许昌高级中学2020届高三上学期第一次月考化学试题江西省宜春市万载中学2019-2020学年高二上学期期中考试化学试题(衔接班)河北省石家庄市行唐县三中2020届高三11月月考化学试题甘肃省武威第六中学2020届高三上学期第五次过关考试化学试题2020届高三化学选修4二轮专题练——酸碱中和滴定的曲线分析【精编25题】专题5.2 化学实验的设计与评价(疑难突破)——巅峰冲刺2020年高考化学二轮专项提升河南省洛阳市第一高级中学2021届高三上学期10月月考化学试题(已下线)【一飞冲天】名家原创卷1天津市咸水沽第一中学2023届高三上学期第一次模拟考试化学试题天津西青区2022-2023学年高三上学期期末考试化学试题江苏省南通市通州区金沙中学2022-2023学年高一下学期6月质量监测化学试题



