名校
解题方法
1 . 如图是元素周期表的一部分,主族元素A、B、C、D、E在元素周期表中的位置如图,A元素的单质在空气中含量最高(请用相应的元素符号或化学式作答)∶
(1)A简单离子结构示意图_______
(2)下列说法不正确的是_______
A.C的最高价氧化物能溶于B的氢化物水溶液
B.元素A、E的气态氢化物相遇会产生白烟
C.B元素形成的其中一种18电子分子,能与A元素形成的一种10电子分子发生氧化还原反应
D.原子得电子能力∶D>E>A
(3)C、D、B氢化物的稳定性大小为_______ ,A和D氢化物沸点的大小为_______ 。
(4)设计实验比较D与E的非金属性强(用离子方程式表示)_______ 。
(5)A2的结构式_____ ,CB4的电子式为____ ,CB4溶于NaOH溶液的化学方程式____ 。
(6)E单质通入足量Na2CO3溶液发生反应的化学方程式_______ 。
| A | B | ||
| C | D | E |
(1)A简单离子结构示意图
(2)下列说法不正确的是
A.C的最高价氧化物能溶于B的氢化物水溶液
B.元素A、E的气态氢化物相遇会产生白烟
C.B元素形成的其中一种18电子分子,能与A元素形成的一种10电子分子发生氧化还原反应
D.原子得电子能力∶D>E>A
(3)C、D、B氢化物的稳定性大小为
(4)设计实验比较D与E的非金属性强(用离子方程式表示)
(5)A2的结构式
(6)E单质通入足量Na2CO3溶液发生反应的化学方程式
您最近一年使用:0次
2 . 写出下列反应的化学方程式,是离子反应的写离子方程式
(1)工业上制备氨气反应的化学方程式___________
(2)铜和浓硫酸发生反应的化学方程式___________
(3)氨气催化氧化生成一氧化氮的化学方程式___________
(4)工业上制备漂白液发生反应的离子方程式___________
(5)将亚硫酸钠溶液滴入酸性高锰酸钾溶液中发生反应的离子方程式___________
(1)工业上制备氨气反应的化学方程式
(2)铜和浓硫酸发生反应的化学方程式
(3)氨气催化氧化生成一氧化氮的化学方程式
(4)工业上制备漂白液发生反应的离子方程式
(5)将亚硫酸钠溶液滴入酸性高锰酸钾溶液中发生反应的离子方程式
您最近一年使用:0次
3 . 漂白粉是一种常用杀菌、消毒剂,其有效成分为次氯酸钙。如图为制取漂白粉的工业流程简图。

(1)流程Ⅰ得到浓度为80 g/L氢氧化钠溶液,其物质的量浓度是_______ mol/L。
(2)流程 Ⅱ的反应条件(2)是_______ 。
(3)流程 Ⅲ中发生两个反应,写出其中一个的氧化还原反应的方程式:_______ 。
(4)流程 Ⅳ中操作b是_______ (写名称)。
(5)用化学方程式说明较纯的次氯酸钙粉末必须密封保存的原因:_______ 。

(1)流程Ⅰ得到浓度为80 g/L氢氧化钠溶液,其物质的量浓度是
(2)流程 Ⅱ的反应条件(2)是
(3)流程 Ⅲ中发生两个反应,写出其中一个的氧化还原反应的方程式:
(4)流程 Ⅳ中操作b是
(5)用化学方程式说明较纯的次氯酸钙粉末必须密封保存的原因:
您最近一年使用:0次
名校
解题方法
4 . 2020年突如其来的“新冠肺炎”使人们认识到日常杀菌消毒的重要性。氯气、以及由其制备得到的漂白液、漂白粉都是生活中常见的含氯消毒剂。
(1)常温下用烧碱溶液吸收Cl2制备“84”消毒液,但是将Cl2通入热的烧碱溶液中,可以得到NaCl、NaClO、NaClO3的混合溶液。当混合溶液中的Cl-和ClO 的个数比为15:2时,混合液中的ClO-和ClO
的个数比为15:2时,混合液中的ClO-和ClO 的个数比为
的个数比为__ ,从氧化还原角度分析Cl2表现了_______ 性。
(2)“洁厕灵”和“84”消毒液不可以混合使用,请用离子方程式解释原因:_______
(1)常温下用烧碱溶液吸收Cl2制备“84”消毒液,但是将Cl2通入热的烧碱溶液中,可以得到NaCl、NaClO、NaClO3的混合溶液。当混合溶液中的Cl-和ClO
 的个数比为15:2时,混合液中的ClO-和ClO
的个数比为15:2时,混合液中的ClO-和ClO 的个数比为
的个数比为(2)“洁厕灵”和“84”消毒液不可以混合使用,请用离子方程式解释原因:
您最近一年使用:0次
名校
解题方法
5 . (1)向Fe(OH)3胶体中逐滴加入氢碘酸。
现象:____________________________________________________________
离子方程式:________________________________________________
(2)将Cl2通入NaOH溶液,充分反应后测得溶液中ClO-与ClO 个数比为3:1,则被氧化与被还原的氯元素质量比为
个数比为3:1,则被氧化与被还原的氯元素质量比为_________ ;离子方程式为_________________________________ 。
(3)H2与Cl2混合点燃,充分反应后,将气体通入含有40gNaOH的溶液中恰好完全反应,则混合气体中Cl2质量为________ 。
(4)向FeBr2溶液中通入一定量的Cl2,充分反应后,测得游离态的溴元素和化合态的溴元素质量比为1:1,写出反应的离子方程式________________________________________________ 。
现象:
离子方程式:
(2)将Cl2通入NaOH溶液,充分反应后测得溶液中ClO-与ClO
 个数比为3:1,则被氧化与被还原的氯元素质量比为
个数比为3:1,则被氧化与被还原的氯元素质量比为(3)H2与Cl2混合点燃,充分反应后,将气体通入含有40gNaOH的溶液中恰好完全反应,则混合气体中Cl2质量为
(4)向FeBr2溶液中通入一定量的Cl2,充分反应后,测得游离态的溴元素和化合态的溴元素质量比为1:1,写出反应的离子方程式
您最近一年使用:0次
2020-11-16更新
|
118次组卷
|
2卷引用:安徽省黄山市屯溪第一中学2020-2021学年高一上学期期中考试化学试题
名校
6 . 氯气极其相关产品在生产生活中应用广泛。
(1)氯气属于有毒气体,贮氯罐意外泄漏时,消防员会喷洒稀氢氧化钠溶液,其作用是__________ 。(用化学方程式表示)。
实验室常用NaOH溶液吸收多余的氯气,下列也可用于吸收氯气的是_________ (填字母)。
a.NaCl溶液 b.FeSO4溶液 c.KMnO4溶液
(2)家庭中常用消毒液(主要成分NaClO)、洁厕灵(主要成分盐酸)等清洁卫生。某品牌消毒液包装上的说明如下图。
①分析“对金属制品有腐蚀作用”的原因:_______________ 。
②需“密闭保存”的原因:______________ 。
③“与洁厕灵同时使用”会产生有毒的氯气,请写出反应的离子方程式_____________ 。
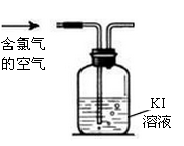
(3)已知空气中氯气含量超过0.1mg/m3就会引起中毒。某液氯生产车间在一次测定空气中氯气的含量时,测得消耗0.001ml/L Kl溶液100mL,为了判断空气中氯气的含量是否超标,还需要获得的数据是_______ 。
(1)氯气属于有毒气体,贮氯罐意外泄漏时,消防员会喷洒稀氢氧化钠溶液,其作用是
实验室常用NaOH溶液吸收多余的氯气,下列也可用于吸收氯气的是
a.NaCl溶液 b.FeSO4溶液 c.KMnO4溶液
(2)家庭中常用消毒液(主要成分NaClO)、洁厕灵(主要成分盐酸)等清洁卫生。某品牌消毒液包装上的说明如下图。

①分析“对金属制品有腐蚀作用”的原因:
②需“密闭保存”的原因:
③“与洁厕灵同时使用”会产生有毒的氯气,请写出反应的离子方程式
(3)已知空气中氯气含量超过0.1mg/m3就会引起中毒。某液氯生产车间在一次测定空气中氯气的含量时,测得消耗0.001ml/L Kl溶液100mL,为了判断空气中氯气的含量是否超标,还需要获得的数据是
您最近一年使用:0次
7 . 某校化学兴趣小组用浓盐酸与二氧化锰加热反应来制取并收集氯气,装置如下图:

(1)写出该反应的离子方程式:______________
(2)上述反应中,还原剂是________ ,若有2 mol氧化剂参加反应,转移电子的物质的量是________ mol。
(3)实验开始前,某学生对装置进行了气密性检查。方法是:连接好装置之后,用弹簧夹夹住________ 处(填“A”或“B”)橡皮管;向分液漏斗中加水并打开活塞,当加到一定量时,停止加水,静置观察。当观察到分液漏斗中______________ 时,表明该装置不漏气。
(4)兴趣小组的某些同学准备在烧杯中加入下列溶液中的一种来吸收残余氯气,你认为其中错误的是________ (填写序号)。
A 氢氧化钠溶液 B 碳酸钠溶液 C 浓硫酸

(1)写出该反应的离子方程式:
(2)上述反应中,还原剂是
(3)实验开始前,某学生对装置进行了气密性检查。方法是:连接好装置之后,用弹簧夹夹住
(4)兴趣小组的某些同学准备在烧杯中加入下列溶液中的一种来吸收残余氯气,你认为其中错误的是
A 氢氧化钠溶液 B 碳酸钠溶液 C 浓硫酸
您最近一年使用:0次
8 . 饮用水的质量关乎人类健康。回答下列问题:
(1)自来水厂用氯气杀菌、消毒,其消毒原理主要是氯气溶于水后生成了HClO,写出HClO的电子式________ 。
(2)常温下,将氯气通入稀NaOH溶液中得到漂白液(主要成分为NaClO),该反应的离子方程式为________ 。
(3)ClO2是一种黄绿色气体,被称为“第四代”饮用水消毒剂。制备ClO2的一种方法为:在平底烧瓶中加入KClO3固体、足量草酸(H2C2O4)、稀硫酸,60℃~80℃水浴加热。该反应的化学方程式为________ 。
(1)自来水厂用氯气杀菌、消毒,其消毒原理主要是氯气溶于水后生成了HClO,写出HClO的电子式
(2)常温下,将氯气通入稀NaOH溶液中得到漂白液(主要成分为NaClO),该反应的离子方程式为
(3)ClO2是一种黄绿色气体,被称为“第四代”饮用水消毒剂。制备ClO2的一种方法为:在平底烧瓶中加入KClO3固体、足量草酸(H2C2O4)、稀硫酸,60℃~80℃水浴加热。该反应的化学方程式为
您最近一年使用:0次
解题方法
9 . 某实验小组用MnO2与浓盐酸加热制取Cl2,并将得的氯气与潮湿的Ca(OH)2固体反应制取少量漂白粉,实验装置如下图:
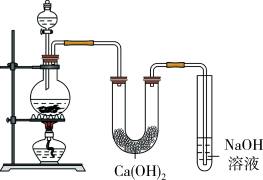
回答下列问题:
(1)漂白粉的有效成分是____________ (写化学式)。
(2)烧瓶中发生反应的化学方程式为_______________ 。
(3)温度较高时氯气与消石灰发生反应:6Cl2+6Ca(OH)2=5CaCl2+Ca(ClO3)2+6H2O,该反应中氧化剂和还原剂的物质的量之比是________ ;若反应消耗0.3molCl2,则转移的电子数为__________ 个。

回答下列问题:
(1)漂白粉的有效成分是
(2)烧瓶中发生反应的化学方程式为
(3)温度较高时氯气与消石灰发生反应:6Cl2+6Ca(OH)2=5CaCl2+Ca(ClO3)2+6H2O,该反应中氧化剂和还原剂的物质的量之比是
您最近一年使用:0次
解题方法
10 . “84消毒液”是日常生活中常用的消毒液,在抗击新冠肺炎中广泛应用。
(1)“84消毒液”的有效成分为________ ;
(2)“84消毒液”与适量硫酸混合使用可增强消毒能力,某消毒组成员欲用盐酸代替硫酸,是否可行_________ (填“是"或“否”),原因是_____________ ;
(3)Cl2是最早用于饮用水消毒的物质,ClO2是一种广谱消毒剂,等质量的Cl2和ClO2消毒效率高的是________ (填化学式);工业上ClO2常用NaClO3和Na2SO3溶液混合酸化反应制得,反应中NaClO3和Na2SO3的物质的量之比为__________ 。
(1)“84消毒液”的有效成分为
(2)“84消毒液”与适量硫酸混合使用可增强消毒能力,某消毒组成员欲用盐酸代替硫酸,是否可行
(3)Cl2是最早用于饮用水消毒的物质,ClO2是一种广谱消毒剂,等质量的Cl2和ClO2消毒效率高的是
您最近一年使用:0次



