1 . 某小组同学欲实验验证 的化学性质,探究催化氧化反应,按如图装置进行实验。A、B装置可选药品:浓氨水、
的化学性质,探究催化氧化反应,按如图装置进行实验。A、B装置可选药品:浓氨水、 、蒸馏水、
、蒸馏水、 固体、
固体、 ,C、D为干燥装置。
,C、D为干燥装置。
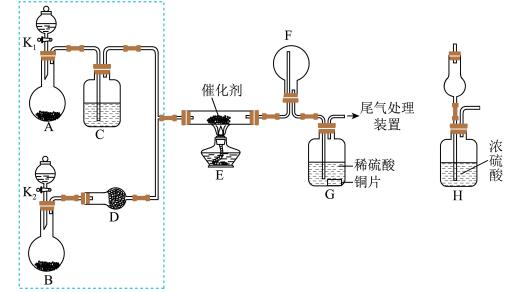
(1)装置A、B中产生气体的化学式分别是A:__________ ,B:_________ ,E中发生反应的化学方程式是___________________________________ 。
(2)甲乙两同学分别按上述装置进行实验,一段时间后,装置G中溶液都变成蓝色。甲观察到装置F中有红棕色气体,红棕色气体的成分是(写化学式)__________ ,乙观察到装置F中只有白烟生成,白烟的成分是(写化学式)__________ 。
(3)为帮助乙实现在装置F中也观察到红棕色气体,可在原实验的基础上进行改进。除了调节 和
和 控制A、B装置中的产气量外,还可以在装置E、F间增加一个H装置,理由是
控制A、B装置中的产气量外,还可以在装置E、F间增加一个H装置,理由是__________________________________ ,该装置采用空的干燥管,目的是________________________________ 。
(4)为实现该反应,也可用如下图所示的装置替换上述装置中虚线框部分,该气体发生装置涉及多个化学反应,如: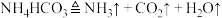 ,写出装置中还可能的化学方程式
,写出装置中还可能的化学方程式_________________________ (写出一个即可)。
(5)运输氨时,不能使用铜及其合金制造的管道阀门,因为,在潮湿的环境中,金属铜在有 存在时能被空气中的
存在时能被空气中的 氧化,生成
氧化,生成 ,该反应的离子方程式为
,该反应的离子方程式为_______________________________ 。
 的化学性质,探究催化氧化反应,按如图装置进行实验。A、B装置可选药品:浓氨水、
的化学性质,探究催化氧化反应,按如图装置进行实验。A、B装置可选药品:浓氨水、 、蒸馏水、
、蒸馏水、 固体、
固体、 ,C、D为干燥装置。
,C、D为干燥装置。
(1)装置A、B中产生气体的化学式分别是A:
(2)甲乙两同学分别按上述装置进行实验,一段时间后,装置G中溶液都变成蓝色。甲观察到装置F中有红棕色气体,红棕色气体的成分是(写化学式)
(3)为帮助乙实现在装置F中也观察到红棕色气体,可在原实验的基础上进行改进。除了调节
 和
和 控制A、B装置中的产气量外,还可以在装置E、F间增加一个H装置,理由是
控制A、B装置中的产气量外,还可以在装置E、F间增加一个H装置,理由是(4)为实现该反应,也可用如下图所示的装置替换上述装置中虚线框部分,该气体发生装置涉及多个化学反应,如:
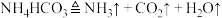 ,写出装置中还可能的化学方程式
,写出装置中还可能的化学方程式
(5)运输氨时,不能使用铜及其合金制造的管道阀门,因为,在潮湿的环境中,金属铜在有
 存在时能被空气中的
存在时能被空气中的 氧化,生成
氧化,生成 ,该反应的离子方程式为
,该反应的离子方程式为
您最近一年使用:0次
名校
解题方法
2 . 如图所示的物质转化关系中,A是常见的气态氢化物,B是能使带火星的木条复燃的无色、无臭气体,E的相对分子质量比D的大17,G是一种紫红色金属单质(反应条件和部分生成物未列出)。
对图中有关物质及反应的叙述正确的是

对图中有关物质及反应的叙述正确的是
| A.图中涉及反应均为氧化还原反应 |
| B.D与水反应能生成酸,因此D是酸性氧化物 |
| C.因为E具有强氧化性,所以不能用铝制容器盛装 |
D.A分子中心原子的杂化方式为 |
您最近一年使用:0次
2023-11-28更新
|
69次组卷
|
2卷引用:天津市第一百中学2023-2024学年高三上学期期中考试化学试题
名校
解题方法
3 . 合成氨及氨氧化制硝酸的流程如图所示,下列说法错误的是


| A.从氨分离器中分离出氨,主要利用了其易液化的性质 |
B.氧化炉中发生反应的化学方程式为 |
| C.向吸收塔中通入空气的主要作用是提高氮元素的利用率 |
| D.酸雨和光化学烟雾的形成均与氮氧化物有关 |
您最近一年使用:0次
2023-09-17更新
|
66次组卷
|
2卷引用:天津市滨海新区田家炳中学2023-2024学年高三上学期期中考试化学试题
名校
解题方法
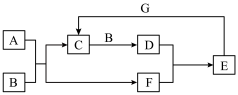
4 . 下列关系图中,A 是一种正盐,B 是气态氢化物,C 是单质,F 是强酸。当 X 无论是强酸还是强碱时都有如下转化关系(其他反应产物及反应所需条件均已略去),当 X 是强碱时,过量的 B 跟 Cl2 反应除生成 C 外,另一产物是盐酸盐。
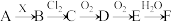
下列说法中不正确的是
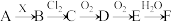
下列说法中不正确的是
| A.当 X 是强酸时,A、B、C、D、E、F 中均含同一种元素,F 可能是 H2SO4 |
| B.当 X 是强碱时,A、B、C、D、E、F 中均含同一种元素,F 是 HNO3 |
| C.用 O2 代替 Cl2, 也能与 B 反应生成 C 物质 |
| D.当 X 是强酸时,C 在常温下是一种易溶于酒精的固体 |
您最近一年使用:0次
2022-12-20更新
|
769次组卷
|
6卷引用:天津市第三中学2022-2023学年高一下学期期中质量检测化学试题
解题方法
5 . 氮元素形成的化合物种类十分丰富。请根据以下工业制硝酸的原理示意图回答含氮化合物相关的问题:

(1)下列有关NH3的说法中,不正确的是___________。
(2)NH3易溶于水,标准状况下,用充满NH3的烧瓶做喷泉实验(如图),引发喷泉的方法是________________________ ,水充满整个烧瓶后所形成溶液的物质的量浓度为___________ mol·L-1。

(3)氨气在氧化炉中发生反应的化学方程式为_____________________ 。
(4)HNO3是一种重要的化工原料,工厂生产出的浓硝酸可用铝槽车或铁槽车来运输。在常温下能使铝、铁钝化,说明浓硝酸具有很强的___________ 性。
(5)“吸收塔”尾部会有含NO、NO2等氮氧化物的尾气排出,为消除它们对环境的破坏作用,通常用以下两种方法处理:
①纯碱溶液吸收法。纯碱溶液与NO2的反应原理为Na2CO3+NO2=NaNO3+___________ +CO2(不需配平,请填写缺少物质的化学式)。
②氨转化法。已知7 mol氨恰好能将含NO和NO2共6 mol 的混合气体完全转化为N2,则混合气体中NO和NO2的物质的量之比为___________ 。

(1)下列有关NH3的说法中,不正确的是___________。
| A.工业合成NH3需要在高温高压催化剂下进行 |
| B.NH3可用来生产碳铵和尿素等化肥 |
| C.NH3可用浓硫酸或无水氯化钙干燥 |
| D.NH3受热易分解,须置于冷暗处保存 |

(3)氨气在氧化炉中发生反应的化学方程式为
(4)HNO3是一种重要的化工原料,工厂生产出的浓硝酸可用铝槽车或铁槽车来运输。在常温下能使铝、铁钝化,说明浓硝酸具有很强的
(5)“吸收塔”尾部会有含NO、NO2等氮氧化物的尾气排出,为消除它们对环境的破坏作用,通常用以下两种方法处理:
①纯碱溶液吸收法。纯碱溶液与NO2的反应原理为Na2CO3+NO2=NaNO3+
②氨转化法。已知7 mol氨恰好能将含NO和NO2共6 mol 的混合气体完全转化为N2,则混合气体中NO和NO2的物质的量之比为
您最近一年使用:0次
6 . 氮及其化合物的转化具有重要应用。下列说法不正确 的是
A.自然固氮、人工固氮都是将 转化为 转化为 |
B.侯氏制碱法以 、 、 、 、 、 、 为原料制备 为原料制备 和 和 |
C.工业上通过 催化氧化等反应过程生产 催化氧化等反应过程生产 |
| D.多种形态的氮及其化合物间的转化形成了自然界的“氮循环” |
您最近一年使用:0次
2022-07-21更新
|
8599次组卷
|
27卷引用:天津市滨海新区田家炳中学2023-2024学年高三上学期期中考试化学试题
天津市滨海新区田家炳中学2023-2024学年高三上学期期中考试化学试题江苏省淮安市高中校协作体2022-2023学年高三上学期期中考试化学试题江苏省南京市六校联合体2022-2023学年高一下学期5月期中考试化学试题辽宁省部分县级重点中学2023-2024学年高三上学期11月期中考试化学试题天津市第四中学2023-2024学年高三上学期第二次月考化学试卷(已下线)专题05 元素及其化合物-2022年高考真题模拟题分项汇编江苏省2022年普通高中学业水平选择性考试(已下线)第14讲 氮及其化合物(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)2022年江苏卷高考真题变式题1-13(已下线)第12讲 氮及其化合物(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)易错点11 氮元素及其化合物-备战2023年高考化学考试易错题甘肃省武威第六中学2022-2023学年高三上学期第三次过关考试化学试题(已下线)专题08 元素及其化合物(讲)-2023年高考化学二轮复习讲练测(新高考专用)(已下线)专题10 常见非金属元素的性质及应用-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)江苏省2022年普通高中学业水平选择性考试变式题(选择题6-10)江苏省连云港市赣榆智贤中学2022-2023学年高一3月阶段检测化学试题(已下线)专题卷08 无机物的性质与用途-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)(已下线)查补易混易错01 元素化合物部分-【查漏补缺】2023年高考化学三轮冲刺过关(新高考专用)(已下线)第07练 元素及其化合物基础知识和应用 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)广东省梅州市大埔县虎山中学2022-2023学年高三上学期12月月考化学试题(已下线)考点11 氮及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)专题07 无机物的转化 微型工艺流程-2023年高考化学真题题源解密(全国通用)(已下线)专题06 元素及其化合物 -2023年高考化学真题题源解密(新高考专用)黑龙江省哈尔滨市第三中学2023-2024学年高二上学期开学测试化学试题江苏省泰州市泰州中学2023-2024学年高三上学期第一次月度检测化学试题江苏省南京师范大学附属中学2023-2024学年高一上学期1月期末化学试题河北省唐山市开滦第二中学2023-2024学年高一下学期4月月考化学试题
7 . 某工厂制硝酸的流程如图所示。

(1)上述转化中,属于氮的固定的是___ (填“i”“ii”或“iii”)。
(2)写出“氧化炉“中反应的化学方程式___ 。

(1)上述转化中,属于氮的固定的是
(2)写出“氧化炉“中反应的化学方程式
您最近一年使用:0次
8 . 自然界中的局部氮循环如下图。

(1)上图含氮物质的各步转化中,属于氮的固定的是___________ (填数字序号)。
(2)NH3是氮循环中的重要物质,工业合成氨反应的化学方程式为___________ 。
(3)某化工厂出现泄漏大量氨水进入循环水系统,使循环水中含氯杀菌剂(有效成分为Cl2)的杀菌效果降低、硝化作用增强,导致循环水的pH发生波动,最终造成设备腐蚀。
①下列有关氨对循环水影响的说法中,正确的是___________ (填字母序号)。
a.过量氨进入循环水后,水中 和
和 含量会升高
含量会升高
b.过量氨进入循环水后,不会导致水体富营养化
c.循环水pH的波动中,pH的上升与氨水的碱性有关
②通过检测循环水中的c( )可判断循环水的水质是否恶化,c(
)可判断循环水的水质是否恶化,c( )检测利用的是酸性条件下I-被
)检测利用的是酸性条件下I-被 氧化为I2的反应,该反应的历程如下:
氧化为I2的反应,该反应的历程如下:
I. +2H+=NO++H2O
+2H+=NO++H2O
II.……
III.2ONI=I2+2NO
历程II的离子方程式为___________ 。
(4)汽车排出的尾气中也含有氮氧化物,如果直接排放到大气中可能造成___________ ,为避免污染,常给汽车安装三元催化净化装置,氮氧化物和CO在催化剂作用下生成无毒可直接排放的物质。以NO2为例写出净化过程中的总化学方程式:___________ 。
(5)含 的废水可用二硫化亚铁(FeS2)处理,在反硝化细菌的作用下发生以下反应,请将离子方程式补充完整:14
的废水可用二硫化亚铁(FeS2)处理,在反硝化细菌的作用下发生以下反应,请将离子方程式补充完整:14 +5FeS2+_____H+
+5FeS2+_____H+ 7N2↑+10
7N2↑+10 +______+______H2O,
+______+______H2O,_______ 。

(1)上图含氮物质的各步转化中,属于氮的固定的是
(2)NH3是氮循环中的重要物质,工业合成氨反应的化学方程式为
(3)某化工厂出现泄漏大量氨水进入循环水系统,使循环水中含氯杀菌剂(有效成分为Cl2)的杀菌效果降低、硝化作用增强,导致循环水的pH发生波动,最终造成设备腐蚀。
①下列有关氨对循环水影响的说法中,正确的是
a.过量氨进入循环水后,水中
 和
和 含量会升高
含量会升高b.过量氨进入循环水后,不会导致水体富营养化
c.循环水pH的波动中,pH的上升与氨水的碱性有关
②通过检测循环水中的c(
 )可判断循环水的水质是否恶化,c(
)可判断循环水的水质是否恶化,c( )检测利用的是酸性条件下I-被
)检测利用的是酸性条件下I-被 氧化为I2的反应,该反应的历程如下:
氧化为I2的反应,该反应的历程如下:I.
 +2H+=NO++H2O
+2H+=NO++H2OII.……
III.2ONI=I2+2NO
历程II的离子方程式为
(4)汽车排出的尾气中也含有氮氧化物,如果直接排放到大气中可能造成
(5)含
 的废水可用二硫化亚铁(FeS2)处理,在反硝化细菌的作用下发生以下反应,请将离子方程式补充完整:14
的废水可用二硫化亚铁(FeS2)处理,在反硝化细菌的作用下发生以下反应,请将离子方程式补充完整:14 +5FeS2+_____H+
+5FeS2+_____H+ 7N2↑+10
7N2↑+10 +______+______H2O,
+______+______H2O,
您最近一年使用:0次
名校
解题方法
9 . 含氮化合物过多蓄积会导致水体富营养化,需将其从水体中除去,该过程称为脱氮。常用的脱氮方法有吹脱法和折点氯化法。
吹脱法:调节水体 至8左右,然后持续向水中吹入空气。
至8左右,然后持续向水中吹入空气。
折点氯化法:调节水体 至6左右,向水中加入适量
至6左右,向水中加入适量 。
。
下列分析不正确的是
吹脱法:调节水体
 至8左右,然后持续向水中吹入空气。
至8左右,然后持续向水中吹入空气。折点氯化法:调节水体
 至6左右,向水中加入适量
至6左右,向水中加入适量 。
。下列分析不正确的是
A.含氨和铵盐的水体中存在平衡: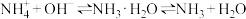 |
B.吹脱法的原理是通过鼓气降低 浓度,从而降低水中 浓度,从而降低水中 与 与 的含量 的含量 |
C.折点氯化法除 的原理为: 的原理为: |
D.吹脱法无法对含 的水体脱氮,但折点氯化法可以对含 的水体脱氮,但折点氯化法可以对含 的水体脱氮 的水体脱氮 |
您最近一年使用:0次
2021-10-19更新
|
1056次组卷
|
17卷引用:天津市五校2022-2023学年高三上学期期中联考化学试题
天津市五校2022-2023学年高三上学期期中联考化学试题2020届高三化学海淀区高三第一学期期中练习北京市海淀区2019-2020学年高三期中考试化学试题山东省济宁市泗水县2021届高三上学期期中考试化学试题天津市咸水沽第一中学2022-2023学年高三上学期线上期末考试化学试题(已下线)考点24 元素与理论综合——《备战2020年高考精选考点专项突破题集》湖北省龙泉中学、潜江中学2020届高三12月联考理综化学试题(已下线)课时24 环境污染与保护-2022年高考化学一轮复习小题多维练(全国通用)北京市北京中国人民大学附属中学2022届高三10月检测化学试卷(已下线)2022年新高考化学时事热点情境化考题---化学与文化生活(已下线)备战2022年高考化学精准检测卷【全国卷】11(已下线)二轮拔高卷2-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(北京专用)(已下线)章末综合评价(四)THUSSAT新高考地区2022年12月诊断性测试化学试题北京市交通大学附属中学2023-2024学年高一上学期12月月考化学试题 重庆市2023-2024学年高三下学期2月月度质量检测化学试题(已下线)通关练02 重要无机化合物的性质及应用-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)
名校
解题方法
10 . A、B、C、D、E为中学化学常见的单质或化合物,相互转化关系如图所示。

(1)若A是能使湿润的红色石蕊试纸变蓝的气体;C、D均为空气的主要成分;E是一种有毒气体能与血红蛋白结合,反应Ⅱ在三元催化器催化作用下常用于汽车尾气的转化。
①写出反应I的化学方程式__ 。
②写出Ⅲ在高温下反应的化学方程式__ 。
(2)若A是淡黄色化合物;常温下D是无色气体;C是一种常见的碱,含有的阴、阳离子均为10电子粒子。
①写出反应Ⅰ的化学方程式___ 。
②写出反应Ⅲ的化学方程式___ 。
(3)若A是酸,D是一种常见金属,E是一种常见的非金属单质。
①写出反应Ⅱ的离子方程式___ 。
②检验B中含有少量C的方法是:取少量溶液加入__ (填序号)后观察现象。
A.NaOH溶液 B.KSCN溶液 C.酸性KMnO4溶液 D.淀粉—KI溶液

(1)若A是能使湿润的红色石蕊试纸变蓝的气体;C、D均为空气的主要成分;E是一种有毒气体能与血红蛋白结合,反应Ⅱ在三元催化器催化作用下常用于汽车尾气的转化。
①写出反应I的化学方程式
②写出Ⅲ在高温下反应的化学方程式
(2)若A是淡黄色化合物;常温下D是无色气体;C是一种常见的碱,含有的阴、阳离子均为10电子粒子。
①写出反应Ⅰ的化学方程式
②写出反应Ⅲ的化学方程式
(3)若A是酸,D是一种常见金属,E是一种常见的非金属单质。
①写出反应Ⅱ的离子方程式
②检验B中含有少量C的方法是:取少量溶液加入
A.NaOH溶液 B.KSCN溶液 C.酸性KMnO4溶液 D.淀粉—KI溶液
您最近一年使用:0次
2021-05-01更新
|
608次组卷
|
2卷引用:天津市第一中学2020-2021学年高一下学期期中考试化学试题



