名校
解题方法
1 . 判断下列说法不正确的是
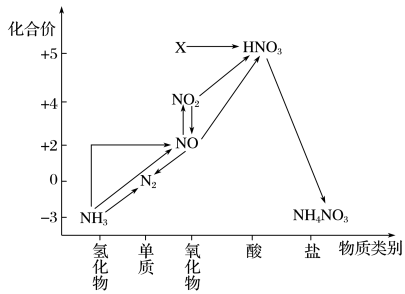
| A.X是N2O5 |
| B.可用排空气法收集NO气体 |
| C.工业上以NH3、空气、水为原料生产硝酸 |
| D.由NH3→N2,从原理上看,NH3可与NO2反应实现 |
您最近一年使用:0次
2023-05-11更新
|
494次组卷
|
29卷引用:专题7 专题强化练3 氮及其化合物的性质与转化-高中化学必修第二册苏教版2019
专题7 专题强化练3 氮及其化合物的性质与转化-高中化学必修第二册苏教版2019陕西省宝鸡市渭滨区2020-2021学年高一上学期期末考试化学试题广东省肇庆市高要区第二中学2020-2021学年高一下学期段考(一)化学试题江苏省南京市六校联考2020-2021学年高一下学期期末考试化学试题2020届高三化学二轮冲刺新题专练——氮及其氧化物的性质(提升练)(已下线)【浙江新东方】98辽宁省葫芦岛市普通高中2021-2022学年高一下学期期末学业质量监测化学试题甘肃省永昌县第一高级中学2021-2022学年高一下学期期末考试化学试题江苏省常熟市2021-2022学年高一下学期期中考试化学试题广东省广州市第二中学2021-2022学年高一下学期期末考试化学试题(已下线)第12讲 氮及其化合物(练)-2023年高考化学一轮复习讲练测(新教材新高考)河南省郑州市第七高级中学2022-2023 学年高一上学期期末考试化学试题宁夏银川市第二中学2022-2023学年高一下学期第一次月考化学试题江苏省南京市协同体七校2022-2023学年高一下学期期中联合考试化学试题山西省阳泉市第一中学校2022-2023学年高一下学期期中考试化学试题陕西省西安市第八十五中学2022-2023学年高一下学期期中考试化学试题安徽省合肥市庐巢八校联考2022-2023学年高一下学期5月期中化学试题广东省广州市真光中学2022-2023学年高一下学期5月月考化学试题宁夏银川市贺兰县第一中学2022-2023学年高一下学期期中考试化学试题辽宁省鞍山市普通高中2022-2023学年高一下学期期末考试化学试题四川省成都石室蜀都中学2022-2023学年高一下学期期末考试化学试题吉林省梅河口市第五中学2023-2024学年高二上学期开学考试化学试题云南省开远市第一中学校2022-2023学年高一下学期3月月考化学试题四川省眉山市仁寿第一中学校(北校区)2023-2024学年高二上学期9月月考化学试题湖北省襄阳市第一中学2023-2024学年高一下学期3月月考化学试题福建省德化第一中学2024-2024学年高一下学期第一次月考化学试题福建省福州第四中学2023-2024学年高一下学期期中考试化学试卷宁夏青铜峡市宁朔中学2023-2024学年高一下学期期中考试化学试题青海省西宁市第十四中学2023-2024学年高一下学期期中考试化学试卷
2 . 氮是地球上含量丰富的一种元素,氮及其化合物与工农业生产、生活具有密切关系。
(1)下列变化属于“氮的固定”的是_______(填字母)。
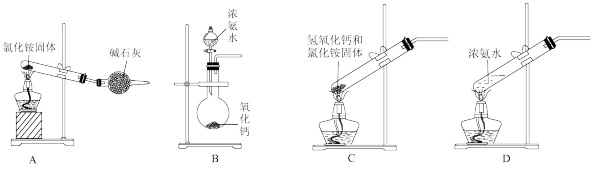
(2)如图是实验室制取氨气的装置和选用的试剂,其中不正确的是_______ (填字母)。
(3) 是常用的铵态氮肥,检验铵态氮肥中是否含有
是常用的铵态氮肥,检验铵态氮肥中是否含有 的方法是
的方法是_______ (写出实验操作、现象及结论)。
(4)治理 通常是在氧化剂作用下,将
通常是在氧化剂作用下,将 氧化成
氧化成 ,然后用水或碱液吸收脱氮。下列物质可用于氧化
,然后用水或碱液吸收脱氮。下列物质可用于氧化 的是
的是_______ (填字母)。
A. 溶液 B.
溶液 B. 溶液 C.
溶液 C. 溶液 D.
溶液 D. 溶液
溶液
若用 溶液氧化
溶液氧化 ,写出该反应的化学方程式并用双线桥法标出反应中电子转移的方向和数目
,写出该反应的化学方程式并用双线桥法标出反应中电子转移的方向和数目_______ 。
(5)用尿素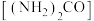 水溶液吸收氮氧化物也是一种可行的方法。将
水溶液吸收氮氧化物也是一种可行的方法。将 和
和 不同配比的混合气通入尿素溶液中,总氮还原率与配比关系如图。
不同配比的混合气通入尿素溶液中,总氮还原率与配比关系如图。

①用尿素水溶液吸收体积比为1∶1的 和
和 混合气,可将N元素转变为对环境无害的气体,发生反应的化学方程式为
混合气,可将N元素转变为对环境无害的气体,发生反应的化学方程式为_______ 。
②随着 和
和 配比的提高,总氮还原率降低的主要原因是
配比的提高,总氮还原率降低的主要原因是_______ 。
(1)下列变化属于“氮的固定”的是_______(填字母)。
| A.植物从土壤中吸收氮肥 |
| B.硝酸和氨气反应生成氮肥 |
| C.将空气中的氮气转变为氮的化合物 |
| D.大豆的根瘤菌将含氮的化合物转变为植物蛋白质 |

(3)
 是常用的铵态氮肥,检验铵态氮肥中是否含有
是常用的铵态氮肥,检验铵态氮肥中是否含有 的方法是
的方法是(4)治理
 通常是在氧化剂作用下,将
通常是在氧化剂作用下,将 氧化成
氧化成 ,然后用水或碱液吸收脱氮。下列物质可用于氧化
,然后用水或碱液吸收脱氮。下列物质可用于氧化 的是
的是A.
 溶液 B.
溶液 B. 溶液 C.
溶液 C. 溶液 D.
溶液 D. 溶液
溶液若用
 溶液氧化
溶液氧化 ,写出该反应的化学方程式并用双线桥法标出反应中电子转移的方向和数目
,写出该反应的化学方程式并用双线桥法标出反应中电子转移的方向和数目(5)用尿素
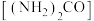 水溶液吸收氮氧化物也是一种可行的方法。将
水溶液吸收氮氧化物也是一种可行的方法。将 和
和 不同配比的混合气通入尿素溶液中,总氮还原率与配比关系如图。
不同配比的混合气通入尿素溶液中,总氮还原率与配比关系如图。
①用尿素水溶液吸收体积比为1∶1的
 和
和 混合气,可将N元素转变为对环境无害的气体,发生反应的化学方程式为
混合气,可将N元素转变为对环境无害的气体,发生反应的化学方程式为②随着
 和
和 配比的提高,总氮还原率降低的主要原因是
配比的提高,总氮还原率降低的主要原因是
您最近一年使用:0次
解题方法
3 . 亚硝酰氯(NOCl)是一种红褐色液体或黄色气体,其熔点-64.5°C, 沸点-5.5°C,具有刺鼻恶臭气味,遇水易水解生成HNO2和氯化氢。NOCl 可由NO与纯净的Cl2合成,相关实验装置如图所示(夹持装置略去)。

(1)制备Cl2
①若用高锰酸钾制备Cl2,发生装置可选_______ (填大写字母), 反应的离子方程式为:_______ 。
②欲收集干燥纯净的Cl2,装置接口的连接顺序为a→_______
(2)合成NOCl
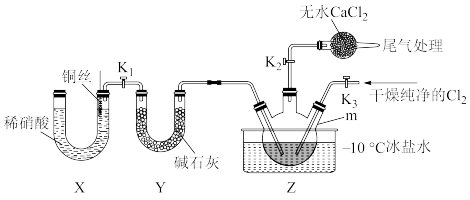
①仪器m的名称为_______ , 写出仪器m中合成NOCl的化学方程式_______ 。
②-10°C冰盐水的作用是_______ 。
③实验中用NaOH溶液进行尾气处理,无水CaCl2的作用是_______ 。
(3)NOCl与水反应生成HNO2与氯化氢。设计实验证明HNO2是弱酸:_______ 。(仅提供:1 mol/L盐酸、1 mol/L HNO2溶液、饱和NaNO2溶液、红色石蕊试纸、蓝色石蕊试纸)

(1)制备Cl2
①若用高锰酸钾制备Cl2,发生装置可选
②欲收集干燥纯净的Cl2,装置接口的连接顺序为a→
(2)合成NOCl

①仪器m的名称为
②-10°C冰盐水的作用是
③实验中用NaOH溶液进行尾气处理,无水CaCl2的作用是
(3)NOCl与水反应生成HNO2与氯化氢。设计实验证明HNO2是弱酸:
您最近一年使用:0次
名校
解题方法
4 . 探究 与
与 溶液反应的实验装置如图所示。回答下列问题。
溶液反应的实验装置如图所示。回答下列问题。
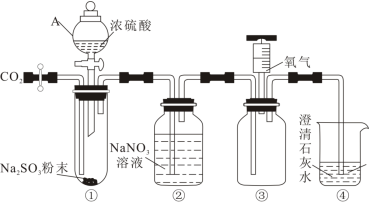
(1)仪器A在使用前应_______ 。装置连接完成后,先检查装置气密性,再加入试剂,通入 ,通入
,通入 的目的是
的目的是_______ ,直至装置④中现象为_______ ,停止通入 。
。
(2)将装置④中盛放 溶液的烧杯替换,打开A仪器活塞,向装置①中滴加浓硫酸,使
溶液的烧杯替换,打开A仪器活塞,向装置①中滴加浓硫酸,使 缓慢通入装置②中,直至装置②中反应完全,停止通入
缓慢通入装置②中,直至装置②中反应完全,停止通入 。将装置③注射器中氧气注入广口瓶,观察到
。将装置③注射器中氧气注入广口瓶,观察到_______ ,说明装置②中反应生成了NO,写出装置②中反应的离子方程式_______ 。
(3)为测定某亚硫酸钠样品的纯度,对上述装置进行如下改进。
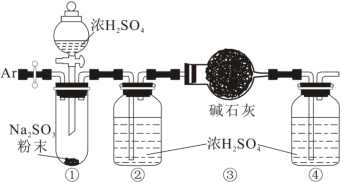
称取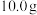 固体,进行如下实验:
固体,进行如下实验:
a.通入氩气排净装置①、②中的空气;
b.将盛有碱石灰的干燥管(总质量 )和装置④连接好;
)和装置④连接好;
c.打开分液漏斗活塞,向装置①中滴加浓硫酸;
d.续通入氩气,直至装置④收集到的Ar纯净;
e.拆除装置,称量装置③的总质量为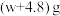 。
。
该样品中亚硫酸钠的纯度为_______ ;若实验中缺少步骤d,会使测定结果_______ (填“偏高”、“偏低”或“无影响”)。
 与
与 溶液反应的实验装置如图所示。回答下列问题。
溶液反应的实验装置如图所示。回答下列问题。
(1)仪器A在使用前应
 ,通入
,通入 的目的是
的目的是 。
。(2)将装置④中盛放
 溶液的烧杯替换,打开A仪器活塞,向装置①中滴加浓硫酸,使
溶液的烧杯替换,打开A仪器活塞,向装置①中滴加浓硫酸,使 缓慢通入装置②中,直至装置②中反应完全,停止通入
缓慢通入装置②中,直至装置②中反应完全,停止通入 。将装置③注射器中氧气注入广口瓶,观察到
。将装置③注射器中氧气注入广口瓶,观察到(3)为测定某亚硫酸钠样品的纯度,对上述装置进行如下改进。

称取
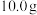 固体,进行如下实验:
固体,进行如下实验:a.通入氩气排净装置①、②中的空气;
b.将盛有碱石灰的干燥管(总质量
 )和装置④连接好;
)和装置④连接好;c.打开分液漏斗活塞,向装置①中滴加浓硫酸;
d.续通入氩气,直至装置④收集到的Ar纯净;
e.拆除装置,称量装置③的总质量为
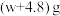 。
。该样品中亚硫酸钠的纯度为
您最近一年使用:0次
2022-01-10更新
|
541次组卷
|
3卷引用:河南省义马市高级中学2021-2022学年高三上学期11月份联考化学试题
河南省义马市高级中学2021-2022学年高三上学期11月份联考化学试题湖南省株洲市攸县第四中学2022-2023学年高三上学期第四次月考化学试题(已下线)专题28 性质探究类综合性实验题-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)
名校
5 . Ⅰ.现有混有少量SO2杂质的CO2气体,请选用适当的实验装置,收集纯净干燥的CO2气体。
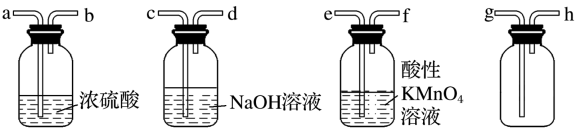
(1)要达到实验目的,按气流从左到右,各接口连接顺序正确的是_______ (填字母)。
(2)下列溶液或用品中:①澄清石灰水;②H2S溶液;③酸性KMnO4溶液;④溴水;⑤Ba(NO3)2溶液;⑥品红溶液;⑦湿润的蓝色石蕊试纸。不能区别SO2和CO2气体的是_______。
Ⅱ. 前几年我国多地发生了严重的雾霾天气,这种天气的形成与汽车尾气排放有关。汽车尾气中常含有CO、NOx等气体,为减轻污染,一般汽车都加装了“催化净化器”,可将汽车尾气中的有毒气体转化为无污染的气体。某化学兴趣小组在实验室模拟汽车尾气处理,设计了下图所示装置(部分夹持装置已略去)。

(3)装置(Ⅲ)的主要作用为_______ 。
(4)停止加热,打开活塞K,放入适量氧气时,装置(Ⅱ)中可观察到的现象是_______ 。
(5)该套装置的不完善之处是_______ 。
(6)汽车尾气中含有CO和NOx,消除它们对大气污染的方法是安装催化转化器,使它们发生反应生成两种无毒的气体,其中一种是单质,该反应的化学方程式为_______ 。
(7)工业上常用纯碱液来吸收NOx,有关反应的化学方程式为2NO2+Na2CO3=NaNO2+NaNO3+CO2、NO2+NO+Na2CO3=2NaNO2+CO2。现有标准状况下a L NO2和b L NO的混合气体恰好被200 mL Na2CO3溶液完全吸收,则a、b应满足的关系为_______ 。Na2CO3溶液的物质的量浓度为_______ mol·L-1。

(1)要达到实验目的,按气流从左到右,各接口连接顺序正确的是
(2)下列溶液或用品中:①澄清石灰水;②H2S溶液;③酸性KMnO4溶液;④溴水;⑤Ba(NO3)2溶液;⑥品红溶液;⑦湿润的蓝色石蕊试纸。不能区别SO2和CO2气体的是_______。
| A.①⑤⑦ | B.①⑤ | C.①⑦ | D.②③④⑤⑥ |
Ⅱ. 前几年我国多地发生了严重的雾霾天气,这种天气的形成与汽车尾气排放有关。汽车尾气中常含有CO、NOx等气体,为减轻污染,一般汽车都加装了“催化净化器”,可将汽车尾气中的有毒气体转化为无污染的气体。某化学兴趣小组在实验室模拟汽车尾气处理,设计了下图所示装置(部分夹持装置已略去)。

(3)装置(Ⅲ)的主要作用为
(4)停止加热,打开活塞K,放入适量氧气时,装置(Ⅱ)中可观察到的现象是
(5)该套装置的不完善之处是
(6)汽车尾气中含有CO和NOx,消除它们对大气污染的方法是安装催化转化器,使它们发生反应生成两种无毒的气体,其中一种是单质,该反应的化学方程式为
(7)工业上常用纯碱液来吸收NOx,有关反应的化学方程式为2NO2+Na2CO3=NaNO2+NaNO3+CO2、NO2+NO+Na2CO3=2NaNO2+CO2。现有标准状况下a L NO2和b L NO的混合气体恰好被200 mL Na2CO3溶液完全吸收,则a、b应满足的关系为
您最近一年使用:0次
名校
解题方法
6 . 研究硝酸工业尾气的处理对环境保护和资源的开发利用有重要意义。一种利用硝酸尾气初步处理后获得的高浓度NOx(NO、NO2)气体制备NaNO2、NaNO3的工艺流程如下:
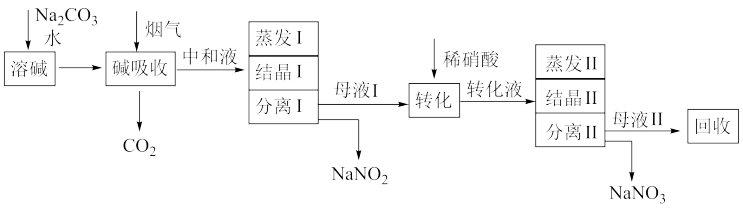
已知:NaNO2在酸性条件下能发生歧化反应。
回答下列问题:
(1)“碱吸收”过程中发生反应的离子方程式为___________ 。
(2)蒸发I产生的蒸气中含有少量的NaNO2等有毒物质,不能直接排放,将其冷凝后用于流程中的___________ (填操作名称)最合理。
(3)“转化”时加入稀HNO3发生反应的化学方程式为___________ 。
(4)若将NaNO2、NaNO3两种产品的物质的量之比设为2:1,则生产2.76吨NaNO2时,Na2CO3的理论用量为___________ 吨(假定Na2CO3恰好完全反应)。
(5)工业制硝酸尾气中的NOx(NO、NO2)常用NaOH溶液吸收,反应的化学方程式为:NO+NO2+2NaOH=2NaNO2+H2O;2NO2+2NaOH=NaNO2+NaNO3+H2O。硝酸尾气中的NOx,通入足量NaOH溶液中充分反应后气体没有剩余,则:
①NOx的x的取值范围为___________ ;
②反应后溶液中n(NO ):n(NO
):n(NO )=
)=___________ (用含x的代数式表示)。

已知:NaNO2在酸性条件下能发生歧化反应。
回答下列问题:
(1)“碱吸收”过程中发生反应的离子方程式为
(2)蒸发I产生的蒸气中含有少量的NaNO2等有毒物质,不能直接排放,将其冷凝后用于流程中的
(3)“转化”时加入稀HNO3发生反应的化学方程式为
(4)若将NaNO2、NaNO3两种产品的物质的量之比设为2:1,则生产2.76吨NaNO2时,Na2CO3的理论用量为
(5)工业制硝酸尾气中的NOx(NO、NO2)常用NaOH溶液吸收,反应的化学方程式为:NO+NO2+2NaOH=2NaNO2+H2O;2NO2+2NaOH=NaNO2+NaNO3+H2O。硝酸尾气中的NOx,通入足量NaOH溶液中充分反应后气体没有剩余,则:
①NOx的x的取值范围为
②反应后溶液中n(NO
 ):n(NO
):n(NO )=
)=
您最近一年使用:0次
解题方法
7 . 在给定条件下,下列选项物质间不满足每一步转化均能实现的是
A.N2(g) NO(g) NO(g) NaNO2(aq) NaNO2(aq) |
B.SiO2 Na2SiO3 Na2SiO3 H2SiO3 H2SiO3 |
C.S SO2 SO2 SO3→H2SO4 SO3→H2SO4 |
D.NH3 NO NO NO2→HNO3 NO2→HNO3 |
您最近一年使用:0次
8 . 亚硝酰氯(NOCl,熔点:-64.5℃,沸点:-5.5℃)为红褐色液体或黄色气体,具有刺鼻恶臭味,遇水剧烈水解生成氮的两种氧化物与氯化氢,易溶于浓硫酸。常可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。其制备装置如图所示(已知:NO+NO2+2NaOH=2NaNO2+H2O):
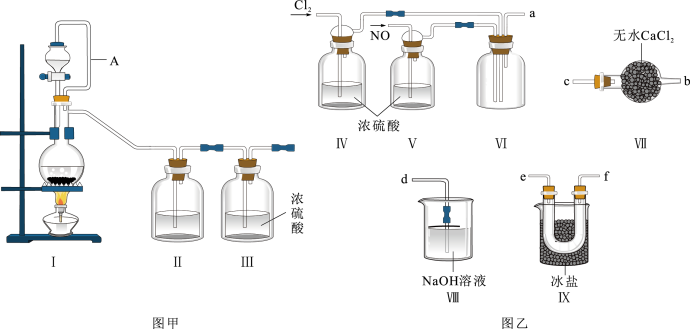
(1)用图甲中装置制备纯净干燥的原料气,补充表中所缺少的药品。
(2)将制得的NO和Cl2通入图乙对应装置制备NOCl。
①装置连接顺序为a→___ (按气流自左向右方向,用小写字母表示)。
②装置Ⅳ、V除可进-步干燥NO、Cl2外,另一个作用是___ 。
(3)有人认为多余的氯气可以通过下列装置暂时储存后再利用,请选择可以用作氯气的储气的装置___ 。

(4)装置Ⅷ吸收尾气时,NOCl发生反应的化学方程式为___ 。
(5)有人认为装置Ⅷ中氢氧化钠溶液只能吸收氯气和NOCl,不能吸收NO,经过查阅资料发现用高锰酸钾溶液可以吸收NO气体,因此在装置Ⅷ氢氧化钠溶液中加入高锰酸钾,反应产生黑色沉淀,写出该反应的离子方程式:___ 。
(6)制得的NOCl中可能含有少量N2O4杂质,为测定产品纯度进行如下实验:称取1.6375g样品溶于50.00mLNaOH溶液中,加入几滴K2CrO4溶液作指示剂,用足量硝酸酸化的0.40mol/LAgNO3溶液滴定至产生砖红色沉淀Ag2CrO4,消耗AgNO3溶液50.00mL。(已知常温下,Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=2×10-12)
①样品的纯度为___ %(保留三位有效数字)
②若在滴定终点时测得溶液中CrO 的浓度是5.0×10-3mol/L,此时溶液中Cl-浓度是
的浓度是5.0×10-3mol/L,此时溶液中Cl-浓度是___ 。

(1)用图甲中装置制备纯净干燥的原料气,补充表中所缺少的药品。
| 装置I | 装置Ⅱ | ||
| 烧瓶中 | 分液漏斗中 | ||
| 制备纯净Cl2 | MnO2 | 浓盐酸 | |
| 制备纯净NO | Cu | 稀硝酸 | 水 |
①装置连接顺序为a→
②装置Ⅳ、V除可进-步干燥NO、Cl2外,另一个作用是
(3)有人认为多余的氯气可以通过下列装置暂时储存后再利用,请选择可以用作氯气的储气的装置

(4)装置Ⅷ吸收尾气时,NOCl发生反应的化学方程式为
(5)有人认为装置Ⅷ中氢氧化钠溶液只能吸收氯气和NOCl,不能吸收NO,经过查阅资料发现用高锰酸钾溶液可以吸收NO气体,因此在装置Ⅷ氢氧化钠溶液中加入高锰酸钾,反应产生黑色沉淀,写出该反应的离子方程式:
(6)制得的NOCl中可能含有少量N2O4杂质,为测定产品纯度进行如下实验:称取1.6375g样品溶于50.00mLNaOH溶液中,加入几滴K2CrO4溶液作指示剂,用足量硝酸酸化的0.40mol/LAgNO3溶液滴定至产生砖红色沉淀Ag2CrO4,消耗AgNO3溶液50.00mL。(已知常温下,Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=2×10-12)
①样品的纯度为
②若在滴定终点时测得溶液中CrO
 的浓度是5.0×10-3mol/L,此时溶液中Cl-浓度是
的浓度是5.0×10-3mol/L,此时溶液中Cl-浓度是
您最近一年使用:0次
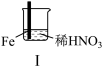
9 . 某学习小组探究某浓度浓硝酸和稀硝酸与铁的反应。
(1)Ⅰ中液面上方气体由无色变为红棕色的化学方程式为_______ 。
(2)取少量Ⅰ中溶液,加入_______ (填名称),溶液变成红色,说明产生了Fe3+。
(3)Ⅱ中现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应。说明硝酸具有_______ 性。
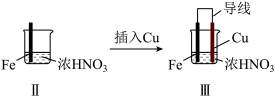
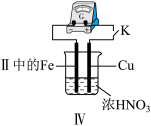
(4)Ⅲ中,连接导线后体系形成了原电池。为分析反应过程,在Fe、Cu之间连接电流计,实验如表。
①推测现象ⅰ中被还原的是_______ 。
②若将该装置Cu电极换成Zn电极,实验过程中是否会出现现象ii_______ (填“是”、“否”) 。
③现象ⅲ中,Fe一直做负极,难以形成氧化层,可能的原因是_______ 。
④用方程式解释现象ⅳ:_______ 。
| 实验 |
|
| |
| 现象 | Ⅰ中:Fe表面产生大量无色气泡,液面上方变为红棕色 | Ⅱ中:Fe表面产生红棕色气泡,过一会儿停止 | Ⅲ中:连接导线,一段时间后Fe表面产生红棕色气泡,而后停止;随即又产生红棕色气泡,而后停止,……如此往复多次。Cu表面始终产生红棕色气泡 |
(2)取少量Ⅰ中溶液,加入
(3)Ⅱ中现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应。说明硝酸具有
(4)Ⅲ中,连接导线后体系形成了原电池。为分析反应过程,在Fe、Cu之间连接电流计,实验如表。
| 实验 | 现象 |
| ⅰ.K闭合时,指针向左偏转(Cu做负极),Fe表面无明显现象 ⅱ.过一会儿指针向右偏,Fe表面产生红棕色气体;后又迅速向左偏,Fe表面停止产生气泡,……如此往复多次 ⅲ.一段时间后,指针一直处于右端,Fe表面持续产生红棕色气体 ⅳ.Cu表面始终产生红棕色气泡 |
②若将该装置Cu电极换成Zn电极,实验过程中是否会出现现象ii
③现象ⅲ中,Fe一直做负极,难以形成氧化层,可能的原因是
④用方程式解释现象ⅳ:
您最近一年使用:0次
2021-05-27更新
|
953次组卷
|
2卷引用:福建省福州一中2021届高三第五次模拟考试化学试题
名校
10 . 已知X、Y、Z、W(含同一种短周期元素)有如图所示转化关系,下列相关说法错误的是
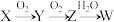
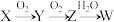
| A.若W为强酸,X为氢化物,则X至少有两种,且两种的水溶液可能发生反应 |
| B.若W为弱酸,X为单质,则X至少有两种,且两种单质可以相互转化 |
| C.若W为强酸,X为氢化物,W与X反应生成固体,该固体一定为硝酸铵 |
| D.若W为强碱,则X只能为金属单质,且化合物Z中存在离子键和非极性键 |
您最近一年使用:0次
2021-05-27更新
|
1081次组卷
|
4卷引用:河北省邯郸市九校联盟2020-2021学年高一下学期期中考试化学试题