名校
解题方法
1 . A、B、C、D、E、F、G为原子序数依次增大的短周期主族元素。B、C、D均能与A形成10电子分子,E单质可用于野外焊接钢轨的原料,F与D同主族。
(1)D、E、F的离子半径由大到小的顺序为_______ (填离子符号)。
(2)写出能证明G比F非金属性强的一个化学方程式:_______ 。
(3)F和G形成的一种化合物甲中所有原子均为8电子稳定结构,该化合物与水反应生成F单质、F的最高价含氧酸和G的氢化物,三种产物的物质的量之比为2∶1∶6,甲的电子式为_______ ,该反应的化学方程式为_______ 。
(4)C能分别与A和D按原子个数比1∶2形成化合物乙和丙,乙的结构式为_______ 。常温下,液体乙与气体丙反应生成两种无污染的物质,该反应的氧化产物与还原产物的物质的量之比为_______ 。
(1)D、E、F的离子半径由大到小的顺序为
(2)写出能证明G比F非金属性强的一个化学方程式:
(3)F和G形成的一种化合物甲中所有原子均为8电子稳定结构,该化合物与水反应生成F单质、F的最高价含氧酸和G的氢化物,三种产物的物质的量之比为2∶1∶6,甲的电子式为
(4)C能分别与A和D按原子个数比1∶2形成化合物乙和丙,乙的结构式为
您最近半年使用:0次
解题方法
2 . 气体中微量的H2S,对工业生产和环境都有危害。通过以下实验装置利用20%脱硫剂三嗪(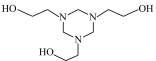 )水溶液除去H2S,并使用2 mol·L-1 CuSO4溶液检验H2S是否除尽。
)水溶液除去H2S,并使用2 mol·L-1 CuSO4溶液检验H2S是否除尽。

回答下列问题:
(1)仪器1的名称是_______ 。装置甲制取CO2,实验室制取CO2的离子方程式为_______ 。
(2)仪器2盛装0.001 mol·L-1H2S水溶液,三颈烧瓶丙中盛装溶液是_______ 。
(3)操作步骤:
①打开开关A、C,放入酸溶液产生CO2,目的是_______ ;
②一段时间后,关小开关C的出气量,打开压缩机开关,同时打开活塞放入H2S水溶液;逐渐减缓仪器1中酸溶液滴入速率并控制气压。使用CO2压缩机的作用是_______ 。
(4)通入二氧化碳所形成的混合气体中,经测量含H2S的量为1000 ×10-6mg·m-3,则该混合气体中c(H2S)计算式为_______ mol·L-1。
(5)三嗪( )水溶液吸收H2S,生成
)水溶液吸收H2S,生成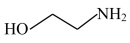 和
和 化学方程式为
化学方程式为_______ 。CuSO4溶液没有出现_______ (填现象), 证明三嗪吸收H2S的化学反应具有_______ 、_______ 等特征,20%三嗪水溶液是很好的脱硫剂。
 )水溶液除去H2S,并使用2 mol·L-1 CuSO4溶液检验H2S是否除尽。
)水溶液除去H2S,并使用2 mol·L-1 CuSO4溶液检验H2S是否除尽。
回答下列问题:
(1)仪器1的名称是
(2)仪器2盛装0.001 mol·L-1H2S水溶液,三颈烧瓶丙中盛装溶液是
(3)操作步骤:
①打开开关A、C,放入酸溶液产生CO2,目的是
②一段时间后,关小开关C的出气量,打开压缩机开关,同时打开活塞放入H2S水溶液;逐渐减缓仪器1中酸溶液滴入速率并控制气压。使用CO2压缩机的作用是
(4)通入二氧化碳所形成的混合气体中,经测量含H2S的量为1000 ×10-6mg·m-3,则该混合气体中c(H2S)计算式为
(5)三嗪(
 )水溶液吸收H2S,生成
)水溶液吸收H2S,生成 和
和 化学方程式为
化学方程式为
您最近半年使用:0次
2022-06-14更新
|
274次组卷
|
2卷引用:江西省抚州市2022届高三下学期4月教学质量监测理综化学试题
名校
解题方法
3 . 下列说法正确的是
| A.向HClO溶液中通入SO2,生成H2SO4,证明H2SO4的酸性比HClO强 |
| B.SO2、H2S为强还原性化合物,都不可用浓硫酸干燥 |
| C.将SO2通入品红溶液,溶液褪色后加热恢复原色 |
| D.蔗糖遇浓H2SO4后变黑,膨胀,最后产生刺激性气味气体,说明浓H2SO4具有酸性、氧化性和脱水性 |
您最近半年使用:0次
2021-09-10更新
|
438次组卷
|
5卷引用:河北省张家口市第一中学2020-2021学年高一下学期4月月考化学试题
河北省张家口市第一中学2020-2021学年高一下学期4月月考化学试题(已下线)4.1.2 硫酸的工业制备 浓硫酸的性质-2021-2022学年高一化学课后培优练(苏教版2019必修第一册)2021年北京高考化学试题变式题1-10(已下线)3.1.2 浓硫酸和硫酸盐-【帮课堂】2022-2023学年高一化学同步精品讲义(沪科版2020必修第一册)山东省鄄城县第一中学2022-2023学年高一下学期2月月考化学试题
名校
解题方法
4 . A、B、C、D、E、F为中学化学常见的单质或化合物,其中A为淡黄色固体单质,B为气体,E的浓溶液能使铁、铝钝化,F为非金属单质。其转化关系如图所示(条件已略去)。
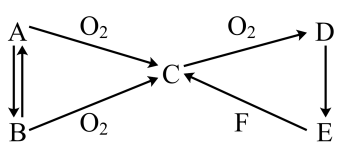
完成下列问题:
(1)写出E转化为C的化学方程式________________________ 。
(2)物质B电子式为________ 。实验室制取少量B时,可用其对应的盐与稀硫酸加热反应,不能选用浓硫酸制取的原因是________________________ 。
(3)空气中含有少量B时,能使银器表面失去金属光泽、逐渐变黑,将变黑的银器放入装满食盐水的铝盆中,二者直接接触,银器恢复往日光泽试写出银器恢复光亮的反应________________________________ 。
(4)设计实验证明C具有氧化性(实验方法及现象)________________________ 。

完成下列问题:
(1)写出E转化为C的化学方程式
(2)物质B电子式为
(3)空气中含有少量B时,能使银器表面失去金属光泽、逐渐变黑,将变黑的银器放入装满食盐水的铝盆中,二者直接接触,银器恢复往日光泽试写出银器恢复光亮的反应
(4)设计实验证明C具有氧化性(实验方法及现象)
您最近半年使用:0次
2020-09-25更新
|
162次组卷
|
2卷引用:山西省实验中学2021届高三9月月考化学试题
解题方法
5 . 已知O、S、Se、Te、Po、Lv是同主族元素,其原子序数依次增大。回答下列问题:
(1)Lv在周期表中的位置是_________ 。
(2)下列有关性质的比较,能用元素周期律解释的是_________ 。
a.离子半径:Te2->Se2- b.热稳定性:H2O>H2S
c.熔、沸点:H2O>H2S d.酸性:H2SO4>H2SeO4
(3)从原子结构角度解释Se与S的最高价氧化物对应的水化物酸性不同的原因_________ 。
(4)实验室用如下方法制备H2S并进行性质验证。

①设计B装置的目的是证明_________ ,B中实验现象为_______________ 。
②实验中经检测发现C中溶液pH降低且出现黑色沉淀。C中反应的离子方程式是_______________ 。
③有同学根据“强酸制弱酸”原理认为装置A、C中两个反应相矛盾,认为C中不可能出现上述现象。该观点不正确的理由是_______________ 。
(1)Lv在周期表中的位置是
(2)下列有关性质的比较,能用元素周期律解释的是
a.离子半径:Te2->Se2- b.热稳定性:H2O>H2S
c.熔、沸点:H2O>H2S d.酸性:H2SO4>H2SeO4
(3)从原子结构角度解释Se与S的最高价氧化物对应的水化物酸性不同的原因
(4)实验室用如下方法制备H2S并进行性质验证。

①设计B装置的目的是证明
②实验中经检测发现C中溶液pH降低且出现黑色沉淀。C中反应的离子方程式是
③有同学根据“强酸制弱酸”原理认为装置A、C中两个反应相矛盾,认为C中不可能出现上述现象。该观点不正确的理由是
您最近半年使用:0次
14-15高三上·上海宝山·期末
解题方法
6 . 硫元素具有可变价态,据此完成以下有关含硫化合物性质的试题。
(1)将H2S气体通入FeCl3溶液中,现象是_____________________________ ;反应的离子方程式是______________________________________ 。
(2)为了探究-2价硫的化合物与+4价硫的化合物反应的条件,设计了下列实验。
已知:电离平衡常数:H2S K1 =1.3×10-7;K2 = 7.1×10-15
H2SO3 K1 =1.7×10-2;K2 = 5.6×10-8
①根据上述实验,可以得出结论:在_________ 条件下,+4价硫的化合物可以氧化-2价硫的化合物。
②将SO2气体通入H2S水溶液中直至过量,下列表示溶液pH随SO2气体体积变化关系示意图正确的是______ (选填编号)。
A.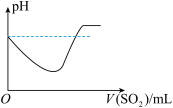 B.
B. 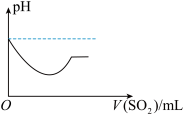
C.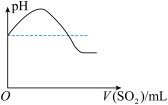 D.
D. 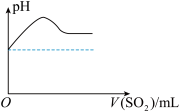
(3)现有试剂:溴水、硫化钠溶液、Na2SO3溶液、稀硫酸、NaOH溶液、氨水。 要证明Na2SO3具有还原性,应选用的试剂有______________ ,看到的现象是 ____________________ 。 要证明Na2SO3具有氧化性,应选用的试剂有___________________ ,反应的离子方程式是________________________________ 。
(4)文献记载,常温下H2S可与Ag发生置换反应生成H2。现将H2S气体通过装有银粉的玻璃管,请设计简单实验,通过检验反应产物证明H2S与Ag发生了置换反应_____________________ 。
(1)将H2S气体通入FeCl3溶液中,现象是
(2)为了探究-2价硫的化合物与+4价硫的化合物反应的条件,设计了下列实验。
| 实验操作 | 实验现象 | |
| 实验1 | 将等浓度的Na2S和Na2SO3溶液按体积比2∶1混合 | 无明显现象 |
| 实验2 | 将H2S通入Na2SO3溶液中 | 未见明显沉淀,再加入少量稀硫酸,立即产生大量浅黄色沉淀 |
| 实验3 | 将SO2通入Na2S溶液中 | 有浅黄色沉淀产生 |
H2SO3 K1 =1.7×10-2;K2 = 5.6×10-8
①根据上述实验,可以得出结论:在
②将SO2气体通入H2S水溶液中直至过量,下列表示溶液pH随SO2气体体积变化关系示意图正确的是
A.
 B.
B. 
C.
 D.
D. 
(3)现有试剂:溴水、硫化钠溶液、Na2SO3溶液、稀硫酸、NaOH溶液、氨水。 要证明Na2SO3具有还原性,应选用的试剂有
(4)文献记载,常温下H2S可与Ag发生置换反应生成H2。现将H2S气体通过装有银粉的玻璃管,请设计简单实验,通过检验反应产物证明H2S与Ag发生了置换反应
您最近半年使用:0次
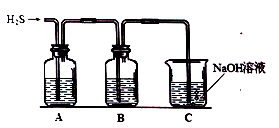
7 . 硫化氢(H2S)是一种具有臭鸡蛋气味的无色气体,有剧毒。某化学兴趣小组设计了制取H2S气体并验证其性质的实验。实验装置如下图所示。
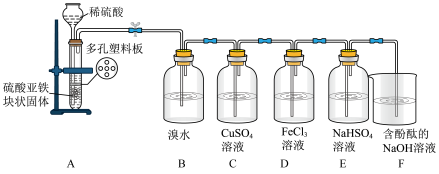
已知:①H2S在水中的溶解度为1:2(体积比),其水溶液称为氢硫酸;
②H2S可与许多金属离子反应生成沉淀;
③H2S有极强的还原性。
请回答下列问题:
(1)装置A为制备H2S气体的发生装置,该装置还可以制取的气体有___________ (任填一种)。装置A中的稀硫酸若换为稀硝酸,是否可行?其理由是_______________________________________________ 。
(2)装置B中溴水橙色褪去,证明溴的非金属性比硫_______________ (填“强”或“弱”)。
(3)装置C中有黑色沉淀(CuS)生成,装置D中有淡黄色沉淀生成,说明Fe3+的氧化性比Cu2+强,请设计实验证明这一结论:____________________________________________________________________ 。
(4)装置E中生成淡黄色沉淀,该反应的离子方程式为_____________ 。
(5)装置F中的现象为_____________________ ,该反应的离子方程式为_________ 。

已知:①H2S在水中的溶解度为1:2(体积比),其水溶液称为氢硫酸;
②H2S可与许多金属离子反应生成沉淀;
③H2S有极强的还原性。
请回答下列问题:
(1)装置A为制备H2S气体的发生装置,该装置还可以制取的气体有
(2)装置B中溴水橙色褪去,证明溴的非金属性比硫
(3)装置C中有黑色沉淀(CuS)生成,装置D中有淡黄色沉淀生成,说明Fe3+的氧化性比Cu2+强,请设计实验证明这一结论:
(4)装置E中生成淡黄色沉淀,该反应的离子方程式为
(5)装置F中的现象为
您最近半年使用:0次
8 . 实验室利用下图装置制备H2S气体,并探究H2S的有关性质。回答下列问题:
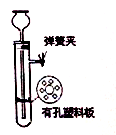
(1)实验开始时,检查装置气密性的方法是_________________ 。
(2)若装置不漏气,加入装置中的药品为_________ (填字母)。
a.FeS和稀硫酸 b.Na2S和稀硫酸 C.ZnS和稀硝酸 d.CuS和稀盐酸
该反应的离子方程式为_________________ 。
(3)打开弹簧夹使反应发生,将生成的H2S气体通入1.0mol/LFe(NO3)3溶液中,观察到有浅黄色固体析出。为探究实际参与该反应的微粒种类,设计如下图装置:
若A装置中加入1.0mol/L的FeCl3溶液,并测其pH=1,则B装置中加入的试剂是______ ;实验观察到A、B中均有浅黄色固体析出,则H2S与Fe(NO3)3溶液反应的离子方程式为_______ 。
(4)实验结束时,使反应停止的操作是______ ;此时反应停止的原因是______________ 。
(5)常温下,以Na2S为样品,选择合理的仪器和试剂设计实验①证明氢硫酸为二元弱酸②测量并估算氢硫酸的Ka2(H2S),则需要的主要计量仪器为电子天平、容量瓶、_____ 、_______ 。

(1)实验开始时,检查装置气密性的方法是
(2)若装置不漏气,加入装置中的药品为
a.FeS和稀硫酸 b.Na2S和稀硫酸 C.ZnS和稀硝酸 d.CuS和稀盐酸
该反应的离子方程式为
(3)打开弹簧夹使反应发生,将生成的H2S气体通入1.0mol/LFe(NO3)3溶液中,观察到有浅黄色固体析出。为探究实际参与该反应的微粒种类,设计如下图装置:

若A装置中加入1.0mol/L的FeCl3溶液,并测其pH=1,则B装置中加入的试剂是
(4)实验结束时,使反应停止的操作是
(5)常温下,以Na2S为样品,选择合理的仪器和试剂设计实验①证明氢硫酸为二元弱酸②测量并估算氢硫酸的Ka2(H2S),则需要的主要计量仪器为电子天平、容量瓶、
您最近半年使用:0次
解题方法
9 . 硫化亚铁是一种黑色块状固体,常温下难溶于水,易溶于酸而生成能溶于水的硫化氢气体。硫化亚铁在空气中煅烧时生成二氧化硫气体和烧渣。
(1)①实验室常用FeS固体与酸反应制取H2S。已知10℃时,FeSO4· 7H2O的溶解度是20.5g,FeCl2·4H2O的溶解度是64.5g。从氧化还原反应、平衡移动和产品纯度等角度分析,实验室制取H2S时最好选用的酸是________ (填字母)。
a.浓硫酸 b.盐酸 c.稀硫酸 d.稀硝酸
②实验室制取H2S时,从反应物与生成物的状态、性质和反应条件分析,下列发生装置可选用的是______ (填序号)。
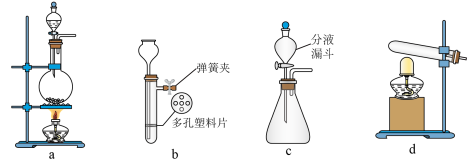
(2)硫化亚铁煅烧得到的烧渣的主要成分为FeO、Fe3O4和Fe2O3等。利用该烧渣制备铁红和副产品无氯钾肥的流程如下:
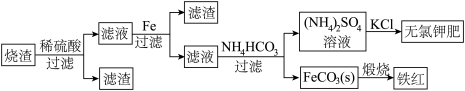
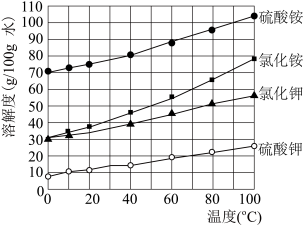
已知四种盐的溶解度随温度变化的曲线如下图所示。请回答下列问题:
①检验加入铁粉过滤后的滤液中是否含有Fe3+的方法是__________ 。该滤液加入NH4HCO3发生反应的离子方程式是________________ 。
②(NH4)2SO4溶液加入KCl后得到无氯钾肥应进行的操作为_________ 、________ 、洗涤、干燥等;反应的化学方程式为_______________ 。
③实验室煅烧FeCO3(s)的操作中需要的仪器除了三脚架、泥三角、酒精灯,还需要_______________ 。
(3)FeS煅烧后生成的SO2通入下列装置:
该实验的目的是_____________ 。若将SO2通入水中制成饱和溶液,请设计实验证明亚硫酸是弱电解质。实验方案________________ 。(提供的药品及仪器:蒸馏水、0.1 mol·L-1的NaOH溶液;pH计,其他仪器自选)
(1)①实验室常用FeS固体与酸反应制取H2S。已知10℃时,FeSO4· 7H2O的溶解度是20.5g,FeCl2·4H2O的溶解度是64.5g。从氧化还原反应、平衡移动和产品纯度等角度分析,实验室制取H2S时最好选用的酸是
a.浓硫酸 b.盐酸 c.稀硫酸 d.稀硝酸
②实验室制取H2S时,从反应物与生成物的状态、性质和反应条件分析,下列发生装置可选用的是

(2)硫化亚铁煅烧得到的烧渣的主要成分为FeO、Fe3O4和Fe2O3等。利用该烧渣制备铁红和副产品无氯钾肥的流程如下:

已知四种盐的溶解度随温度变化的曲线如下图所示。请回答下列问题:

①检验加入铁粉过滤后的滤液中是否含有Fe3+的方法是
②(NH4)2SO4溶液加入KCl后得到无氯钾肥应进行的操作为
③实验室煅烧FeCO3(s)的操作中需要的仪器除了三脚架、泥三角、酒精灯,还需要
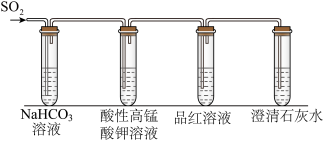
(3)FeS煅烧后生成的SO2通入下列装置:

该实验的目的是
您最近半年使用:0次
10-11高三上·黑龙江牡丹江·期中
解题方法
10 . 已知实验室制取H2S的实验原理为FeS(块状)+H2SO4=FeSO4+H2S↑。根据下图中A~D 的实验装置和试剂进行实验:
(1)装置A是由双孔塞、玻璃导管、________ 和________ 组装起来的。
(2)组装一套制取二氧化硫气体的装置,并证明二氧化硫既有氧化性又有还原性:
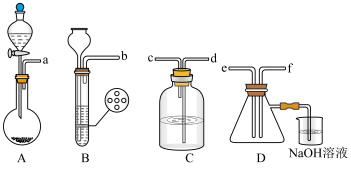
制备SO2的实验原理:Na2SO3(粉末状)+H2SO4(70%)=Na2SO4+SO2↑+H2O。
①按实验装置连接顺序:把a→f各导管口连接起来,正确的顺序是___________ 。
②C装置中的溶液是________ ,说明二氧化硫具有____ 性。
(3)D中产生的现象是____________ ,说明二氧化硫具有____ 性。
(4)烧杯中发生反应的离子方程式为________________________ 。
(1)装置A是由双孔塞、玻璃导管、
(2)组装一套制取二氧化硫气体的装置,并证明二氧化硫既有氧化性又有还原性:

制备SO2的实验原理:Na2SO3(粉末状)+H2SO4(70%)=Na2SO4+SO2↑+H2O。
①按实验装置连接顺序:把a→f各导管口连接起来,正确的顺序是
②C装置中的溶液是
(3)D中产生的现象是
(4)烧杯中发生反应的离子方程式为
您最近半年使用:0次



