解题方法
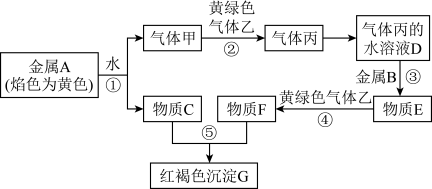
1 . 现有金属单质 A、B 和气体甲、乙、丙及物质 C、D、E、F、G,它们之间能发生如图反应(图中某些反应的产物及条件没有全部标出)。___________ ,氧化产物和还原产物的物质的量之比为 ___________ 。
(2)写出反应④的离子方程式___________ ,该反应证明 E 中的阳离子有___________ (填“氧化性”或“还原性”)。
(3)F 溶液常用于腐蚀覆铜印刷电路板,请写出相关的离子方程式___________ 。腐蚀结束后,通过以下两步可分离出铜,并实现 F 溶液再生:“试剂 a”和“操作”分别为 ___________ 、___________ 。
(2)写出反应④的离子方程式
(3)F 溶液常用于腐蚀覆铜印刷电路板,请写出相关的离子方程式

您最近一年使用:0次
2 . 现有中学化学常见的金属单质A、B、C和气体甲、乙、丙、丁以及物质D、E、F、G、H、X,其中气体乙为黄绿色气体,它们之间的相互转化关系如图所示(图中有些反应的生成物和反应的条件没有标出)。
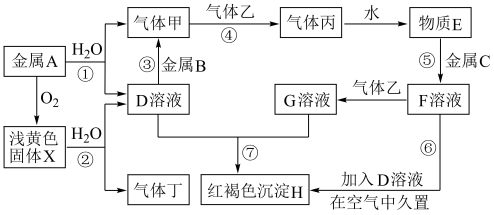
请根据以上信息完成下列各题:
(1)写出反应①的离子方程式:___________ 。
(2)写出反应②的化学方程式:___________ ,该反应的氧化剂是_____ 。
(3)写出反应③的化学方程式:___________ 。
(4)写出反应⑥的化学方程式:___________ 。

请根据以上信息完成下列各题:
(1)写出反应①的离子方程式:
(2)写出反应②的化学方程式:
(3)写出反应③的化学方程式:
(4)写出反应⑥的化学方程式:
您最近一年使用:0次
名校
解题方法
3 . 据题目要求完成下列各题:
(1)写出氯气溶于水的离子反应方程式___________ 。
(2)将4.6g金属钠投入到足量水中,得ag溶液;将4.8g金属镁投入到足量盐酸中,得bg溶液,假设水的质量与盐酸的质量相等,则反应后两溶液的质量关系式为a___________ b(填>、<、=)。
(3) 在碱性溶液中可被NaClO氧化为
在碱性溶液中可被NaClO氧化为 ,而NaClO被还原为NaCl。若反应中
,而NaClO被还原为NaCl。若反应中 与NaClO的物质的量之比为1:13,则x的值为
与NaClO的物质的量之比为1:13,则x的值为___________ 。
(4) 离子在一定条件下可以把
离子在一定条件下可以把 离子氧化,若反应后
离子氧化,若反应后 离子变为
离子变为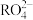 离子,又知反应中氧化剂和还原剂的物质的量之比为5:2,
离子,又知反应中氧化剂和还原剂的物质的量之比为5:2, 离子被氧化后的化合价为
离子被氧化后的化合价为___________ 。
(5)已知爆炸时硝酸铵按下式分解: 。则该反应中被氧化和被还原的N原子数之比为
。则该反应中被氧化和被还原的N原子数之比为___________ 。
(6)高铁酸钠( )是高效的饮用水处理剂,可在碱性溶液环境下由NaClO溶液氧化
)是高效的饮用水处理剂,可在碱性溶液环境下由NaClO溶液氧化 制得。
制得。
①请配平以下化学反应方程式,并用单线桥标出电子转移的方向和数目:________

②每转移3mol电子,生成 的物质的量为
的物质的量为___________ mol。
(1)写出氯气溶于水的离子反应方程式
(2)将4.6g金属钠投入到足量水中,得ag溶液;将4.8g金属镁投入到足量盐酸中,得bg溶液,假设水的质量与盐酸的质量相等,则反应后两溶液的质量关系式为a
(3)
 在碱性溶液中可被NaClO氧化为
在碱性溶液中可被NaClO氧化为 ,而NaClO被还原为NaCl。若反应中
,而NaClO被还原为NaCl。若反应中 与NaClO的物质的量之比为1:13,则x的值为
与NaClO的物质的量之比为1:13,则x的值为(4)
 离子在一定条件下可以把
离子在一定条件下可以把 离子氧化,若反应后
离子氧化,若反应后 离子变为
离子变为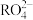 离子,又知反应中氧化剂和还原剂的物质的量之比为5:2,
离子,又知反应中氧化剂和还原剂的物质的量之比为5:2, 离子被氧化后的化合价为
离子被氧化后的化合价为(5)已知爆炸时硝酸铵按下式分解:
 。则该反应中被氧化和被还原的N原子数之比为
。则该反应中被氧化和被还原的N原子数之比为(6)高铁酸钠(
 )是高效的饮用水处理剂,可在碱性溶液环境下由NaClO溶液氧化
)是高效的饮用水处理剂,可在碱性溶液环境下由NaClO溶液氧化 制得。
制得。①请配平以下化学反应方程式,并用单线桥标出电子转移的方向和数目:

②每转移3mol电子,生成
 的物质的量为
的物质的量为
您最近一年使用:0次
2023-11-29更新
|
328次组卷
|
2卷引用:河南省开封市五县联考2023-2024学年高一上学期12月月考化学试题
名校
解题方法
4 . 某实验小组探究钠的性质。
Ⅰ.探究钠与水反应
(1)钠与水反应的化学方程式是___________
(2)钠与水反应放出热量的现象是___________
Ⅱ.探究钠与 的反应,设计如下装置。请回答下列问题:
的反应,设计如下装置。请回答下列问题:
一、实验室用大理石与稀盐酸反应制备
(3)应选用下列装置中的___________ (填序号),乙装置中仪器A的名称是___________ 。
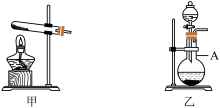
二、钠与 反应
反应
查阅资料:ⅰ.氯化钯溶液与CO反应产生黑色沉淀。
三、钠与 发生反应可能有三种情况:
发生反应可能有三种情况:
①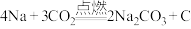 ;
;
② ;
;
②
(4)图中按气流由左至右的顺序,导管口连接顺序为 混合气体→
混合气体→___________ (填接口字母)。

(5)若无装置丁会有什么影响?___________ 。
(6)点燃装置甲中酒精灯之前,需要通一段时间 气体,其目的是
气体,其目的是___________ 。
(7)若装置乙中 溶液中没有黑色沉淀产生,说明上述反应
溶液中没有黑色沉淀产生,说明上述反应___________ (填“①”、“②”或“③”)不可能发生。
(8)为了验证装置甲中钠与 反应的产物,设计如下实验步骤(假设金属钠反应完全),请填写下列表格。
反应的产物,设计如下实验步骤(假设金属钠反应完全),请填写下列表格。
Ⅰ.探究钠与水反应
(1)钠与水反应的化学方程式是
(2)钠与水反应放出热量的现象是
Ⅱ.探究钠与
 的反应,设计如下装置。请回答下列问题:
的反应,设计如下装置。请回答下列问题:一、实验室用大理石与稀盐酸反应制备

(3)应选用下列装置中的
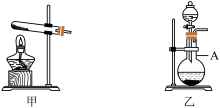
二、钠与
 反应
反应查阅资料:ⅰ.氯化钯溶液与CO反应产生黑色沉淀。
三、钠与
 发生反应可能有三种情况:
发生反应可能有三种情况:①
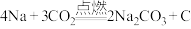 ;
;②
 ;
;②

(4)图中按气流由左至右的顺序,导管口连接顺序为
 混合气体→
混合气体→
(5)若无装置丁会有什么影响?
(6)点燃装置甲中酒精灯之前,需要通一段时间
 气体,其目的是
气体,其目的是(7)若装置乙中
 溶液中没有黑色沉淀产生,说明上述反应
溶液中没有黑色沉淀产生,说明上述反应(8)为了验证装置甲中钠与
 反应的产物,设计如下实验步骤(假设金属钠反应完全),请填写下列表格。
反应的产物,设计如下实验步骤(假设金属钠反应完全),请填写下列表格。| 步骤 | 实验操作及现象 | 实验结论 |
| ① | 取一定量装置甲中反应后的固体溶于足量水中,有黑色不溶固体,过滤 | 说明固体中含有碳 |
| ② | 说明固体中含有 | |
| ③ | 说明固体中含有 |
您最近一年使用:0次
名校
解题方法
5 . 为了研究钠的性质,在实验室里做了如下实验:
(1)将一小块钠投入 溶液中,发生反应的总化学方程式为
溶液中,发生反应的总化学方程式为_______ 。
(2)为粗略测定金属钠的相对原子质量,设计的装置如图所示,该装置(包括水)的总质量为ag,将质量为bg的钠(不足量)放入水中,立即塞紧瓶塞。完全反应后再称量此装置的总质量为cg。

①列出计算钠相对原子质量的数学表达式_______ (用含有a、b、c的算式表示)。
②无水氯化钙的作用是_______ 。若不用无水氯化钙,求出的钠的相对原子质量的实际数值是偏大还是偏小?_______ 。
(3)现有一块部分被氧化为氧化钠的钠块,其质量为10.8g,将它投入一定量的水中完全反应,最终得到含16g溶质的氢氧化钠溶液,回答下列问题:
①反应中生成的氢气为_______ mol。
②钠的质量为_______ g。
(1)将一小块钠投入
 溶液中,发生反应的总化学方程式为
溶液中,发生反应的总化学方程式为(2)为粗略测定金属钠的相对原子质量,设计的装置如图所示,该装置(包括水)的总质量为ag,将质量为bg的钠(不足量)放入水中,立即塞紧瓶塞。完全反应后再称量此装置的总质量为cg。

①列出计算钠相对原子质量的数学表达式
②无水氯化钙的作用是
(3)现有一块部分被氧化为氧化钠的钠块,其质量为10.8g,将它投入一定量的水中完全反应,最终得到含16g溶质的氢氧化钠溶液,回答下列问题:
①反应中生成的氢气为
②钠的质量为
您最近一年使用:0次
6 . 下列实验操作不能达到相应实验目的的是
| 选项 | 实验目的 | 实验操作 |
| A | 比较水与乙醇中羟基氢的活泼性 | 分别将少量钠投入到乙醇和水中,观察现象 |
| B | 检验淀粉的水解反应是否进行完全 | 向水解液中加入碘水,观察溶液是否变蓝 |
| C | 检验淀粉水解是否产生葡萄糖 | 将淀粉和稀硫酸混合加热段时间后,再加入新制的 悬浊液,加热 悬浊液,加热 |
| D | 验证催化剂对化学反应速率的影响 | 在两支试管中各加入5mL 12%  溶液,将其中一支中加入 溶液,将其中一支中加入 ,观察并比较实验现象 ,观察并比较实验现象 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
7 . Ⅰ.探究金属钠与水反应实验过程中,某课外小组同学记录了如下实验现象和实验结论:
①有碱生成;②溶液变红;③钠四处游动;④钠浮在水面上;⑤有气体产生;⑥钠的密度比水小;⑦钠熔成光亮的小球;⑧反应放热,钠熔点低。
(1)请填写下表中的空格(从①~⑧中选择,填序号):
(2)写出钠与水反应的离子方程式:________ 。
Ⅱ.某课外活动小组设计下列装置,验证二氧化碳跟过氧化钠反应时,需要与水接触。
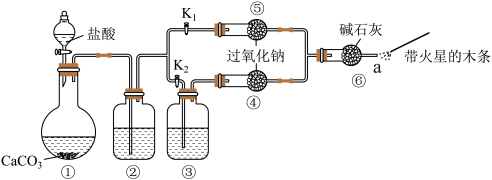
【装置分析】
(3)装置①中反应的离子方程式是________ 。
(4)已知盐酸具有挥发性。装置②中的试剂是________ ,②中反应的离子方程式是________ 。
(5)装置③中的试剂是________ 。
【进行实验】
步骤1:打开弹簧夹 ,关闭
,关闭 ,打开分液漏斗活塞加入盐酸,将带火星的木条放在处。
,打开分液漏斗活塞加入盐酸,将带火星的木条放在处。
步骤2:打开弹簧夹 ,关闭
,关闭 ,打开分液漏斗活塞加入盐酸,将带火星的木条放在处。
,打开分液漏斗活塞加入盐酸,将带火星的木条放在处。
(6)步骤1和步骤2中,a处带火星的木条产生的实验现象分别是________ 、________ 。
(7)写出过氧化钠跟二氧化碳反应的化学方程式并标出反应过程中的电子转移方向和数目:________ 。
Ⅲ.欲探究 和
和 稳定性的相对强弱,两同学分别设计以下两组装置:
稳定性的相对强弱,两同学分别设计以下两组装置:
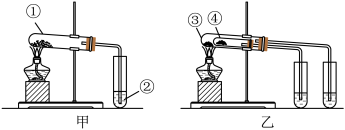
(8)如甲图所示,分别用 和
和 做实验,试管②中的试剂是
做实验,试管②中的试剂是________ 。试管①中发生反应的化学方程式是________ 。
(9)如乙图所示,试管④中装入的固体应该是________ (填化学式)。
(10)通过上述实验,得出的结论是; 比
比 的稳定性
的稳定性________ (填“强”或“弱”)。
(11)向浓度相等、体积均为50mL的A、B两份NaOH溶液中,分别通入一定量的 后,均稀释至100mL。向稀释后的溶液中,逐滴滴加0.1mol/L盐酸,产生
后,均稀释至100mL。向稀释后的溶液中,逐滴滴加0.1mol/L盐酸,产生 的体积(已折合至标准状况)与所加盐酸的体积关系如图所示。
的体积(已折合至标准状况)与所加盐酸的体积关系如图所示。
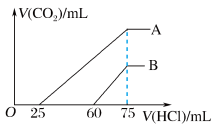
①A曲线表明,原溶液通入 后,所得溶质与盐酸反应产生
后,所得溶质与盐酸反应产生 的最大体积为
的最大体积为________ mL(标准状况)。
②B曲线表明,原溶液通入 后,所得溶液中溶质的化学式为
后,所得溶液中溶质的化学式为________ 。
③原NaOH溶液的物质的量浓度为________ 。
①有碱生成;②溶液变红;③钠四处游动;④钠浮在水面上;⑤有气体产生;⑥钠的密度比水小;⑦钠熔成光亮的小球;⑧反应放热,钠熔点低。
(1)请填写下表中的空格(从①~⑧中选择,填序号):
实验现象 | ⑦ | ③ | ||
实验结论 | ⑥ | ① |
Ⅱ.某课外活动小组设计下列装置,验证二氧化碳跟过氧化钠反应时,需要与水接触。

【装置分析】
(3)装置①中反应的离子方程式是
(4)已知盐酸具有挥发性。装置②中的试剂是
(5)装置③中的试剂是
【进行实验】
步骤1:打开弹簧夹
 ,关闭
,关闭 ,打开分液漏斗活塞加入盐酸,将带火星的木条放在处。
,打开分液漏斗活塞加入盐酸,将带火星的木条放在处。步骤2:打开弹簧夹
 ,关闭
,关闭 ,打开分液漏斗活塞加入盐酸,将带火星的木条放在处。
,打开分液漏斗活塞加入盐酸,将带火星的木条放在处。(6)步骤1和步骤2中,a处带火星的木条产生的实验现象分别是
(7)写出过氧化钠跟二氧化碳反应的化学方程式并标出反应过程中的电子转移方向和数目:
Ⅲ.欲探究
 和
和 稳定性的相对强弱,两同学分别设计以下两组装置:
稳定性的相对强弱,两同学分别设计以下两组装置:
(8)如甲图所示,分别用
 和
和 做实验,试管②中的试剂是
做实验,试管②中的试剂是(9)如乙图所示,试管④中装入的固体应该是
(10)通过上述实验,得出的结论是;
 比
比 的稳定性
的稳定性(11)向浓度相等、体积均为50mL的A、B两份NaOH溶液中,分别通入一定量的
 后,均稀释至100mL。向稀释后的溶液中,逐滴滴加0.1mol/L盐酸,产生
后,均稀释至100mL。向稀释后的溶液中,逐滴滴加0.1mol/L盐酸,产生 的体积(已折合至标准状况)与所加盐酸的体积关系如图所示。
的体积(已折合至标准状况)与所加盐酸的体积关系如图所示。
①A曲线表明,原溶液通入
 后,所得溶质与盐酸反应产生
后,所得溶质与盐酸反应产生 的最大体积为
的最大体积为②B曲线表明,原溶液通入
 后,所得溶液中溶质的化学式为
后,所得溶液中溶质的化学式为③原NaOH溶液的物质的量浓度为
您最近一年使用:0次
8 . 某小组同学探究溶液中的 能否被金属钠还原,进行实验:
能否被金属钠还原,进行实验:
①在干燥试管中加入绿豆大小的金属钠,逐滴滴加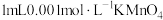 溶液,产生无色气体,溶液由紫红色变为浅绿色
溶液,产生无色气体,溶液由紫红色变为浅绿色 。
。
②向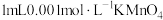 溶液中持续通入
溶液中持续通入 ,水浴加热,溶液颜色无明显变化。
,水浴加热,溶液颜色无明显变化。
③向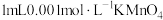 溶液中加入
溶液中加入 固体,溶液由紫红色变为浅绿色。
固体,溶液由紫红色变为浅绿色。
下列说法不正确 的是
 能否被金属钠还原,进行实验:
能否被金属钠还原,进行实验:①在干燥试管中加入绿豆大小的金属钠,逐滴滴加
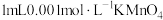 溶液,产生无色气体,溶液由紫红色变为浅绿色
溶液,产生无色气体,溶液由紫红色变为浅绿色 。
。②向
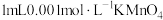 溶液中持续通入
溶液中持续通入 ,水浴加热,溶液颜色无明显变化。
,水浴加热,溶液颜色无明显变化。③向
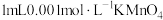 溶液中加入
溶液中加入 固体,溶液由紫红色变为浅绿色。
固体,溶液由紫红色变为浅绿色。下列说法
| A.实验①中还可能观察到钠块浮在溶液表面,剧烈燃烧,发出黄色火焰 |
| B.实验②中的现象说明实验①中溶液变色的原因与产生的气体无关 |
C.实验③中的现象说明实验①中可能发生的反应: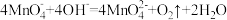 |
D.上述实验能证明溶液中的 可以被金属钠还原 可以被金属钠还原 |
您最近一年使用:0次
2023-05-07更新
|
1673次组卷
|
7卷引用:北京师范大学附属实验中学2023-2024学年暑期高三第一次督导化学试题
北京师范大学附属实验中学2023-2024学年暑期高三第一次督导化学试题北京市海淀区2022-2023学年高三第二次模拟(下学期期末)考试化学试题(已下线)T12-化学反应及限度(已下线)第4讲 钠及其重要化合物(已下线)选择题11-14(已下线)选择题6-10湖南省邵阳市第二中学2023-2024学年高二上学期基础知识竞赛化学试题
名校
9 . 下列“类比”合理的是
A. 可以作为膨松剂,则 可以作为膨松剂,则 也可以作为膨松剂 也可以作为膨松剂 |
B. 溶解度小于 溶解度小于 ,则 ,则 溶解度小于 溶解度小于 |
C.少量 与澄清石灰水生成白色沉淀,则少量 与澄清石灰水生成白色沉淀,则少量 与澄清石灰水也生成白色沉淀 与澄清石灰水也生成白色沉淀 |
D. 与 与 生成 生成 和 和 ,则 ,则 与 与 生成 生成 和 和 |
您最近一年使用:0次
2023-02-12更新
|
604次组卷
|
3卷引用:安徽省六安第一中学2022-2023学年高一下学期第一次阶段检测化学试题
名校
解题方法
10 . 金属钠与下列溶液反应时,既有白色沉淀析出又有气体逸出的是
| A.BaCl2溶液 | B.CuSO4溶液 | C.稀H2SO4溶液 | D.MgCl2溶液 |
您最近一年使用:0次
2023-01-11更新
|
595次组卷
|
4卷引用:河南省洛阳市洛宁县第一高级中学2023-2024学年高三上学期第一次月考化学试题
河南省洛阳市洛宁县第一高级中学2023-2024学年高三上学期第一次月考化学试题河北省石家庄市2023-2024学年高一上学期第二次月考化学试题江苏省靖江高级中学2022-2023学年高一上学期期末调研测试化学试题(已下线)专题05 金属钠及钠的化合物-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(江苏专用)



