名校
1 . 某课外学习小组在学习了 与
与 的反应后,认为
的反应后,认为 与
与 应该也可以反应。他们设计了如图装置
应该也可以反应。他们设计了如图装置 夹持装置已略去,装置的气密性良好
夹持装置已略去,装置的气密性良好 进行实验,探究
进行实验,探究 与
与 反应的产物,请按要求回答下列问题。
反应的产物,请按要求回答下列问题。
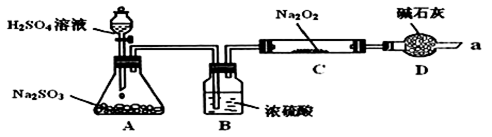
Ⅰ 写出装置A中发生反应的化学方程式:
写出装置A中发生反应的化学方程式:______ 。
Ⅱ 装置D的作用:除了可以防止空气中的
装置D的作用:除了可以防止空气中的 、水蒸气等进入C中与
、水蒸气等进入C中与 反应,还可以
反应,还可以______________________________________________________ 。
Ⅲ 在通入足量的
在通入足量的 与
与 充分反应后,他们对C中固体产物提出如下假设:
充分反应后,他们对C中固体产物提出如下假设:
假设1:只有 ;
;
假设2:___________ ;
假设3:既有 ,又有
,又有 。
。
(1)若假设2成立,写出 与
与 反应的化学方程式:
反应的化学方程式:_________________ 。
(2)某同学设计了如下实验进一步确认产物的成分。
步骤 中将产生的气体通入少量酸性
中将产生的气体通入少量酸性 溶液中,发生反应的离子方程式为:
溶液中,发生反应的离子方程式为:______ 。通过上述实验现象确定假设______ 成立。 选填1、2或
选填1、2或
 与
与 的反应后,认为
的反应后,认为 与
与 应该也可以反应。他们设计了如图装置
应该也可以反应。他们设计了如图装置 夹持装置已略去,装置的气密性良好
夹持装置已略去,装置的气密性良好 进行实验,探究
进行实验,探究 与
与 反应的产物,请按要求回答下列问题。
反应的产物,请按要求回答下列问题。
Ⅰ
 写出装置A中发生反应的化学方程式:
写出装置A中发生反应的化学方程式:Ⅱ
 装置D的作用:除了可以防止空气中的
装置D的作用:除了可以防止空气中的 、水蒸气等进入C中与
、水蒸气等进入C中与 反应,还可以
反应,还可以Ⅲ
 在通入足量的
在通入足量的 与
与 充分反应后,他们对C中固体产物提出如下假设:
充分反应后,他们对C中固体产物提出如下假设:假设1:只有
 ;
;假设2:
假设3:既有
 ,又有
,又有 。
。(1)若假设2成立,写出
 与
与 反应的化学方程式:
反应的化学方程式:(2)某同学设计了如下实验进一步确认产物的成分。
实验步骤 | 现象 |
| 固体全部溶解 |
| 酸性 |
| 产生白色沉淀 |
 中将产生的气体通入少量酸性
中将产生的气体通入少量酸性 溶液中,发生反应的离子方程式为:
溶液中,发生反应的离子方程式为: 选填1、2或
选填1、2或
您最近一年使用:0次
2 . 实验室常用Na2O2与H2O反应快速制取少量O2。用如图所示装置制取O2并进行Na在O2中燃烧的实验。请回答下列问题:
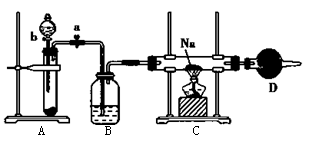
(1)关闭装置中的止水夹a后,开启活塞b,漏斗中的液体不断往下滴,直至全部流入试管。试判断装置是否漏气__________ (填“漏气"“不漏气”或“无法确定”),说明理由:_____________________ 。
(2)写出A装置中所发生反应的化学方程式_______________________________ 。
(3)C装置中观察到的现象是__________ 。
(4)D装置中盛放的试剂是__________ ,其作用是__________ 。

(1)关闭装置中的止水夹a后,开启活塞b,漏斗中的液体不断往下滴,直至全部流入试管。试判断装置是否漏气
(2)写出A装置中所发生反应的化学方程式
(3)C装置中观察到的现象是
(4)D装置中盛放的试剂是
您最近一年使用:0次
名校
3 . Na2O2具有强氧化性,H2具有还原性,某同学根据氧化还原反应的知识推测Na2O2与H2能发生反应。为了验证此推测结果,该同学设计并进行如下实验。
I.实验探究
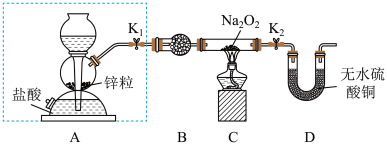
步骤1:按如图所示的装置组装仪器(图中夹持仪器已省略)并检查装置的气密性,然后装入药品。
步骤2:打开K1、K2,在产生的氢气流经装有Na2O2的硬质玻璃管的过程中,未观察到明显现象。
步骤3:进行必要的实验操作,淡黄色的粉末慢慢变成白色固体,无水硫酸铜未变蓝色。
(1)组装好仪器后,要检查装置的气密性。简述检查虚线框内装置气密性的方法:________ 。
(2)B装置中所盛放的试剂是_____ ,其作用是_______ 。
(3)步骤3中的必要操作为打开K1、K2,_______ (请按正确的顺序填入下列步骤的字母)。
A.加热至Na2O2逐渐熔化,反应一段时间
B.用小试管收集气体并检验其纯度
C.关闭K1
D.停止加热,充分冷却
(4)由上述实验可推出Na2O2与H2反应的化学方程式为__________ 。
II.数据处理
(5)实验结束后,该同学欲测定C装置硬质玻璃管内白色固体中未反应完的Na2O2含量。
其操作流程如下:

①测定过程中需要的仪器除固定、夹持仪器外,还有电子天平、烧杯、酒精灯、蒸发皿和____ 。
②在转移溶液时,若溶液转移不完全,则测得的Na2O2质量分数_____ (填“偏大”“偏小”或“不变”)
I.实验探究

步骤1:按如图所示的装置组装仪器(图中夹持仪器已省略)并检查装置的气密性,然后装入药品。
步骤2:打开K1、K2,在产生的氢气流经装有Na2O2的硬质玻璃管的过程中,未观察到明显现象。
步骤3:进行必要的实验操作,淡黄色的粉末慢慢变成白色固体,无水硫酸铜未变蓝色。
(1)组装好仪器后,要检查装置的气密性。简述检查虚线框内装置气密性的方法:
(2)B装置中所盛放的试剂是
(3)步骤3中的必要操作为打开K1、K2,
A.加热至Na2O2逐渐熔化,反应一段时间
B.用小试管收集气体并检验其纯度
C.关闭K1
D.停止加热,充分冷却
(4)由上述实验可推出Na2O2与H2反应的化学方程式为
II.数据处理
(5)实验结束后,该同学欲测定C装置硬质玻璃管内白色固体中未反应完的Na2O2含量。
其操作流程如下:

①测定过程中需要的仪器除固定、夹持仪器外,还有电子天平、烧杯、酒精灯、蒸发皿和
②在转移溶液时,若溶液转移不完全,则测得的Na2O2质量分数
您最近一年使用:0次
2017-10-30更新
|
1137次组卷
|
9卷引用:河北省承德市各县第一中学2018届高三上学期期末考试化学试题
河北省承德市各县第一中学2018届高三上学期期末考试化学试题河北省廊坊市2018-2019学年高二下学期期末考试化学试题江西省百所名校2018届高三第一次联合考试化学试题湖南省衡阳市第八中学2017-2018学年高一(理科实验班)上学期第一次月考理综化学试题山西省大同市2020届高三第一次联合考试(县区)化学试题(已下线)第三章 能力提升检测卷(测)——2021年高考化学一轮复习讲练测甘肃省天水市第一中学2021届高三上学期第一学段考试化学试题(已下线)第06讲 钠及其化合物(练)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)第1讲 钠及其重要化合物
4 . 下列框图中的物质均为中学化学中常见物质,其中甲、乙为单质,其余均为化合物,B为常见液态化合物,A为淡黄色固体,F、G所含元素相同且均为氯化物,G遇KSCN溶液显红色。
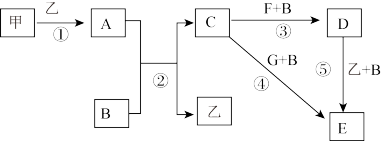
请问答下列问题:
(1)A是____________ ,G是______________ 。(填化学式)
(2)反应①-⑤中,属于氧化还原反应的是________________ (填序号)。
(3)反应⑤的化学方程式为___________ ,甲与B反应的离子方程式 _______ 。
(4)在实验室将C溶液滴入F溶液中,观察到的现象是___________ 。
(5)在F溶液中加入等物质的量的A,发生反应的总的离子方程式为:________ 。
(6)已知:酚酞在c(OH-) 为1.0×10-4mol/L~2.5mol/L时呈红色,且半分钟内不褪色。向3.9g A和 100g B混合后的溶液中滴入2滴酚酞试液,溶液变红色,片刻红色褪去(假设过程中液体体积不变)。
①甲同学认为“红色迅速褪去”是由于溶液中c(OH-)过大造成的。上述观点是否正确__ ,请通过计算对比数据加以说明________________ 。
②乙同学认为“红色迅速褪去”是由于A+B =碱+H2O2,H2O2具有氧化性和漂白性导致的。试设计简单实验证明烧瓶内溶液中含H2O2,简述实验原理____ 。

请问答下列问题:
(1)A是
(2)反应①-⑤中,属于氧化还原反应的是
(3)反应⑤的化学方程式为
(4)在实验室将C溶液滴入F溶液中,观察到的现象是
(5)在F溶液中加入等物质的量的A,发生反应的总的离子方程式为:
(6)已知:酚酞在c(OH-) 为1.0×10-4mol/L~2.5mol/L时呈红色,且半分钟内不褪色。向3.9g A和 100g B混合后的溶液中滴入2滴酚酞试液,溶液变红色,片刻红色褪去(假设过程中液体体积不变)。
①甲同学认为“红色迅速褪去”是由于溶液中c(OH-)过大造成的。上述观点是否正确
②乙同学认为“红色迅速褪去”是由于A+B =碱+H2O2,H2O2具有氧化性和漂白性导致的。试设计简单实验证明烧瓶内溶液中含H2O2,简述实验原理
您最近一年使用:0次
名校
解题方法
5 . 有两个实验小组的同学为探究过氧化钠与二氧化硫的反应,都用如下图所示的装置进行实验。通入SO2气体,将带余烬的木条插入试管C中,木条复燃。
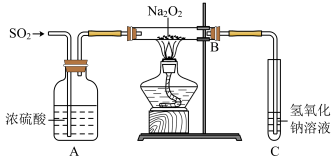
请回答下列问题。
(1)第一小组同学认为Na2O2与SO2反应生成了Na2SO3和O2,该反应的化学方程式是:
______________
(2)请设计一简单实验方案证明Na2O2与SO2反应生成的白色固体中含有Na2SO3_________________________ 。
(3)第二小组同学认为Na2O2与SO2反应除了生成Na2SO3和O2外,还有Na2SO4生成。为检验是否有Na2SO4生成,他们设计了如下方案:

上述方案是否合理?______________________ 。请简要说明两点理由:
①___________________________ ;②____________________________ 。

请回答下列问题。
(1)第一小组同学认为Na2O2与SO2反应生成了Na2SO3和O2,该反应的化学方程式是:
(2)请设计一简单实验方案证明Na2O2与SO2反应生成的白色固体中含有Na2SO3
(3)第二小组同学认为Na2O2与SO2反应除了生成Na2SO3和O2外,还有Na2SO4生成。为检验是否有Na2SO4生成,他们设计了如下方案:

上述方案是否合理?
①
您最近一年使用:0次
9-10高二下·河北衡水·期末
6 . (1)某学生判断SO2和Na2O2反应能生成硫酸钠,你认为他的判断合理吗?__________ 简要说明你的理由:______________________________________________ 。
(2)该同学无法断定SO2和Na2O2反应中是否有氧气生成,拟使用下列装置进行实验
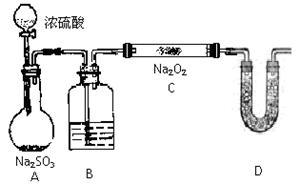
装置中B中的试剂为_____________ ,其作用是_________________________________________________________________
D中的药品为______________ ,其作用是_____________________________________________________________________
(3)为确认SO2和Na2O2反应产物,该同学设计了以下实验步骤,你认为应进行的操作按顺序排列是(填序号)________
(2)该同学无法断定SO2和Na2O2反应中是否有氧气生成,拟使用下列装置进行实验

装置中B中的试剂为
D中的药品为
(3)为确认SO2和Na2O2反应产物,该同学设计了以下实验步骤,你认为应进行的操作按顺序排列是(填序号)
| A.用带火星的细朩条靠近U形管口,观察细朩条是否着火燃烧 |
| B.将C装置中反应后的固体物质溶于适量水配成溶液 |
| C.在配成的溶液中加入用硝酸酸化的硝酸钡溶液,观察是否有沉淀生成 |
| D.在配成的溶液中先加入盐酸酸化,再加入氯化钡溶液,观察是否有气泡或沉淀生成 |
您最近一年使用:0次






