解题方法
1 . I.某校化学课外小组为了鉴别Na2CO3和NaHCO3两种白色固体,用不同的方法做了以下实验,如图所示:
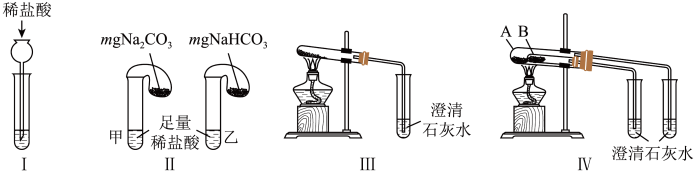
(1)方法Ⅰ,为鉴别Na2CO3和NaHCO3两种白色固体,分别取样配成溶液,再逐滴加入稀盐酸。若将稀盐酸改为Ba(OH)2溶液_______ (填“能”或“不能”)鉴别。
(2)方法Ⅱ,若固体质量相同且稀盐酸足量时,气球鼓起较小的是_______ (填“甲”或“乙”)试管。
(3)方法Ⅲ、Ⅳ均能鉴别这两种物质,加热试管发生反应的化学方程式为________ 。方法Ⅳ中NaHCO3应放在________ (填“A”或“B”)试管中。
Ⅱ.某同学欲配制450mL0.2mol/LNaOH溶液,试回答下列问题:
(4)需要称取NaOH固体的质量为_______ 。
(5)配制过程中若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)?没有洗涤烧杯和玻璃棒_______ ;加蒸馏水时不慎超过了刻度线然后用胶头滴管吸掉多余的溶液至刻度线_______ ;定容时俯视刻度线_______ 。

(1)方法Ⅰ,为鉴别Na2CO3和NaHCO3两种白色固体,分别取样配成溶液,再逐滴加入稀盐酸。若将稀盐酸改为Ba(OH)2溶液
(2)方法Ⅱ,若固体质量相同且稀盐酸足量时,气球鼓起较小的是
(3)方法Ⅲ、Ⅳ均能鉴别这两种物质,加热试管发生反应的化学方程式为
Ⅱ.某同学欲配制450mL0.2mol/LNaOH溶液,试回答下列问题:
(4)需要称取NaOH固体的质量为
(5)配制过程中若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)?没有洗涤烧杯和玻璃棒
您最近一年使用:0次
名校
解题方法
2 . 焦亚硫酸钠 是工业上常用的抗氧化剂。一种湿法制备
是工业上常用的抗氧化剂。一种湿法制备 的生产工艺如下:
的生产工艺如下:

回答下列问题:
(1) 中硫元素的化合价为
中硫元素的化合价为___________ 。
(2)反应1中通入NH3和CO2的顺序为___________ 。
(3)关于上述流程,下列说法正确的是___________(填字母)。
(4)工业上添加 作抗氧化剂时会放出一种有刺激性气味的气体。实验室检验该气体的常用试剂是
作抗氧化剂时会放出一种有刺激性气味的气体。实验室检验该气体的常用试剂是___________ 。
(5)溶液A中阳离子有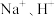 和X离子。检验X离子的操作和现象是
和X离子。检验X离子的操作和现象是___________ 。
(6)获得 需要经过多步反应,其中包括反应3制备
需要经过多步反应,其中包括反应3制备 溶液,然后加入
溶液,然后加入 溶液调
溶液调 转化为
转化为 溶液,再通入
溶液,再通入 生成
生成 ,当溶液中
,当溶液中 含量达到过饱和浓度时,析出
含量达到过饱和浓度时,析出 晶体,反应方程式为
晶体,反应方程式为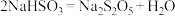 。
。
①反应3的化学方程式为___________ 。
②加入 转化为
转化为 的离子方程式为
的离子方程式为___________ 。
(7)工业上可用焦亚硫酸钠 处理含有
处理含有 的酸性废水,使其转化为毒性较低的
的酸性废水,使其转化为毒性较低的 ,理论上处理
,理论上处理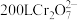 浓度为
浓度为 的废水需要焦亚硫酸钠
的废水需要焦亚硫酸钠___________ g。
 是工业上常用的抗氧化剂。一种湿法制备
是工业上常用的抗氧化剂。一种湿法制备 的生产工艺如下:
的生产工艺如下:
回答下列问题:
(1)
 中硫元素的化合价为
中硫元素的化合价为(2)反应1中通入NH3和CO2的顺序为
(3)关于上述流程,下列说法正确的是___________(填字母)。
| A.该流程中,CO2可以循环使用 |
| B.反应2为分解反应 |
| C.反应3证明硫的非金属性比碳的强 |
D.氨气溶于水使溶液呈碱性的原因是存在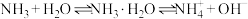 反应 反应 |
(4)工业上添加
 作抗氧化剂时会放出一种有刺激性气味的气体。实验室检验该气体的常用试剂是
作抗氧化剂时会放出一种有刺激性气味的气体。实验室检验该气体的常用试剂是(5)溶液A中阳离子有
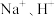 和X离子。检验X离子的操作和现象是
和X离子。检验X离子的操作和现象是(6)获得
 需要经过多步反应,其中包括反应3制备
需要经过多步反应,其中包括反应3制备 溶液,然后加入
溶液,然后加入 溶液调
溶液调 转化为
转化为 溶液,再通入
溶液,再通入 生成
生成 ,当溶液中
,当溶液中 含量达到过饱和浓度时,析出
含量达到过饱和浓度时,析出 晶体,反应方程式为
晶体,反应方程式为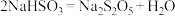 。
。①反应3的化学方程式为
②加入
 转化为
转化为 的离子方程式为
的离子方程式为(7)工业上可用焦亚硫酸钠
 处理含有
处理含有 的酸性废水,使其转化为毒性较低的
的酸性废水,使其转化为毒性较低的 ,理论上处理
,理论上处理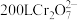 浓度为
浓度为 的废水需要焦亚硫酸钠
的废水需要焦亚硫酸钠
您最近一年使用:0次
2023-12-18更新
|
141次组卷
|
2卷引用:贵州省顶效开发区顶兴学校2023-2024学年高三第二次月考化学试题
3 . A,B、C.D、E五种物质的焰色试验都呈黄色,其中A为金属单质,B为淡黄色固体,五种物质存在如图所示的转化关系。

回答下列问题:
(1)②对应的化学方程式为___________ 。
(2)⑤对应的化学方程式为___________ 。
(3)2molB与足量的水反应时,转移的电子数目为___________ 。
(4)若D的固体中含有少量的E,则除去E的方法为___________ 。
(5)E溶液与稀HCl反应的离子方程式为___________ 。
(6)上述转化关系中,涉及氧化还原反应的是___________ (填序号)。

回答下列问题:
(1)②对应的化学方程式为
(2)⑤对应的化学方程式为
(3)2molB与足量的水反应时,转移的电子数目为
(4)若D的固体中含有少量的E,则除去E的方法为
(5)E溶液与稀HCl反应的离子方程式为
(6)上述转化关系中,涉及氧化还原反应的是
您最近一年使用:0次
4 . 工业上“侯氏制碱法”以NaCl、NH3、CO2及水等为原料制备纯碱,其反应原理为:NaCl +NH3+H2O+CO2 =NaHCO3↓+NH4Cl。生产纯碱的工艺流程示意图如下:

(1)上述沉淀池中发生反应的离子方程式_________ ,实验室分离出沉淀的操作名称是_________ ,煅烧炉里进行的化学反应方程式为:_________ 。
(2)写出上述流程中X物质的化学式_________ 。
(3)使原料氯化钠的利用率从70%提高到90%以上,主要是设计了_________ (填上述流程中的循环1或循环2)
(4)为检验产品碳酸钠中是否含有氯离子,可取少量试样溶于水后,还需要的试剂有_________ 。

(1)上述沉淀池中发生反应的离子方程式
(2)写出上述流程中X物质的化学式
(3)使原料氯化钠的利用率从70%提高到90%以上,主要是设计了
(4)为检验产品碳酸钠中是否含有氯离子,可取少量试样溶于水后,还需要的试剂有
您最近一年使用:0次
解题方法
5 . 侯德榜是我国近代化学工业的奠基人之一,他将氨碱法制取碳酸钠与合成氨联合起来,形成联合制碱法(也称侯氏制碱法),该法缩短了生产流程,提高了食盐利用率。侯氏制碱法过程中首先得到的是 ,再加热分解得到碳酸钠。某化学兴趣小组在实验室模拟侯氏制碱法的装置如图所示(夹持装置已略去)。
,再加热分解得到碳酸钠。某化学兴趣小组在实验室模拟侯氏制碱法的装置如图所示(夹持装置已略去)。
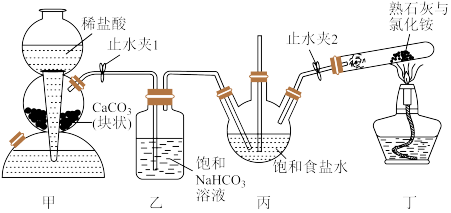
已知:氨气极易溶于水,氨气溶于水后所得溶液呈碱性;二氧化碳在碱性溶液中的溶解度大于在饱和食盐水中的溶解度。根据所学知识回答下列问题:
(1)用于制取氨气的装置为_______ (填“甲”或“丁”)。
(2)装置乙中饱和 溶液的作用为
溶液的作用为_______ 。
(3)装置丙中发生反应的离子方程式为_______ 。
(4)为了提高食盐的利用率应先打开_______ (填“止水夹1”或“止水夹2”)。
(5)分析装置甲中的稀盐酸能否用稀硫酸代替,并说明原因:_______ 。
(6)取一定质量制得的 固体置于埚中加热分解得到固体
固体置于埚中加热分解得到固体 。请设计实验检验固体
。请设计实验检验固体 中是否含有
中是否含有 :
:_______ ;若固体 中还含有
中还含有 ,则
,则 发生反应的化学方程式为
发生反应的化学方程式为_______ 。
 ,再加热分解得到碳酸钠。某化学兴趣小组在实验室模拟侯氏制碱法的装置如图所示(夹持装置已略去)。
,再加热分解得到碳酸钠。某化学兴趣小组在实验室模拟侯氏制碱法的装置如图所示(夹持装置已略去)。
已知:氨气极易溶于水,氨气溶于水后所得溶液呈碱性;二氧化碳在碱性溶液中的溶解度大于在饱和食盐水中的溶解度。根据所学知识回答下列问题:
(1)用于制取氨气的装置为
(2)装置乙中饱和
 溶液的作用为
溶液的作用为(3)装置丙中发生反应的离子方程式为
(4)为了提高食盐的利用率应先打开
(5)分析装置甲中的稀盐酸能否用稀硫酸代替,并说明原因:
(6)取一定质量制得的
 固体置于埚中加热分解得到固体
固体置于埚中加热分解得到固体 。请设计实验检验固体
。请设计实验检验固体 中是否含有
中是否含有 :
: 中还含有
中还含有 ,则
,则 发生反应的化学方程式为
发生反应的化学方程式为
您最近一年使用:0次
2022-11-10更新
|
144次组卷
|
3卷引用:贵州省遵义市2022-2023学年高一上学期期中考试化学试题
6 . 有A、B两种氧化物,焰色试验均为黄色,其转化关系如下图所示(其他物质均已略去)。请回答下列问题:
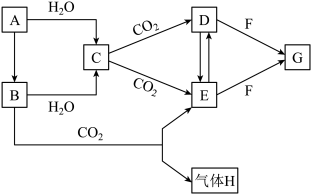
(1)写出A的化学式:___________ 。
(2)写出B→C的化学方程式:___________ 。
(3)B可与 反应生成E与气体H,该反应在生活中可用于
反应生成E与气体H,该反应在生活中可用于___________ 。
(4)有同学提议可用 溶液鉴别D与E,你认为该方案
溶液鉴别D与E,你认为该方案___________ (填“可行”或“不可行”),原因是___________ 。
(5)D与E可互相转化,请写出E→D的化学方程式:___________ 。
(6)若F为人体胃液中的主要成分,则G为___________ 。

(1)写出A的化学式:
(2)写出B→C的化学方程式:
(3)B可与
 反应生成E与气体H,该反应在生活中可用于
反应生成E与气体H,该反应在生活中可用于(4)有同学提议可用
 溶液鉴别D与E,你认为该方案
溶液鉴别D与E,你认为该方案(5)D与E可互相转化,请写出E→D的化学方程式:
(6)若F为人体胃液中的主要成分,则G为
您最近一年使用:0次
7 . 化工专家侯德榜发明的侯氏制碱法为我国纯碱工业和国民经济发展做出了重要贡献,某兴趣小组模拟和改进侯氏制碱法制备纯碱(碳酸氢钠固体分解而得),并进行后续实验,实验如下:

已知:饱和氨盐水是指将氨气通入饱和食盐水中形成的溶液。
回答下列问题:
(1)装置甲中盛装盐酸的仪器名称是_______ ;装置乙中的试剂是_______ 。
(2)装置丙中使用雾化装置的优点是_______ ,该装置中生成 的总反应化学方程式为
的总反应化学方程式为_______ 。
(3)检验纯碱样品中是否混有 ,选择下列装置中的
,选择下列装置中的_______ (填字母编号)组装并进行实验,可观察到的实验现象是_______ 。

(4)若该纯碱样品中所含杂质只有碳酸氢钠,测定该纯碱样品纯度的方法为:称取42.0g样品,加热到质量不再改变,收集到标准状况下的气体112mL,则该纯碱样品的纯度为_______ 。

已知:饱和氨盐水是指将氨气通入饱和食盐水中形成的溶液。
回答下列问题:
(1)装置甲中盛装盐酸的仪器名称是
(2)装置丙中使用雾化装置的优点是
 的总反应化学方程式为
的总反应化学方程式为(3)检验纯碱样品中是否混有
 ,选择下列装置中的
,选择下列装置中的
(4)若该纯碱样品中所含杂质只有碳酸氢钠,测定该纯碱样品纯度的方法为:称取42.0g样品,加热到质量不再改变,收集到标准状况下的气体112mL,则该纯碱样品的纯度为
您最近一年使用:0次
8 . 化工专家侯德榜发明的侯氏制碱法为我国纯碱工业和国民经济发展做出了重要贡献,某化学兴趣小组在实验室中模拟并改进侯氏制碱法制备 ,进一步处理得到产品
,进一步处理得到产品 和
和 ,实验流程如图:
,实验流程如图:

回答下列问题:
(1)从海水中提取NaCl固体时,为先后除去 、
、 、
、 ,除杂试剂应依次加入
,除杂试剂应依次加入 、
、_______ 、_______ (填化学式);
(2)生成 的总反应的化学方程式为
的总反应的化学方程式为_______ 。
(3)向母液中加入NaCl粉末,存在 过程。为使
过程。为使 沉淀充分析出并分离,根据NaCl和
沉淀充分析出并分离,根据NaCl和 溶解度曲线,需采用的操作为
溶解度曲线,需采用的操作为_______ 、过滤、洗涤、干燥。

(4)对固体 充分加热,产生的气体先通过足量浓硫酸,再通过足量
充分加热,产生的气体先通过足量浓硫酸,再通过足量 ,
, 增重0.28g,则固体
增重0.28g,则固体 的质量为
的质量为_______ g。
 ,进一步处理得到产品
,进一步处理得到产品 和
和 ,实验流程如图:
,实验流程如图:
回答下列问题:
(1)从海水中提取NaCl固体时,为先后除去
 、
、 、
、 ,除杂试剂应依次加入
,除杂试剂应依次加入 、
、(2)生成
 的总反应的化学方程式为
的总反应的化学方程式为(3)向母液中加入NaCl粉末,存在
 过程。为使
过程。为使 沉淀充分析出并分离,根据NaCl和
沉淀充分析出并分离,根据NaCl和 溶解度曲线,需采用的操作为
溶解度曲线,需采用的操作为
(4)对固体
 充分加热,产生的气体先通过足量浓硫酸,再通过足量
充分加热,产生的气体先通过足量浓硫酸,再通过足量 ,
, 增重0.28g,则固体
增重0.28g,则固体 的质量为
的质量为
您最近一年使用:0次
解题方法
9 . 膨松剂反应时产生气体的量是检验膨松剂品质的一项重要指标。某膨松剂中发挥作用的物质为碳酸氢钠,学校兴趣小组为研究该膨松剂在加热情况下放出气体的量,设计了如图所示实验(装置A、C、D、E中的试剂足量)。

回答下列问题:
(1)加热前,需向装置内通入空气,用离子反应方程式解释装置A的作用______ ,停止加热后,还需继续通入一段时间的空气,目的是________ 。
(2)将一定质量的膨松剂样品装入装置B中,装置B中可能发生反应的化学反应方程式为____ ;样品产生的二氧化碳的质量可通过测定实验前后装置____ (填装置对应的标号)的质量测得。
(3)若没有装置E,可能会造成测定结果_____ (填“偏大”、“偏小”或“不变”)。
(4)实验测得二氧化碳的质量为13.2 g,则二氧化碳的体积(标准状况)为____ L,膨松剂样品中所含碳酸氢钠的物质的量为_____ mol。

回答下列问题:
(1)加热前,需向装置内通入空气,用离子反应方程式解释装置A的作用
(2)将一定质量的膨松剂样品装入装置B中,装置B中可能发生反应的化学反应方程式为
(3)若没有装置E,可能会造成测定结果
(4)实验测得二氧化碳的质量为13.2 g,则二氧化碳的体积(标准状况)为
您最近一年使用:0次
名校
10 . 有一含NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如图所示的实验装置,通过测量反应产生的CO2和H2O的质量,来确定该混合物中各组分的质量分数。
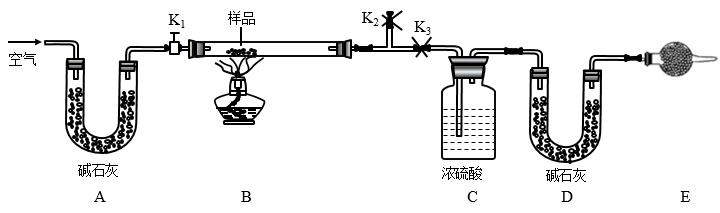
(1)实验步骤:
①按图(夹持仪器未画出)组装好实验装置后,首先进行的操作是______ 。
②称取样品,并将其放入硬质玻璃管中,称量装浓硫酸的洗气瓶C的质量和装碱石灰的U形管D的质量。
③打开活塞K1、K2,关闭K3,缓缓鼓入空气数分钟,其目的是______ 。
④关闭活塞K1、K2,打开K3,点燃酒精灯加热至不再产生气体。装置B中发生反应的化学方程式为______ 、______ 。
⑤打开活塞K1,缓缓鼓入空气数分钟,然后拆下装置,再次称量洗气瓶C的质量和U形管D的质量。
(2)关于该实验方案,请回答下列问题。
①若加热反应后不鼓入空气,对NaCl质量测定结果的影响是______ 。(填“偏大”“偏小”或“无影响”)。
②E处干燥管中盛放的药品是碱石灰,其作用是______ ,如果实验中没有该装置,则会导致测量结果NaHCO3的质量______ (填“偏大”“偏小”或“无影响”)。
③若样品质量为w g,反应后C、D装置增加的质量分别为m1g、m2g,则混合物中Na2CO3·10H2O的质量分数为______ (用含w、m1、m2的代数式表示)。

(1)实验步骤:
①按图(夹持仪器未画出)组装好实验装置后,首先进行的操作是
②称取样品,并将其放入硬质玻璃管中,称量装浓硫酸的洗气瓶C的质量和装碱石灰的U形管D的质量。
③打开活塞K1、K2,关闭K3,缓缓鼓入空气数分钟,其目的是
④关闭活塞K1、K2,打开K3,点燃酒精灯加热至不再产生气体。装置B中发生反应的化学方程式为
⑤打开活塞K1,缓缓鼓入空气数分钟,然后拆下装置,再次称量洗气瓶C的质量和U形管D的质量。
(2)关于该实验方案,请回答下列问题。
①若加热反应后不鼓入空气,对NaCl质量测定结果的影响是
②E处干燥管中盛放的药品是碱石灰,其作用是
③若样品质量为w g,反应后C、D装置增加的质量分别为m1g、m2g,则混合物中Na2CO3·10H2O的质量分数为
您最近一年使用:0次
2021-02-20更新
|
428次组卷
|
20卷引用:贵州省榕江县第三高级中学2019-2020学年高一上学期期末考试化学试题
贵州省榕江县第三高级中学2019-2020学年高一上学期期末考试化学试题贵州省贞丰县第二中学2019-2020学年高一上学期期末考试化学试题云南省通海三中2019-2020学年高一上学期期末考试化学试题云南省玉溪市通海二中2019-2020学年高一上学期期末考试化学试题云南省迪庆州维西县第二中学2019-2020学年高一上学期期末考试化学试题云南省富宁县三中2019-2020学年高一上学期期末考试化学试题云南省普洱市镇沅县第一中学2019—2020学年高一上学期期末考试化学试题云南省丽江市永胜县第二中学2019—2020学年高一上学期期末考试化学试题云南省盐津县第三中学2019-2020学年高一上学期期末考试化学试题云南省昭通市彝良县一中2019—2020学年高一上学期期末考试化学试题云南省昭通市大关县第二中学2019-2020学年高一上学期期末考试化学试题云南省曲靖市马龙区第二中学2019-2020学年 高一上学期期末考试化学试题云南省曲靖市富源县第六中学2019-2020学年高一上学期期末考试化学试题云南省昆明市寻甸县第五中学2019-2020学年高一上学期期末考试化学试题广西河池市都安第五高中2019-2020学年高一上学期期末考试化学试题广西来宾市象州县中学2019-2020学年高一上学期期末考试化学试题四川省泸县第五中学2019-2020学年高一下学期第一次在线月考化学试题安徽省滁州市定远县重点中学2020-2021学年高一10月月考化学试题重庆实验中学2020-2021学年高一上学期第一阶段测试化学试题四川省遂宁中学校2020-2021学年高一上学期12月月考化学试题



