名校
1 . 某化学兴趣小组模拟“侯氏制碱法”制纯碱并进行后续实验。
I.制备纯碱:先以NaCl、NH3、CO2和水等为原料,用下图所示装置制取NaHCO3,然后再将NaHCO3制备成Na2CO3。
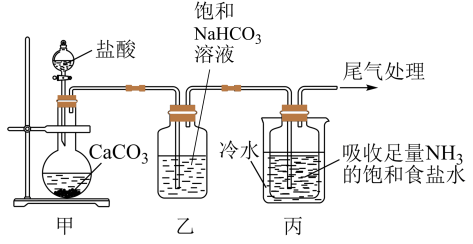
(1)装置乙的作用是_______ ,反应的化学方程式为_______ 。
(2)反应进行一段时间后,观察到装置丙中试剂瓶内溶液中有白色固体析出,经检验该白色固体是NaHCO3。装置丙中可得两种产物,分别是NaHCO3和另一种盐,装置丙中反应的化学方程式为____ 。
(3)用装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有过滤、洗涤、_______ ,最后一步发生反应的化学方程式为_______ 。
II.测定所得产品的组成和纯度
(4)检验纯碱样品中是否混有NaHCO3,请选择下列装置设计实验,并完成下表:
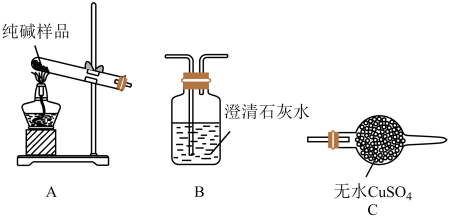
(5)测定该纯碱样品的纯度:称取m1g样品,置于小烧杯中,加水溶解,滴加足量CaCl2溶液。将反应混合物过滤、洗涤、干燥、称量,得到固体的质量为m2g。则该纯碱样品的纯度为_______ 。请另设计一个实验方案,测定纯碱样品的纯度(样品中只含有NaHCO3杂质)_______ 。
I.制备纯碱:先以NaCl、NH3、CO2和水等为原料,用下图所示装置制取NaHCO3,然后再将NaHCO3制备成Na2CO3。

(1)装置乙的作用是
(2)反应进行一段时间后,观察到装置丙中试剂瓶内溶液中有白色固体析出,经检验该白色固体是NaHCO3。装置丙中可得两种产物,分别是NaHCO3和另一种盐,装置丙中反应的化学方程式为
(3)用装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有过滤、洗涤、
II.测定所得产品的组成和纯度
(4)检验纯碱样品中是否混有NaHCO3,请选择下列装置设计实验,并完成下表:

| 选择的装置(填编号) | 实验现象 | 实验结论 |
| 样品中含NaHCO3 |
您最近一年使用:0次
2022-08-21更新
|
474次组卷
|
2卷引用:陕西省西安市长安区第一中学2021-2022学年高一上学期期末考试化学试题
名校
2 . Ⅰ.钠及其化合物有非常重要的用途。
(1)钠的化学性质非常活泼。画出钠原子结构示意图:_______ 。
(2)某课外活动小组为了检验钠与水反应的产物,设计如图装置(夹持装置省略)。首先在U形管内加入少量煤油和几粒钠块,再从U形管高端加入水(含有酚酞),赶出空气,过一会儿点燃酒精灯加热铜丝。

根据反应中观察到的现象,回答下列问题:
①反应过程中金属钠逐渐变小,请写出该反应的化学方程式:_______ 。
②铜丝的变化现象为_______ ,反应的化学方程式是 :_______ 。
Ⅱ.现用金属钠和空气制备纯度较高的Na2O2,可利用的装置如图。
提示:Na2O2可以与H2O、CO2反应。

(3)上述装置④中盛放的试剂是_______ ,为完成实验应将装置④接在_______ (填字母)。
A.①之前 B.①和②之间 C.②和③之间 D.③之后
(4)点燃酒精灯后,装置②中Na生成Na2O2的化学方程式为_______ 。
(5)若缺少装置④,则产生的Na2O2会和水反应,反应的化学方程式为_______ 。
III.为探究Na2CO3和NaHCO3的热稳定性,某同学设计了如图实验:

(6)加热一段时间后,_______ (填“A”或“B”)中澄清石灰水变浑浊,写出试管中发生反应的化学方程式:_______ 。
(1)钠的化学性质非常活泼。画出钠原子结构示意图:
(2)某课外活动小组为了检验钠与水反应的产物,设计如图装置(夹持装置省略)。首先在U形管内加入少量煤油和几粒钠块,再从U形管高端加入水(含有酚酞),赶出空气,过一会儿点燃酒精灯加热铜丝。

根据反应中观察到的现象,回答下列问题:
①反应过程中金属钠逐渐变小,请写出该反应的化学方程式:
②铜丝的变化现象为
Ⅱ.现用金属钠和空气制备纯度较高的Na2O2,可利用的装置如图。
提示:Na2O2可以与H2O、CO2反应。

(3)上述装置④中盛放的试剂是
A.①之前 B.①和②之间 C.②和③之间 D.③之后
(4)点燃酒精灯后,装置②中Na生成Na2O2的化学方程式为
(5)若缺少装置④,则产生的Na2O2会和水反应,反应的化学方程式为
III.为探究Na2CO3和NaHCO3的热稳定性,某同学设计了如图实验:

(6)加热一段时间后,
您最近一年使用:0次
名校
解题方法
3 . 按要求填空(每空2分,共20分)
(1)2Fe+3Cl2 2FeCl3,氧化剂是
2FeCl3,氧化剂是_______ ,发生氧化反应的是_______ 。
(2)将小块钠投入到硫酸铜的稀溶液中,观察到的现象是:①钠浮于液面上 ②熔化成小球 ③发出“嘶嘶”的响声,放出气体 ④有蓝色沉淀产生,用化学方程式解释实验现象:_______ 。
(3)某化学兴趣小组用如图装置制备家用消毒液。

①装置A中的溶液是_______ ,长玻璃导管的作用是_______ ,图中装置的连接顺序是B→_______ 。
②居家消毒时,不能将“84”消毒液与洁厕灵(主要成分是盐酸)混合使用,原因是_______ 。
(4)如图所示实验为“套管实验”,小试管内塞有沾有白色无水硫酸铜粉末的棉花球。

①点燃酒精灯加热,能观察到的实验现象是小试管中棉花_______ ,B烧杯中_______ 。
②实验结论:Na2CO3的热稳定性比NaHCO3_______ 。(填“强”或“弱”)
(1)2Fe+3Cl2
 2FeCl3,氧化剂是
2FeCl3,氧化剂是(2)将小块钠投入到硫酸铜的稀溶液中,观察到的现象是:①钠浮于液面上 ②熔化成小球 ③发出“嘶嘶”的响声,放出气体 ④有蓝色沉淀产生,用化学方程式解释实验现象:
(3)某化学兴趣小组用如图装置制备家用消毒液。

①装置A中的溶液是
②居家消毒时,不能将“84”消毒液与洁厕灵(主要成分是盐酸)混合使用,原因是
(4)如图所示实验为“套管实验”,小试管内塞有沾有白色无水硫酸铜粉末的棉花球。

①点燃酒精灯加热,能观察到的实验现象是小试管中棉花
②实验结论:Na2CO3的热稳定性比NaHCO3
您最近一年使用:0次
名校
解题方法
4 . 某化学兴趣小组在实验室中模拟工业制备碳酸氢钠晶体。在浓氨水中加入NaCl粉末得到饱和氨盐水。向饱和氨盐水(NH3·H2O)中通入CO2,获得碳酸氢钠晶体。并进一步处理得到产品Na2CO3和NH4Cl,实验装置如图,回答下列问题:
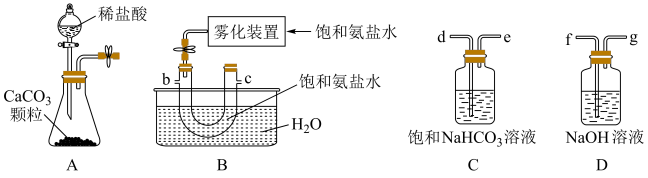
(1)用A~D仪器制备NaHCO3,正确的连接顺序是a→________ (按气流方向,用小写字母表示)。
(2)某同学实验室发现A中分液漏斗内的稀盐酸没有滴下,于是将A 装置图改进后可使稀盐酸顺利滴下,请回答改进后的A装置中的橡皮导管的作用。
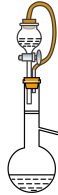 (改进后的A装置)
(改进后的A装置)
①____________________ 。
②__________________ 。
(3)反应完成后,将B中U形管内的混合物处理得到滤液和固体NaHCO3。生成NaHCO3的总反应的化学方程式为________________ 。
(4)对固体NaHCO3充分加热,产生的气体先通过足量浓硫酸,再通过足量Na2O2,Na2O2增重0.28g,则固体NaHCO3的质量为___________ g。
(5)D装置NaOH溶液中吸收一定量的CO2后,充分反应后,将溶液蒸发结晶,得到少量白色固体,请设计实验确认该团队的成分:
①提出合理假设:
假设1:该固体为NaOH和Na2CO3
假设2:该固体只有Na2CO3
假设3:该固体只有___________ 。
假设4:该固体为______________ 。
②请涉及实验验证假设1的固体是NaOH和Na2CO3,写出步骤及预期的实验现象和结论。(步骤可不填满也可增加)
限选的试剂、仪器:1mol/L HCl、1mol/L MgCl2、0.5mol/L BaCl2和1mol/L Ba(OH)2溶液,甲基橙、酚酞试液,试管、胶头滴管、过滤装置。

(1)用A~D仪器制备NaHCO3,正确的连接顺序是a→
(2)某同学实验室发现A中分液漏斗内的稀盐酸没有滴下,于是将A 装置图改进后可使稀盐酸顺利滴下,请回答改进后的A装置中的橡皮导管的作用。
 (改进后的A装置)
(改进后的A装置)①
②
(3)反应完成后,将B中U形管内的混合物处理得到滤液和固体NaHCO3。生成NaHCO3的总反应的化学方程式为
(4)对固体NaHCO3充分加热,产生的气体先通过足量浓硫酸,再通过足量Na2O2,Na2O2增重0.28g,则固体NaHCO3的质量为
(5)D装置NaOH溶液中吸收一定量的CO2后,充分反应后,将溶液蒸发结晶,得到少量白色固体,请设计实验确认该团队的成分:
①提出合理假设:
假设1:该固体为NaOH和Na2CO3
假设2:该固体只有Na2CO3
假设3:该固体只有
假设4:该固体为
②请涉及实验验证假设1的固体是NaOH和Na2CO3,写出步骤及预期的实验现象和结论。(步骤可不填满也可增加)
限选的试剂、仪器:1mol/L HCl、1mol/L MgCl2、0.5mol/L BaCl2和1mol/L Ba(OH)2溶液,甲基橙、酚酞试液,试管、胶头滴管、过滤装置。
| 实验步骤: | 预期现象和结论 |
| 步骤1: | |
| 步骤2: | |
| 步骤3: |
您最近一年使用:0次
2022-12-26更新
|
206次组卷
|
2卷引用:湖北省武汉市第六中学2021-2022学年高一上学期10月月考化学试题
名校
解题方法
5 . 启普发生器是荷兰科学家设计的实验室气体发生装置,由图中漏斗1和容器2两部分构成;现借助启普发生器及相关装置模拟侯氏制碱法制备日用化学品—— 和
和 并进行后续实验。回答相关问题:
并进行后续实验。回答相关问题:
I. 的制备反应原理:
的制备反应原理:
反应装置:

(1)启普发生器中发生的反应方程式为_______ 。
(2)仪器3中盛装的试剂是饱和的 溶液,其作用
溶液,其作用_______ 。
(3)仪器5中稀硫酸的作用是_______ 。
II.的制备
(4)将仪器4中所得固体加热可得到 ,写出相关的化学方程式
,写出相关的化学方程式_______ 。
III.测定所得产品的组成和纯度
(5)检验纯碱样品中是否混有 ,请选择下列装置设计实验,并完成下表。
,请选择下列装置设计实验,并完成下表。

(6)测定该纯碱样品的纯度:称取 g样品,置于小烧杯中,加水溶解,滴加足量
g样品,置于小烧杯中,加水溶解,滴加足量 溶液。将反应混合物过滤、洗涤、干燥、称量,得到固体的质量为
溶液。将反应混合物过滤、洗涤、干燥、称量,得到固体的质量为 g。则该纯碱样品的纯度为
g。则该纯碱样品的纯度为_______ 。
 和
和 并进行后续实验。回答相关问题:
并进行后续实验。回答相关问题:I.
 的制备反应原理:
的制备反应原理:
反应装置:

(1)启普发生器中发生的反应方程式为
(2)仪器3中盛装的试剂是饱和的
 溶液,其作用
溶液,其作用(3)仪器5中稀硫酸的作用是
II.的制备
(4)将仪器4中所得固体加热可得到
 ,写出相关的化学方程式
,写出相关的化学方程式III.测定所得产品的组成和纯度
(5)检验纯碱样品中是否混有
 ,请选择下列装置设计实验,并完成下表。
,请选择下列装置设计实验,并完成下表。
| 选择的装置(填编号) | 实验现象 | 实验结论 |
样品中含 |
 g样品,置于小烧杯中,加水溶解,滴加足量
g样品,置于小烧杯中,加水溶解,滴加足量 溶液。将反应混合物过滤、洗涤、干燥、称量,得到固体的质量为
溶液。将反应混合物过滤、洗涤、干燥、称量,得到固体的质量为 g。则该纯碱样品的纯度为
g。则该纯碱样品的纯度为
您最近一年使用:0次
名校
6 . 某化学兴趣小组模拟“侯氏制碱法”制纯碱并进行后续实验。
Ⅰ.制备纯碱:先以NaCl、NH3、CO2和水等为原料,用下图所示装置制取NaHCO3,然后再将NaHCO3制备成Na2CO3。
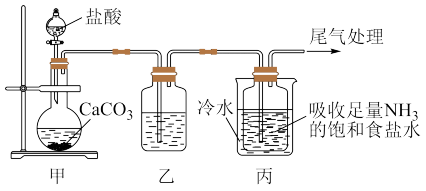
(1)装置乙中盛放的试剂为_______ ,它的作用是_______ 。
(2)反应进行一段时间后,观察到装置丙中试剂瓶内溶液中有白色固体析出,经检验该白色固体是NaHCO3。装置丙中可得两种产物,分别是NaHCO3和另一种盐,装置丙中总反应的化学方程式为_______ 。
(3)用装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有_______ 、洗涤固体、_______ ,最后一步发生反应的化学方程式为_______ 。
Ⅱ.测定所得产品的组成和纯度
(4)检验纯碱样品中是否混有NaHCO3,请选择下列装置设计实验,并完成下表:

Ⅰ.制备纯碱:先以NaCl、NH3、CO2和水等为原料,用下图所示装置制取NaHCO3,然后再将NaHCO3制备成Na2CO3。

(1)装置乙中盛放的试剂为
(2)反应进行一段时间后,观察到装置丙中试剂瓶内溶液中有白色固体析出,经检验该白色固体是NaHCO3。装置丙中可得两种产物,分别是NaHCO3和另一种盐,装置丙中总反应的化学方程式为
(3)用装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有
Ⅱ.测定所得产品的组成和纯度
(4)检验纯碱样品中是否混有NaHCO3,请选择下列装置设计实验,并完成下表:

| 选择的装置(填编号) | 实验现象 | 实验结论 |
| 样品中含NaHCO3 |
您最近一年使用:0次
名校
7 . 某化学兴趣小组模拟“侯氏制碱法”制纯碱并进行后续实验。
Ⅰ.制备纯碱:先以NaCl、NH3、CO2和水等为原料,用如图所示装置制取NaHCO3,然后再将NaHCO3制备成Na2CO3。

(1)装置甲中反应的离子方程式为_______ ;装置乙的作用是_______ ,反应的化学方程式为_______ 。
(2)反应进行一段时间后,观察到装置丙中试剂瓶内溶液中有白色固体析出,经检验该白色固体是NaHCO3.装置丙中可得两种产物,分别是NaHCO3和另一种盐,装置丙中反应的化学方程式为_______ 。
(3)用装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有过滤、洗涤固体、_______ ,最后一步发生反应的化学方程式为_______ 。
Ⅱ.测定所得产品的组成和纯度
(4)检验纯碱样品中是否混有NaHCO3,请选择如图装置设计实验,并完成表格:
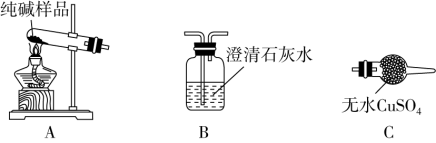
(5)测定该纯碱样品的纯度:称取m1 g样品,置于小烧杯中,加水溶解,滴加足量CaCl2溶液。将反应混合物过滤、洗涤、干燥、称量,得到固体的质量为m2 g。则该纯碱样品的纯度为_______ 。
Ⅰ.制备纯碱:先以NaCl、NH3、CO2和水等为原料,用如图所示装置制取NaHCO3,然后再将NaHCO3制备成Na2CO3。

(1)装置甲中反应的离子方程式为
(2)反应进行一段时间后,观察到装置丙中试剂瓶内溶液中有白色固体析出,经检验该白色固体是NaHCO3.装置丙中可得两种产物,分别是NaHCO3和另一种盐,装置丙中反应的化学方程式为
(3)用装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有过滤、洗涤固体、
Ⅱ.测定所得产品的组成和纯度
(4)检验纯碱样品中是否混有NaHCO3,请选择如图装置设计实验,并完成表格:

| 选择的装置 (填编号) | 实验现象 | 实验结论 |
| 样品中含NaHCO3 |
您最近一年使用:0次
解题方法
8 . Na2CO3和NaHCO3是重要的无机化工产品,广泛应用于食品、化工、医药等领域。如图是利用天然碱(主要成分为Na2CO3、NaHCO3和少量NaCl)制备Na2CO3和NaHCO3的工艺流程。
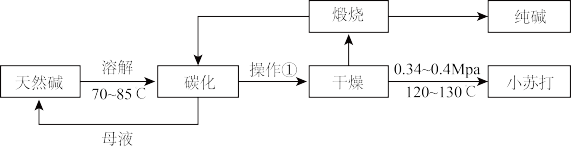
完成下列填空:
(1)操作①为___ 。
(2)碳化装置中反应的离子方程式___ 。
(3)解释选择0.34~0.4MPa干燥的原因___ 。
(4)对比索尔维制碱法,说明利用天然碱制碱的优势___ 。
(5)为了测定产品中小苏打中NaHCO3的含量进行以下实验。
实验步骤:
步骤一:称2.000g小苏打样品,配制小苏打溶液250mL。
步骤二:取20.00mL小苏打溶液置于锥形瓶中,用0.1000mol·L-1盐酸滴定,溶液pH随盐酸体积变化如图所示。

完成下列填空:
①取20.00mL小苏打溶液需要使用的定量仪器名称____ 。
②根据滴定曲线分析,若采用传统滴定法,应选择的指示剂是___ ,此时滴定终点的现象为___ 。
③计算该样品中NaHCO3的质量分数为____ 。

完成下列填空:
(1)操作①为
(2)碳化装置中反应的离子方程式
(3)解释选择0.34~0.4MPa干燥的原因
(4)对比索尔维制碱法,说明利用天然碱制碱的优势
(5)为了测定产品中小苏打中NaHCO3的含量进行以下实验。
实验步骤:
步骤一:称2.000g小苏打样品,配制小苏打溶液250mL。
步骤二:取20.00mL小苏打溶液置于锥形瓶中,用0.1000mol·L-1盐酸滴定,溶液pH随盐酸体积变化如图所示。

完成下列填空:
①取20.00mL小苏打溶液需要使用的定量仪器名称
②根据滴定曲线分析,若采用传统滴定法,应选择的指示剂是
③计算该样品中NaHCO3的质量分数为
您最近一年使用:0次
9 . 实验题
(1)通过如图完成氢氧化铁胶体制备及性质实验。

【实验步骤】
ⅰ.向沸水中加入几滴饱和FeCl3溶液,继续煮沸至液体呈红褐色停止。ⅱ.把分别盛有CuSO4溶液和Fe(OH)3胶体的烧杯置于暗处,用红色激光
笔照射两杯中的液体,观察现象。
【回答问题】
①Fe(OH)3胶体制备的化学方程式为:___________ 。
②步骤ⅱ中能观察到的现象为___________ ,产生该现象的原因是___________ 。
③若将实验改为向氯化铁溶液中加入氢氧化钠溶液,则会产生红褐色沉淀Fe(OH)3,该反应的离子方程式为___________ 。
(2)有同学利用下面的装置鉴别碳酸钠和碳酸氢钠的稳定性。点燃酒精灯,加热盛有固体药品的部位。请结合实验现象,完成下面的填空。

2个长柄V形玻璃管左右并列固定
①[实验现象]加热开始后,很快可以看到,盛有碳酸氢钠的长柄V形玻璃管内的澄清石灰水___________ ,且固体附近的玻璃管内壁上附有大量的___________ ;盛有碳酸钠的长柄V形玻璃管内的澄清石灰水___________ 。
②[实验结论]该实验现象充分说明,碳酸氢钠受热易分解,并且分解的产物有___________ 。碳酸钠受热不分解。
(3)人体的胃液中存在一定量的胃酸,其主要成分是盐酸。当胃酸过量时,常有胃疼烧心感觉,易吐酸水,若服用适量胃舒平【其主要成分是Al(OH)3,Al(OH)3难溶于水】,能治疗胃酸过多,其反应的离子方程式是___________ 。
(1)通过如图完成氢氧化铁胶体制备及性质实验。

【实验步骤】
ⅰ.向沸水中加入几滴饱和FeCl3溶液,继续煮沸至液体呈红褐色停止。ⅱ.把分别盛有CuSO4溶液和Fe(OH)3胶体的烧杯置于暗处,用红色激光
笔照射两杯中的液体,观察现象。
【回答问题】
①Fe(OH)3胶体制备的化学方程式为:
②步骤ⅱ中能观察到的现象为
③若将实验改为向氯化铁溶液中加入氢氧化钠溶液,则会产生红褐色沉淀Fe(OH)3,该反应的离子方程式为
(2)有同学利用下面的装置鉴别碳酸钠和碳酸氢钠的稳定性。点燃酒精灯,加热盛有固体药品的部位。请结合实验现象,完成下面的填空。

2个长柄V形玻璃管左右并列固定
①[实验现象]加热开始后,很快可以看到,盛有碳酸氢钠的长柄V形玻璃管内的澄清石灰水
②[实验结论]该实验现象充分说明,碳酸氢钠受热易分解,并且分解的产物有
(3)人体的胃液中存在一定量的胃酸,其主要成分是盐酸。当胃酸过量时,常有胃疼烧心感觉,易吐酸水,若服用适量胃舒平【其主要成分是Al(OH)3,Al(OH)3难溶于水】,能治疗胃酸过多,其反应的离子方程式是
您最近一年使用:0次
名校
10 . 侯氏制碱法是中国传统工业方法,此方法制备Na2CO3一直在工业上沿用至今。其原理如下:①NH3+H2O+CO2=NH4HCO3
②NH4HCO3+NaCl=NH4Cl+NaHCO3↓
③2NaHCO3 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
某化学兴趣小组模拟“侯氏制碱法”制纯碱并进行后续实验。
Ⅰ.制备纯碱:先以NaCl、NH3、CO2和水等为原料,用如图所示装置制取NaHCO3,然后再将NaHCO3制成Na2CO3。

(1)装置丙中反应的化学方程式为____ 。
(2)装置乙的作用是___ 。为防止污染空气,尾气中的___ 需要进行吸收处理。
(3)用装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有___ 。
Ⅱ.测定所得产品的组成和纯度
(4)检验纯碱样品中是否混有NaHCO3,请选择下列装置设计实验,并完成下表:

(5)测定该纯碱样品的纯度:称取m1g样品,置于小烧杯中,加水溶解,滴加足量CaCl2溶液。将反应混合物过滤、洗涤、干燥、称量,得到固体的质量为m2g。则该纯碱样品的纯度为___ 。
②NH4HCO3+NaCl=NH4Cl+NaHCO3↓
③2NaHCO3
 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑某化学兴趣小组模拟“侯氏制碱法”制纯碱并进行后续实验。
Ⅰ.制备纯碱:先以NaCl、NH3、CO2和水等为原料,用如图所示装置制取NaHCO3,然后再将NaHCO3制成Na2CO3。

(1)装置丙中反应的化学方程式为
(2)装置乙的作用是
(3)用装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有
Ⅱ.测定所得产品的组成和纯度
(4)检验纯碱样品中是否混有NaHCO3,请选择下列装置设计实验,并完成下表:

| 选择的装置(填编号) | 实验现象 | 实验结论 |
| 样品中含NaHCO3 |
(5)测定该纯碱样品的纯度:称取m1g样品,置于小烧杯中,加水溶解,滴加足量CaCl2溶液。将反应混合物过滤、洗涤、干燥、称量,得到固体的质量为m2g。则该纯碱样品的纯度为
您最近一年使用:0次



