解题方法
1 . 化学与生活息息相关。请根据题意填空:
(1)___________ (填“ ”或“
”或“ ”)可以与水反应生成氧气用于解决鱼塘缺氧问题。
”)可以与水反应生成氧气用于解决鱼塘缺氧问题。
(2)用于做面食的苏打 与小苏打
与小苏打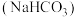 外观相似。某同学取少量两种物质分别置于干燥的坩埚中,盖上盖子加热,盖子内壁有大量水珠附着的是
外观相似。某同学取少量两种物质分别置于干燥的坩埚中,盖上盖子加热,盖子内壁有大量水珠附着的是___________ (填“苏打”或“小苏打”)。
(3)向盛有 溶液中加适量铁粉,溶液颜色
溶液中加适量铁粉,溶液颜色___________ (填“由黄色变为绿色”或“由绿色变为黄色”)。
(1)
 ”或“
”或“ ”)可以与水反应生成氧气用于解决鱼塘缺氧问题。
”)可以与水反应生成氧气用于解决鱼塘缺氧问题。(2)用于做面食的苏打
 与小苏打
与小苏打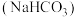 外观相似。某同学取少量两种物质分别置于干燥的坩埚中,盖上盖子加热,盖子内壁有大量水珠附着的是
外观相似。某同学取少量两种物质分别置于干燥的坩埚中,盖上盖子加热,盖子内壁有大量水珠附着的是(3)向盛有
 溶液中加适量铁粉,溶液颜色
溶液中加适量铁粉,溶液颜色
您最近一年使用:0次
2024高三·全国·专题练习
解题方法
2 . 下列关于Na2CO3和NaHCO3两种物质有关性质,说法正确的是______ 。
A.向Na2CO3和NaHCO3溶液中,滴入酚酞后溶液均变红,NaHCO3的颜色深
B.Na2CO3溶液中含有少量NaHCO3可用加热的方法除去
C.向等质量的Na2CO3和NaHCO3固体中加入足量稀盐酸,Na2CO3产生的气体较多
D.向盛有少量Na2CO3和NaHCO3的两支试管中各滴入几滴水,振荡后用温度计测量Na2CO3温度高于NaHCO3
E.热稳定性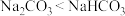
F.常温时水溶性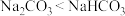
G.等浓度的溶液中滴入稀盐酸,放出气体的快慢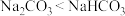
A.向Na2CO3和NaHCO3溶液中,滴入酚酞后溶液均变红,NaHCO3的颜色深
B.Na2CO3溶液中含有少量NaHCO3可用加热的方法除去
C.向等质量的Na2CO3和NaHCO3固体中加入足量稀盐酸,Na2CO3产生的气体较多
D.向盛有少量Na2CO3和NaHCO3的两支试管中各滴入几滴水,振荡后用温度计测量Na2CO3温度高于NaHCO3
E.热稳定性
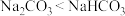
F.常温时水溶性
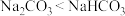
G.等浓度的溶液中滴入稀盐酸,放出气体的快慢
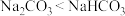
您最近一年使用:0次
名校
3 . 据已经学过的化学知识,回答下列问题。金属及其化合物在生产生活中有着广泛的应用。
(1)胃舒平(主要成分为氢氧化铝)可用于治疗胃酸过多,氢氧化铝体现_______ 性;_______ (填“能”或“不能”)用氢氧化钠溶液代替。
(2)NaHSO4是一种酸式盐,写出NaHSO4在水中的电离方程式:_______ 。
(3)将Cu与稀硫酸混合,二者不能反应,滴入H2O2后,溶液很快变成蓝色,该反应的化学方程式为_______ 。
(4)Na2CO3和NaHCO3是厨房中常见的两种盐,可用化学性质的差异进行鉴别。回答下列问题:
①与酸反应的差异。甲组进行了如图4组实验。

其中实验_______ 和_______ (填实验序号)可以鉴别Na2CO3和NaHCO3。
②热稳定性差异。乙组设计如图装置进行实验(加热及夹持装置省略)。

将分别装有Na2CO3和NaHCO3的试管同时放入甘油浴加热(甘油沸点为290℃)。该实验用饱和碳酸钠溶液检验反应的产物,b试管中的实验现象分别为:_______ ,试管b中发生反应的化学方程式为_______ 。
(1)胃舒平(主要成分为氢氧化铝)可用于治疗胃酸过多,氢氧化铝体现
(2)NaHSO4是一种酸式盐,写出NaHSO4在水中的电离方程式:
(3)将Cu与稀硫酸混合,二者不能反应,滴入H2O2后,溶液很快变成蓝色,该反应的化学方程式为
(4)Na2CO3和NaHCO3是厨房中常见的两种盐,可用化学性质的差异进行鉴别。回答下列问题:
①与酸反应的差异。甲组进行了如图4组实验。

其中实验
②热稳定性差异。乙组设计如图装置进行实验(加热及夹持装置省略)。

将分别装有Na2CO3和NaHCO3的试管同时放入甘油浴加热(甘油沸点为290℃)。该实验用饱和碳酸钠溶液检验反应的产物,b试管中的实验现象分别为:
您最近一年使用:0次
名校
4 . 钠和钠的化合物有许多重要的用途,碳酸钠可用于从海水提取溴,涉及的反应如下:3Br2+6Na2CO3+3H2O=5NaBr+NaBrO3+6NaHCO3。
(1)用双线桥法标出电子转移的方向和数目_______ 。
(2)该反应的离子方程式为_______ 。
(3)该反应中氧化剂与还原剂的物质的量之比是_______ 。
(4)钠着火时应采取的灭火措施是_______ ,不能用水灭火,原因是_______ (涉及反应的离子方程式)。
(5)用洁净的铂丝蘸取Na2CO3溶液置于酒精灯火焰上灼烧,火焰呈_______ 色。
(6)等质量的Na2CO3和NaHCO3分别与足量的盐酸反应,在相同条件下产生CO2的体积V(Na2CO3)_______ V(NaHCO3)(填“大于”,“小于”或“等于”)。
(7)若加热10.00g的碳酸钠和碳酸氢钠的混合物,使碳酸氢钠完全分解,混合物质量减少了2.48g,则原混合物中碳酸钠的质量分数为_______ 。
(1)用双线桥法标出电子转移的方向和数目
(2)该反应的离子方程式为
(3)该反应中氧化剂与还原剂的物质的量之比是
(4)钠着火时应采取的灭火措施是
(5)用洁净的铂丝蘸取Na2CO3溶液置于酒精灯火焰上灼烧,火焰呈
(6)等质量的Na2CO3和NaHCO3分别与足量的盐酸反应,在相同条件下产生CO2的体积V(Na2CO3)
(7)若加热10.00g的碳酸钠和碳酸氢钠的混合物,使碳酸氢钠完全分解,混合物质量减少了2.48g,则原混合物中碳酸钠的质量分数为
您最近一年使用:0次
解题方法
5 . 化学实验是研究物质及其变化的基本方法。
(1)某无色透明溶液中可能大量存在 、
、 、
、 中的几种离子。
中的几种离子。
①不做任何实验就可以肯定原溶液中不存在的离子是_______ 。
②取少量原溶液,加入过量稀盐酸,有白色沉淀生成;再加入过量的稀硝酸,沉淀不消失。说明原溶液中肯定存在的离子是_______ 。
③取②的滤液加入过量NaOH溶液,出现白色沉淀,说明原溶液中肯定存在的离子是_______ 。
④原溶液可能大量存在的阴离子是下列A~D中的_______ (填标号)。
A. B.
B. C.
C. D.
D.
(2)某小组同学对比 和
和 的性质,并进行了如下实验:
的性质,并进行了如下实验:
①写出 水解的离子方程式
水解的离子方程式_______ 。
②向相同体积、相同浓度的 和
和 溶液中分别滴加
溶液中分别滴加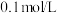 的盐酸,溶液pH变化如下图所示。
的盐酸,溶液pH变化如下图所示。
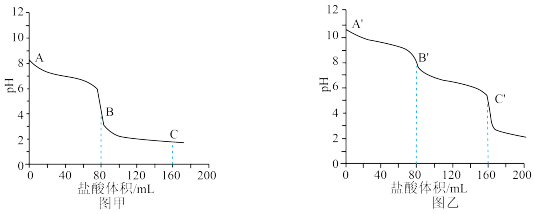
a.图_______ (填“甲”或“乙”)是 的滴定曲线。
的滴定曲线。
b.A′~B′的离子方程式为_______ 。写出A′溶液中各离子浓度由大到小的顺序_______ 。
c.A、B、C三点溶液中,水的电离程度由大到小的顺序为_______ 。
③向 的
的 和
和 溶液中分别滴加少量
溶液中分别滴加少量 溶液,均产生白色沉淀,后者有气体产生,且白色沉淀的成分只有一种。已知:
溶液,均产生白色沉淀,后者有气体产生,且白色沉淀的成分只有一种。已知:
i. 的
的 溶液中,
溶液中,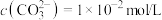 ,
,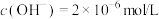
ii.25℃时,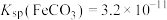 ,
,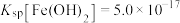
写出向 溶液中滴加少量
溶液中滴加少量 溶液发生的离子反应方程式
溶液发生的离子反应方程式_______ 。
(1)某无色透明溶液中可能大量存在
 、
、 、
、 中的几种离子。
中的几种离子。①不做任何实验就可以肯定原溶液中不存在的离子是
②取少量原溶液,加入过量稀盐酸,有白色沉淀生成;再加入过量的稀硝酸,沉淀不消失。说明原溶液中肯定存在的离子是
③取②的滤液加入过量NaOH溶液,出现白色沉淀,说明原溶液中肯定存在的离子是
④原溶液可能大量存在的阴离子是下列A~D中的
A.
 B.
B. C.
C. D.
D.
(2)某小组同学对比
 和
和 的性质,并进行了如下实验:
的性质,并进行了如下实验:①写出
 水解的离子方程式
水解的离子方程式②向相同体积、相同浓度的
 和
和 溶液中分别滴加
溶液中分别滴加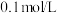 的盐酸,溶液pH变化如下图所示。
的盐酸,溶液pH变化如下图所示。
a.图
 的滴定曲线。
的滴定曲线。b.A′~B′的离子方程式为
c.A、B、C三点溶液中,水的电离程度由大到小的顺序为
③向
 的
的 和
和 溶液中分别滴加少量
溶液中分别滴加少量 溶液,均产生白色沉淀,后者有气体产生,且白色沉淀的成分只有一种。已知:
溶液,均产生白色沉淀,后者有气体产生,且白色沉淀的成分只有一种。已知:i.
 的
的 溶液中,
溶液中,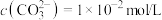 ,
,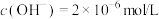
ii.25℃时,
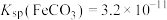 ,
,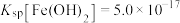
写出向
 溶液中滴加少量
溶液中滴加少量 溶液发生的离子反应方程式
溶液发生的离子反应方程式
您最近一年使用:0次
解题方法
6 . 分别向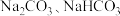 溶液中滴加澄清石灰水,现象为
溶液中滴加澄清石灰水,现象为_______ ,写出 与①过量澄清石灰水;②少量澄清石灰水反应的离子方程式。①
与①过量澄清石灰水;②少量澄清石灰水反应的离子方程式。①_______ ②_______
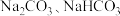 溶液中滴加澄清石灰水,现象为
溶液中滴加澄清石灰水,现象为 与①过量澄清石灰水;②少量澄清石灰水反应的离子方程式。①
与①过量澄清石灰水;②少量澄清石灰水反应的离子方程式。①
您最近一年使用:0次
名校
7 . 小组同学对比 和
和 的性质,进行了如下实验。
的性质,进行了如下实验。
(1)向相同体积、相同浓度的 和
和 溶液中分别滴加
溶液中分别滴加 的盐酸,溶液pH变化如下。
的盐酸,溶液pH变化如下。

①图_______ (填“甲”或“乙”)是 的滴定曲线。
的滴定曲线。
②A′-B′发生反应的离子方程式为_______ 。
③下列说法正确的是_______ (填序号)。
a. 和
和 溶液中所含微粒种类相同
溶液中所含微粒种类相同
b.A、B、C均满足: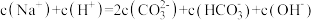
c.水的电离程度: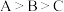
(2)向1mol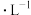 的
的 和
和 溶液中分别滴加少量
溶液中分别滴加少量 溶液,均产生白色沉淀,后者有气体产生。
溶液,均产生白色沉淀,后者有气体产生。
资料:
i.1mol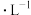 的
的 溶液中,
溶液中, ,
,
ii.25℃时, ,
,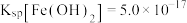
①补全 与
与 反应的离子方程式:
反应的离子方程式:_______ 。

②通过计算说明 与
与 反应产生的沉淀为
反应产生的沉淀为 而不是
而不是
_______ 。
 和
和 的性质,进行了如下实验。
的性质,进行了如下实验。(1)向相同体积、相同浓度的
 和
和 溶液中分别滴加
溶液中分别滴加 的盐酸,溶液pH变化如下。
的盐酸,溶液pH变化如下。
①图
 的滴定曲线。
的滴定曲线。②A′-B′发生反应的离子方程式为
③下列说法正确的是
a.
 和
和 溶液中所含微粒种类相同
溶液中所含微粒种类相同b.A、B、C均满足:
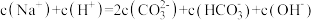
c.水的电离程度:
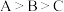
(2)向1mol
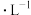 的
的 和
和 溶液中分别滴加少量
溶液中分别滴加少量 溶液,均产生白色沉淀,后者有气体产生。
溶液,均产生白色沉淀,后者有气体产生。资料:
i.1mol
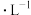 的
的 溶液中,
溶液中, ,
,
ii.25℃时,
 ,
,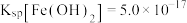
①补全
 与
与 反应的离子方程式:
反应的离子方程式:
②通过计算说明
 与
与 反应产生的沉淀为
反应产生的沉淀为 而不是
而不是
您最近一年使用:0次
2022-11-04更新
|
697次组卷
|
4卷引用:北京市朝阳区2022-2023学年高三上学期期中考试化学试题
北京市朝阳区2022-2023学年高三上学期期中考试化学试题(已下线)专题06 水溶液中的离子平衡(测)-2023年高考化学二轮复习讲练测(新高考专用)北京市第十四中学2023-2024学年高三上学期期中考试化学试题 湖北省襄阳市第五中学2022-2023学年高二下学期开学考试化学试题
名校
8 . 大苏打 、苏打、小苏打被称为“苏氏三兄弟”。它们在生活、生产中有广泛应用。
、苏打、小苏打被称为“苏氏三兄弟”。它们在生活、生产中有广泛应用。
(1)工业上,将 和
和 以
以 的物质的量之比配成溶液。再通入
的物质的量之比配成溶液。再通入 可制取
可制取 ,同时放出
,同时放出 ,写出该反应的化学方程
,写出该反应的化学方程___________ 。 溶液在空气中久置,会生成浅黄色物质,经测定该物质具有与过氧化钠相似的结构,该物质的电子式为
溶液在空气中久置,会生成浅黄色物质,经测定该物质具有与过氧化钠相似的结构,该物质的电子式为___________ 。
(2) 标准溶液常用于滴定碘的含量,若滴定的溶液呈酸性,测定结果会偏高。用离子方程式表示其原因
标准溶液常用于滴定碘的含量,若滴定的溶液呈酸性,测定结果会偏高。用离子方程式表示其原因___________ 。
(3)下列关于苏打和小苏打的说法正确的是___________ (选填字母序号)。
A.纯碱是一种重要的化工原料,在玻璃、肥皂、造纸等工业中都有重要的应用
B.苏打和小苏打的相互转化属于可逆反应
C.苏打(含氯化钠杂质)可用滴定法测苏打的质量分数,使用石蕊溶液做指示剂更准确
D.牙膏中加入小苏打可以让小苏打颗粒直接摩擦牙齿,帮助清洁牙垢
(4)向 的氢氧化钠溶液中通入一定量的二氧化碳,充分反应后再向溶液中逐滴滴入
的氢氧化钠溶液中通入一定量的二氧化碳,充分反应后再向溶液中逐滴滴入 的稀盐酸,产生气体体积(标况)如图所示。
的稀盐酸,产生气体体积(标况)如图所示。

请回答下列问题
①通入二氧化碳后形成溶液的溶质成分是___________ (填写化学式)
②滴入 稀盐酸过程中,溶液导电性
稀盐酸过程中,溶液导电性___________ (填“增强”或“减弱”),试解释其原因___________ 。
③原 氢氧化钠溶液的浓度为
氢氧化钠溶液的浓度为___________ 。
 、苏打、小苏打被称为“苏氏三兄弟”。它们在生活、生产中有广泛应用。
、苏打、小苏打被称为“苏氏三兄弟”。它们在生活、生产中有广泛应用。(1)工业上,将
 和
和 以
以 的物质的量之比配成溶液。再通入
的物质的量之比配成溶液。再通入 可制取
可制取 ,同时放出
,同时放出 ,写出该反应的化学方程
,写出该反应的化学方程 溶液在空气中久置,会生成浅黄色物质,经测定该物质具有与过氧化钠相似的结构,该物质的电子式为
溶液在空气中久置,会生成浅黄色物质,经测定该物质具有与过氧化钠相似的结构,该物质的电子式为(2)
 标准溶液常用于滴定碘的含量,若滴定的溶液呈酸性,测定结果会偏高。用离子方程式表示其原因
标准溶液常用于滴定碘的含量,若滴定的溶液呈酸性,测定结果会偏高。用离子方程式表示其原因(3)下列关于苏打和小苏打的说法正确的是
A.纯碱是一种重要的化工原料,在玻璃、肥皂、造纸等工业中都有重要的应用
B.苏打和小苏打的相互转化属于可逆反应
C.苏打(含氯化钠杂质)可用滴定法测苏打的质量分数,使用石蕊溶液做指示剂更准确
D.牙膏中加入小苏打可以让小苏打颗粒直接摩擦牙齿,帮助清洁牙垢
(4)向
 的氢氧化钠溶液中通入一定量的二氧化碳,充分反应后再向溶液中逐滴滴入
的氢氧化钠溶液中通入一定量的二氧化碳,充分反应后再向溶液中逐滴滴入 的稀盐酸,产生气体体积(标况)如图所示。
的稀盐酸,产生气体体积(标况)如图所示。
请回答下列问题
①通入二氧化碳后形成溶液的溶质成分是
②滴入
 稀盐酸过程中,溶液导电性
稀盐酸过程中,溶液导电性③原
 氢氧化钠溶液的浓度为
氢氧化钠溶液的浓度为
您最近一年使用:0次
2021-02-09更新
|
1015次组卷
|
7卷引用:河南省信阳市2021届高三上学期第二次教学质量检测化学试题
河南省信阳市2021届高三上学期第二次教学质量检测化学试题(已下线)专题06 钠及其化合物(限时精练)-2022届高考化学一轮复习热点题型归纳与变式训练(已下线)第07讲 钠及其重要化合物(精练)-2022年高考化学一轮复习讲练测河北省武安市第一中学2021-2022学年高三上学期第五次调研考试化学试题(已下线)第07讲 钠及其重要化合物(练)-2023年高考化学一轮复习讲练测(全国通用)新疆维吾尔自治区伊犁哈萨克自治州新源县第二中学2021-2022学年上学期高三第一次月考化学试题(已下线)第1讲 钠及其重要化合物
9 . 碳酸氢钠俗称“小苏打”,在生活、生产中用途广泛。
(1)泡沫灭火器中主要成分是NaHCO3溶液和Al2(SO4)3溶液,两者混合后发生双水解反应生成Al(OH)3和CO2进行灭火,写出该反应的化学方程式_________________________________________________ 。
(2)Na2O2和NaHCO3都属于钠的化合物,它具有很强的氧化性。少量Na2O2与FeCl2溶液能发生如下反应:____Na2O2+____FeCl2+____H2O→____Fe(OH)3 +____FeCl3+____NaCl,已知FeCl2前面系数为6,配平上述化学方程式
+____FeCl3+____NaCl,已知FeCl2前面系数为6,配平上述化学方程式______ ,并标出电子转移方向和数目______ 。该反应中被还原的元素是_________ ,氧化产物是_________ 。
(3)向NaHCO3溶液中加入少许Ba(OH)2固体,忽略溶液体积变化,溶液中的c(CO32-)的变化是_____ (选填“增大”、“减小”或“不变”)。
(4)NaHCO3是氨碱法和联合制碱法制纯碱的中间产物,在滤出小苏打后,母液提取氯化铵有两种方法:①通入氨,冷却、加食盐,过滤 ②不通入氨,冷却、加食盐,过滤对两种方法的评价正确的是______ (选填编号)。
a.①析出的氯化铵纯度更高 b.②析出的氯化铵纯度更高
c.①的滤液可直接循环使用 d.②的滤液可直接循环使用
(5)已知HCO3-在水中既能水解也能电离。NaHCO3溶液呈碱性,溶液中c(H2CO3)___ c(CO32-)(选填“>”、“<”、“=”)。
(1)泡沫灭火器中主要成分是NaHCO3溶液和Al2(SO4)3溶液,两者混合后发生双水解反应生成Al(OH)3和CO2进行灭火,写出该反应的化学方程式
(2)Na2O2和NaHCO3都属于钠的化合物,它具有很强的氧化性。少量Na2O2与FeCl2溶液能发生如下反应:____Na2O2+____FeCl2+____H2O→____Fe(OH)3
 +____FeCl3+____NaCl,已知FeCl2前面系数为6,配平上述化学方程式
+____FeCl3+____NaCl,已知FeCl2前面系数为6,配平上述化学方程式(3)向NaHCO3溶液中加入少许Ba(OH)2固体,忽略溶液体积变化,溶液中的c(CO32-)的变化是
(4)NaHCO3是氨碱法和联合制碱法制纯碱的中间产物,在滤出小苏打后,母液提取氯化铵有两种方法:①通入氨,冷却、加食盐,过滤 ②不通入氨,冷却、加食盐,过滤对两种方法的评价正确的是
a.①析出的氯化铵纯度更高 b.②析出的氯化铵纯度更高
c.①的滤液可直接循环使用 d.②的滤液可直接循环使用
(5)已知HCO3-在水中既能水解也能电离。NaHCO3溶液呈碱性,溶液中c(H2CO3)
您最近一年使用:0次
名校
10 . 回答下列问题:
(1)若金属钠等活泼金属着火时,应该用_______________ 来灭火。将一小块钠投入盛有饱和石灰水的烧杯中,不可能观察到的现象是________ 。
a.有气体生成 b.钠熔化成小球并在液面上游动
c.烧杯底部有银白色的金属钙生成 d.溶液变浑浊
(2)Na2CO3和NaHCO3是两种常见的钠盐。下列关于Na2CO3和NaHCO3性质的说法中,正确的是______________ 。
a.常温下,Na2CO3在水中的溶解度比NaHCO3小
b.相同质量的Na2CO3和NaHCO3分别与足量盐酸反应,在相同条件下产生CO2前者多
c.可用Ca(OH)2溶液鉴别Na2CO3溶液和NaHCO3溶液
d. NaHCO3溶液中混有少量Na2CO3杂质可通入足量CO2除杂
(3)过氧化钠、过氧化镁都是重要的过氧化物。过氧化镁不溶于水,但易溶于稀酸,广泛用作胃药,治疗胃酸过多。试写出过氧化镁与胃酸反应的离子方程式:_____________ 。
(4)某无色稀溶液X中,可能含有Al3+、Cl-、Fe3+、Mg2+、NH4+中的某几种,向其中加入NaOH溶液时产生沉淀的物质的量(n)与加入NaOH溶液体积(V)的关系如下图所示。

则X中一定含有的阳离子是_________ ,bc段反应的离子方程式为________ 。
(5)在1L某酸性溶液中离子浓度的分析结果如下表
向该溶液中逐滴加入0.5 mol•L-1NaOH溶液至沉淀恰好不再溶解时,消耗NaOH体积为_____ mL。
(1)若金属钠等活泼金属着火时,应该用
a.有气体生成 b.钠熔化成小球并在液面上游动
c.烧杯底部有银白色的金属钙生成 d.溶液变浑浊
(2)Na2CO3和NaHCO3是两种常见的钠盐。下列关于Na2CO3和NaHCO3性质的说法中,正确的是
a.常温下,Na2CO3在水中的溶解度比NaHCO3小
b.相同质量的Na2CO3和NaHCO3分别与足量盐酸反应,在相同条件下产生CO2前者多
c.可用Ca(OH)2溶液鉴别Na2CO3溶液和NaHCO3溶液
d. NaHCO3溶液中混有少量Na2CO3杂质可通入足量CO2除杂
(3)过氧化钠、过氧化镁都是重要的过氧化物。过氧化镁不溶于水,但易溶于稀酸,广泛用作胃药,治疗胃酸过多。试写出过氧化镁与胃酸反应的离子方程式:
(4)某无色稀溶液X中,可能含有Al3+、Cl-、Fe3+、Mg2+、NH4+中的某几种,向其中加入NaOH溶液时产生沉淀的物质的量(n)与加入NaOH溶液体积(V)的关系如下图所示。

则X中一定含有的阳离子是
(5)在1L某酸性溶液中离子浓度的分析结果如下表
| 离子 | Mg2+ | Al3+ | SO42− | Cl− |
| c/(mol/L) | 0.5×10−2 | 1.0×10−2 | 0.5×10−2 | 3.0×10−2 |
您最近一年使用:0次
2018-12-07更新
|
166次组卷
|
2卷引用:【全国百强校】西藏自治区林芝市第一中学2019届高三上学期第三次月考理科综合化学试题



