解题方法
1 . 明矾[KAl(SO4)2∙12H2O]在造纸、净水等方面应用广泛,实验室以铝灰为原料制备明矾的流程如下图所示,

已知:①铝灰含Al、Al2O3和少量FeO、Fe2O3、SiO2;
②SiO2不溶于强酸;
③不同温度KAl(SO4)2∙12H2O的溶解度:
回答下列问题:
(1)“酸浸”后溶液中主要的金属离子有Fe3+、___________ 。“滤渣Ⅰ”的主要成分为___________ (填化学式)。
(2)①“氧化”过程中H2O2的作用是___________ (用离子方程式表示)。
②Fe2+的“氧化效率”与温度的关系如图所示,试解释温度过高,“氧化效率”降低的可能原因是___________ 。

(3)溶液的pH对铝、铁沉淀率的影响如图所示。“调pH”时应控制溶液的pH范围为___________ 。
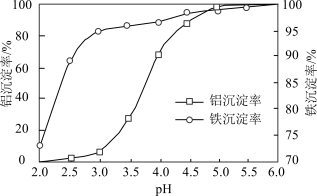
A.3.0~3.5 B.4.0~4.5 C.4.5~5.0
(4)“沉铝”中发生的离子方程式为___________ 。
(5)得到明矾晶体的“系列操作”包括___________ 、___________ 、过滤、洗涤、干燥。

已知:①铝灰含Al、Al2O3和少量FeO、Fe2O3、SiO2;
②SiO2不溶于强酸;
③不同温度KAl(SO4)2∙12H2O的溶解度:
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 60 | 80 | 90 |
| KAl(SO4)2∙12H2O/g | 3.00 | 3.99 | 5.90 | 8.39 | 11.7 | 24.8 | 71.0 | 109 |
(1)“酸浸”后溶液中主要的金属离子有Fe3+、
(2)①“氧化”过程中H2O2的作用是
②Fe2+的“氧化效率”与温度的关系如图所示,试解释温度过高,“氧化效率”降低的可能原因是

(3)溶液的pH对铝、铁沉淀率的影响如图所示。“调pH”时应控制溶液的pH范围为

A.3.0~3.5 B.4.0~4.5 C.4.5~5.0
(4)“沉铝”中发生的离子方程式为
(5)得到明矾晶体的“系列操作”包括
您最近一年使用:0次
名校
2 . 工业上以铝土矿(主要成分为 ,含少量
,含少量 、
、 、
、 等杂质)为主要原料制备氯化铝,流程如下。
等杂质)为主要原料制备氯化铝,流程如下。

(1)酸浸
①用 溶液浸取铝土矿中的铝元素和铁元素,写出加入
溶液浸取铝土矿中的铝元素和铁元素,写出加入 溶液后产生有色离子的离子方程式
溶液后产生有色离子的离子方程式___________ ;___________ 。
②浸渣的主要成分为___________ (填化学式)。
(2)氧化:用 将
将 氧化为
氧化为 ,反应的离子方程式为
,反应的离子方程式为___________ 。判断 已完全被氧化为
已完全被氧化为 的实验操作是
的实验操作是___________ 。
(3)沉淀:用 溶液调节
溶液调节 ,将
,将 、
、 转化为沉淀,溶液终点
转化为沉淀,溶液终点 对铝、铁沉淀率的影响如图所示。
对铝、铁沉淀率的影响如图所示。

为获得较高的铝、铁沉淀率,应控制溶液 最佳为
最佳为___________ (填字母)。
A.4.0左右 B.5.0左右 C.6.0左右
(4)碱溶:用 溶液溶解沉淀,写出发生反应的离子方程式
溶液溶解沉淀,写出发生反应的离子方程式___________ ,分离出 的实验操作为
的实验操作为___________ (填名称)。
(5)碳分:向碱溶后的溶液中通入足量 气体,该反应的离子方程式为
气体,该反应的离子方程式为___________ 。
 ,含少量
,含少量 、
、 、
、 等杂质)为主要原料制备氯化铝,流程如下。
等杂质)为主要原料制备氯化铝,流程如下。
(1)酸浸
①用
 溶液浸取铝土矿中的铝元素和铁元素,写出加入
溶液浸取铝土矿中的铝元素和铁元素,写出加入 溶液后产生有色离子的离子方程式
溶液后产生有色离子的离子方程式②浸渣的主要成分为
(2)氧化:用
 将
将 氧化为
氧化为 ,反应的离子方程式为
,反应的离子方程式为 已完全被氧化为
已完全被氧化为 的实验操作是
的实验操作是(3)沉淀:用
 溶液调节
溶液调节 ,将
,将 、
、 转化为沉淀,溶液终点
转化为沉淀,溶液终点 对铝、铁沉淀率的影响如图所示。
对铝、铁沉淀率的影响如图所示。
为获得较高的铝、铁沉淀率,应控制溶液
 最佳为
最佳为A.4.0左右 B.5.0左右 C.6.0左右
(4)碱溶:用
 溶液溶解沉淀,写出发生反应的离子方程式
溶液溶解沉淀,写出发生反应的离子方程式 的实验操作为
的实验操作为(5)碳分:向碱溶后的溶液中通入足量
 气体,该反应的离子方程式为
气体,该反应的离子方程式为
您最近一年使用:0次
3 . 利用硫铁矿烧渣(主要成分为Fe3O4、FeO、SiO2等)和粉煤灰(主要成分为Al2O3、Fe2O3、FeO等),制备高效水处理剂聚合硫酸铁铝的流程如下:

已知:SiO2既不溶于H2SO4溶液,也不和H2SO4溶液反应。
(1)“酸溶Ⅰ”得到的溶液中所含的金属阳离子主要有_____ 。
(2)“氧化”时,若用氯水代替H2O2:
①发生反应的离子方程式为_____ 。
②与使用氯水相比,“氧化”时使用H2O2的优点是_____ 。
(3)①“碱溶”时,Al2O3发生反应的化学方程式为_____ 。
②通入CO2后生成沉淀的化学式为_____ 。
(4)在流程中可以循环利用的是_____ (填“滤渣Ⅰ”、“滤渣Ⅱ”或“滤渣Ⅰ和滤渣Ⅱ”)。
(5)向Fe3O4、FeO的固体混合物中,加入足量H2SO4溶液,充分反应后,向溶液中再加入足量铜粉,充分搅拌反应,得到的溶液中离子浓度比为c(Cu2+):c(Fe2+)=2:7,则固体混合物中物质的量比n(Fe3O4):n(FeO)为_____ 。

已知:SiO2既不溶于H2SO4溶液,也不和H2SO4溶液反应。
(1)“酸溶Ⅰ”得到的溶液中所含的金属阳离子主要有
(2)“氧化”时,若用氯水代替H2O2:
①发生反应的离子方程式为
②与使用氯水相比,“氧化”时使用H2O2的优点是
(3)①“碱溶”时,Al2O3发生反应的化学方程式为
②通入CO2后生成沉淀的化学式为
(4)在流程中可以循环利用的是
(5)向Fe3O4、FeO的固体混合物中,加入足量H2SO4溶液,充分反应后,向溶液中再加入足量铜粉,充分搅拌反应,得到的溶液中离子浓度比为c(Cu2+):c(Fe2+)=2:7,则固体混合物中物质的量比n(Fe3O4):n(FeO)为
您最近一年使用:0次
解题方法
4 . 锂在新能源等领域应用广泛。从粉煤灰(含Al2O3、Fe2O3、Li2O、SiO2等)中回收提取铝、锂元素的化合物的流程如图所示:

已知:碳酸锂的溶解度(g·L-1)见表。
回答下列问题
(1)“粉碎”的目的是___________ ,滤渣1的成分主要是___________ 。(填化学式)
(2)“调pH”的目的是沉淀Fe3+、Al3+。当离子浓度≤1.0×10-5mol·L-1时表示该离子沉淀完全。常温下,如果溶液pH=4,Fe3+、Al3+___________ (填“能”或“否”)均沉淀完全,此时溶液中c(Fe3+)、c(Al3+)之比为___________ 。(已知:Ksp[Fe(OH)3]=8.0×10-38,Ksp[Al(OH)3]=2.0×10-33)
(3)从滤渣2中分离出Al(OH)3,可用如图所示方法,试剂X是___________ ,“步骤2”中主要发生的离子反应方程式有OH-+CO2=HCO 、
、___________ 。
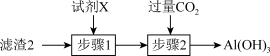
(4)“沉锂”中的“一系列操作”依次为蒸发浓缩、___________ 、洗涤、干燥。检验母液主要溶质的阴离子所用的试剂为___________ 。母液的用途___________ (任写一种)。
(5)太阳能路灯蓄电池是磷酸铁锂电池,其工作原理如图所示。电池总反应式为LixC6 + Li1−xFePO4 LiFePO4 + 6C。试写出充电时,该电池正极材料上的反应式:
LiFePO4 + 6C。试写出充电时,该电池正极材料上的反应式:___________ 。


已知:碳酸锂的溶解度(g·L-1)见表。
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 80 | 100 |
| Li2CO3 | 1.54 | 1.43 | 1.33 | 1.25 | 1.17 | 1.08 | 1.01 | 0.85 | 0.72 |
(1)“粉碎”的目的是
(2)“调pH”的目的是沉淀Fe3+、Al3+。当离子浓度≤1.0×10-5mol·L-1时表示该离子沉淀完全。常温下,如果溶液pH=4,Fe3+、Al3+
(3)从滤渣2中分离出Al(OH)3,可用如图所示方法,试剂X是
 、
、
(4)“沉锂”中的“一系列操作”依次为蒸发浓缩、
(5)太阳能路灯蓄电池是磷酸铁锂电池,其工作原理如图所示。电池总反应式为LixC6 + Li1−xFePO4
 LiFePO4 + 6C。试写出充电时,该电池正极材料上的反应式:
LiFePO4 + 6C。试写出充电时,该电池正极材料上的反应式:
您最近一年使用:0次
名校
5 . 某化学兴趣小组模拟工业上从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3等杂质)中提取氧化铝的工艺做实验,流程如图,请回答下列问题:

(1)操作I的名称为___ 。
(2)验证溶液B中是否含有Fe3+的方法:___ 。
(3)步骤①中,加入足量盐酸,所得不溶物A是___ (填化学式)。
(4)步骤②中,加入过量NaOH溶液,其中发生反应的离子方程式有___ 、___ 。
(5)步骤③中得到的不溶物E的化学式为___ 。
(6)如果铝土矿100g,步骤④中的灼烧后得不溶物G质量为51g,则矿石中铝元素的含量为___ 。

(1)操作I的名称为
(2)验证溶液B中是否含有Fe3+的方法:
(3)步骤①中,加入足量盐酸,所得不溶物A是
(4)步骤②中,加入过量NaOH溶液,其中发生反应的离子方程式有
(5)步骤③中得到的不溶物E的化学式为
(6)如果铝土矿100g,步骤④中的灼烧后得不溶物G质量为51g,则矿石中铝元素的含量为
您最近一年使用:0次
2021-10-24更新
|
308次组卷
|
2卷引用:广东省惠州市2020-2021学年高一上学期期末质量检测化学试题
名校
解题方法
6 . 用软锰矿(主要成分 ,含有
,含有 、
、 、
、 、
、 等杂质)制备
等杂质)制备 的流程如下:
的流程如下:

已知:
回答下列问题:
(1)焙烧时, 和
和 在纤维素作用下分别转化为
在纤维素作用下分别转化为 、
、 ,则纤维素的作用是
,则纤维素的作用是_______ 。
(2)酸浸时,浸出液的 与锰的浸出率关系如下图所示:
与锰的浸出率关系如下图所示:

实际生产中,酸浸时控制硫酸的量不宜过多,使 在2左右。请结合上图和制备硫酸锰的流程,说明硫酸的量不宜过多的原因:
在2左右。请结合上图和制备硫酸锰的流程,说明硫酸的量不宜过多的原因:_______ 。
(3)净化时,加入30% 的目的是(用离子方程式表示)
的目的是(用离子方程式表示)_______ ;加氨水,调 为5.5的目的是
为5.5的目的是_______ 。
(4)结合 与
与 溶解度曲线,简述“结晶分离”的具体实验操作
溶解度曲线,简述“结晶分离”的具体实验操作_______ 。

(5)产品 纯度测定:称取a
纯度测定:称取a 产品,在适宜的条件下用适量
产品,在适宜的条件下用适量 将
将 氧化为
氧化为 ,再用
,再用
 溶液b
溶液b 刚好把
刚好把 转化为
转化为 。通过计算可知,产品纯度为
。通过计算可知,产品纯度为_______ (用质量分数表示)。
 ,含有
,含有 、
、 、
、 、
、 等杂质)制备
等杂质)制备 的流程如下:
的流程如下:
已知:
| 氢氧化物 |  |  |  |  |  |
| 开始沉淀时的pH | 2.3 | 4.0 | 7.5 | 8.8 | 10.4 |
| 沉淀完全时的pH | 4.1 | 5.2 | 9.7 | 10.4 | 12.4 |
(1)焙烧时,
 和
和 在纤维素作用下分别转化为
在纤维素作用下分别转化为 、
、 ,则纤维素的作用是
,则纤维素的作用是(2)酸浸时,浸出液的
 与锰的浸出率关系如下图所示:
与锰的浸出率关系如下图所示:
实际生产中,酸浸时控制硫酸的量不宜过多,使
 在2左右。请结合上图和制备硫酸锰的流程,说明硫酸的量不宜过多的原因:
在2左右。请结合上图和制备硫酸锰的流程,说明硫酸的量不宜过多的原因:(3)净化时,加入30%
 的目的是(用离子方程式表示)
的目的是(用离子方程式表示) 为5.5的目的是
为5.5的目的是(4)结合
 与
与 溶解度曲线,简述“结晶分离”的具体实验操作
溶解度曲线,简述“结晶分离”的具体实验操作
(5)产品
 纯度测定:称取a
纯度测定:称取a 产品,在适宜的条件下用适量
产品,在适宜的条件下用适量 将
将 氧化为
氧化为 ,再用
,再用
 溶液b
溶液b 刚好把
刚好把 转化为
转化为 。通过计算可知,产品纯度为
。通过计算可知,产品纯度为
您最近一年使用:0次
2021-01-27更新
|
1359次组卷
|
5卷引用:广东省惠州市2022届高三第一次调研考试化学试题
广东省惠州市2022届高三第一次调研考试化学试题北京市顺义区2021届高三一模化学试题(已下线)大题01 化学工艺流程题(一)-【考前抓大题】备战2021年高考化学(全国通用)2020年北京高考化学真题变式题11-19广东省广州市第十六中学2021届高三下学期5月考试化学试题
解题方法
7 . 石墨在材料领域有重要应用。某初级石墨中含SiO2(7.8%)、Al2O3(5.1%)、Fe2O3(3.1%)和MgO(0.5%)等杂质。设计的提纯和综合应用工艺如下:
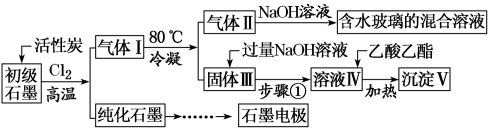
(注:SiCl4的沸点是57.6ºC,金属氯化物的沸点均高于150ºC)
(1)向反应器中通入Cl2前,需通一段时间的N2,主要目的是_______ 。
(2)高温反应后,石墨中的氧化物杂质均转变为相应的氯化物。气体I中的氯化物主要为_______ 。由气体II中某物质得到水玻璃的化学方程式为_______ 。
(3)步骤①为:搅拌、_______ 。
(4)由溶液IV生成沉淀V的总反应的离子方程式为_______ 。100 kg初级石墨最多可获得V的质量为_______ kg。

(注:SiCl4的沸点是57.6ºC,金属氯化物的沸点均高于150ºC)
(1)向反应器中通入Cl2前,需通一段时间的N2,主要目的是
(2)高温反应后,石墨中的氧化物杂质均转变为相应的氯化物。气体I中的氯化物主要为
(3)步骤①为:搅拌、
(4)由溶液IV生成沉淀V的总反应的离子方程式为
您最近一年使用:0次
8 . 软锰矿的主要成分为MnO2,含少量Al2O3和SiO2。闪锌矿主要成分为ZnS,含少量FeS、CuS、CdS杂质。现以软锰矿和闪锌矿为原料制备MnO2和Zn,其简化流程如下(中间产物的固体部分已经略去)。
已知: Ⅰ.矿石中所有金属元素在滤液A中均以离子形式存在。
Ⅱ.各种金属离子完全沉淀的pH如下表:
回答下列问题:
(1)步骤①中为了加快硫酸的浸取速率,可采用的方法是_________________ (任写一种)。①中发生多个反应,其中MnO2、FeS与硫酸共热时有淡黄色物质析出,溶液变为棕黄色,写出MnO2、FeS与硫酸共热发生反应的化学方程式______________________ 。
(2)步骤②加入金属锌是为了回收金属,回收金属的主要成分是_________ 。
(3)步骤③中MnO2的其作用是__________________ ,另外一种物质X可以是__________ 。
A.ZnO B.MgCO3 C.MnCO3 D.Cu(OH)2
(4)MnO2与Li构成LiMnO2,它可作为某锂离子电池的正极材料,电池反应方程式为: Li1-xMnO2+LixC6=LiMnO2+6C,写出该锂离子电池的正极电极反应式__________ 。
(5)已知:HCN的电离常数K=4.9×10-10,H2S的电离常数K1=1.3×10―7,K2=7.0×10―15,向NaCN溶液中通入少量的H2S气体,反应的离子方程式为__________________ 。在废水处理领域中常用H2S将Mn2+转化为MnS除去,向含有0.020 mol·L―1Mn2+废水中通入一定量的H2S气体,调节溶液的pH=a,当HS―浓度为1.0×10―4 mol·L―1时,Mn2+开始沉淀,则a=______ 。[已知:Ksp(MnS)=1.4×10―15]

已知: Ⅰ.矿石中所有金属元素在滤液A中均以离子形式存在。
Ⅱ.各种金属离子完全沉淀的pH如下表:
| Zn2+ | Mn2+ | Fe2+ | Fe3+ | Al3+ | |
| pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
回答下列问题:
(1)步骤①中为了加快硫酸的浸取速率,可采用的方法是
(2)步骤②加入金属锌是为了回收金属,回收金属的主要成分是
(3)步骤③中MnO2的其作用是
A.ZnO B.MgCO3 C.MnCO3 D.Cu(OH)2
(4)MnO2与Li构成LiMnO2,它可作为某锂离子电池的正极材料,电池反应方程式为: Li1-xMnO2+LixC6=LiMnO2+6C,写出该锂离子电池的正极电极反应式
(5)已知:HCN的电离常数K=4.9×10-10,H2S的电离常数K1=1.3×10―7,K2=7.0×10―15,向NaCN溶液中通入少量的H2S气体,反应的离子方程式为
您最近一年使用:0次
2017-02-26更新
|
306次组卷
|
2卷引用:广东省惠阳高级中学2018届高三上学期12月月考理科综合化学试题
真题
名校
9 . 从铝土矿(主要成分是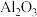 ,含
,含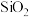 、
、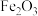 、MgO等杂质)中提取两种工艺品的流程如下:
、MgO等杂质)中提取两种工艺品的流程如下:
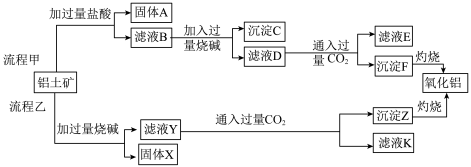
请回答下列问题:
(1)流程甲加入盐酸后生成Al3+的方程式为_________ .
(2)流程乙加入烧碱后生成SiO32-的离子方程式为________ .
(3)验证滤液B含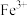 ,可取少量滤液并加入
,可取少量滤液并加入________ (填试剂名称)。
(4)滤液E、K中溶质的主要成分是________ (填化学式),写出该溶液的一种用途________
(5)已知298K时, 的容度积常数
的容度积常数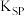 =5.6×
=5.6×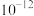 ,取适量的滤液B,加入一定量的烧碱达到沉淀溶液平衡,测得pH=13.00,则此温度下残留在溶液中的
,取适量的滤液B,加入一定量的烧碱达到沉淀溶液平衡,测得pH=13.00,则此温度下残留在溶液中的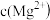 =
=_______ .
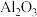 ,含
,含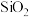 、
、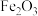 、MgO等杂质)中提取两种工艺品的流程如下:
、MgO等杂质)中提取两种工艺品的流程如下:
请回答下列问题:
(1)流程甲加入盐酸后生成Al3+的方程式为
(2)流程乙加入烧碱后生成SiO32-的离子方程式为
(3)验证滤液B含
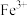 ,可取少量滤液并加入
,可取少量滤液并加入(4)滤液E、K中溶质的主要成分是
(5)已知298K时,
 的容度积常数
的容度积常数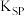 =5.6×
=5.6×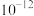 ,取适量的滤液B,加入一定量的烧碱达到沉淀溶液平衡,测得pH=13.00,则此温度下残留在溶液中的
,取适量的滤液B,加入一定量的烧碱达到沉淀溶液平衡,测得pH=13.00,则此温度下残留在溶液中的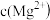 =
=
您最近一年使用:0次
2016-12-09更新
|
235次组卷
|
10卷引用:广东省惠州市惠东中学2019届高三上学期第一次月考化学试题
广东省惠州市惠东中学2019届高三上学期第一次月考化学试题2009年普通高等学校招生统一考试理综试题化学部分(福建卷)2009高考真题汇编-无机综合题(已下线)2014年高考化学苏教版总复习 3-1 从铝土矿到铝合金练习卷(已下线)2015届江西省南昌市八一中学高三8月月考化学试卷2015届山东省邹城市第一中学高三4月高考模拟理综化学试卷2020年安徽省全省教学质量检测统一考试(练习检测一)2020届高中化学第一轮复习第十三章《化学与技术》测试卷贵州省锦屏中学2019-2020学年高二上学期期末考试化学试题甘肃省会宁县第一中学2021届高三上学期第三次月考化学试题



