解题方法
1 . W、X、Y、Z、Q为原子序数依次增大的短周期主族元素,W与Y形成生活中常见的液态化合物,Y的原子序数等于W与X的原子序数之和,Z原子最外层电子数为Y原子最外层电子数的一半,Q的原子半径是第三周期中最小的。下列说法不正确 的是
| A.Y元素与Z元素组成的化合物是两性氧化物 |
| B.由W、X、Y三种元素所组成的化合物可能是酸也可能是碱 |
| C.由Z和Q形成的化合物在熔融状态下能导电 |
| D.简单氢化物的沸点:X<Y |
您最近一年使用:0次
解题方法
2 . 明矾[KAl(SO4)2∙12H2O]在造纸、净水等方面应用广泛,实验室以铝灰为原料制备明矾的流程如下图所示,

已知:①铝灰含Al、Al2O3和少量FeO、Fe2O3、SiO2;
②SiO2不溶于强酸;
③不同温度KAl(SO4)2∙12H2O的溶解度:
回答下列问题:
(1)“酸浸”后溶液中主要的金属离子有Fe3+、___________ 。“滤渣Ⅰ”的主要成分为___________ (填化学式)。
(2)①“氧化”过程中H2O2的作用是___________ (用离子方程式表示)。
②Fe2+的“氧化效率”与温度的关系如图所示,试解释温度过高,“氧化效率”降低的可能原因是___________ 。

(3)溶液的pH对铝、铁沉淀率的影响如图所示。“调pH”时应控制溶液的pH范围为___________ 。
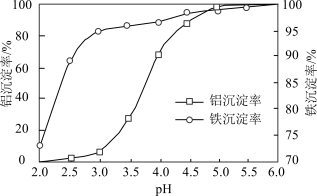
A.3.0~3.5 B.4.0~4.5 C.4.5~5.0
(4)“沉铝”中发生的离子方程式为___________ 。
(5)得到明矾晶体的“系列操作”包括___________ 、___________ 、过滤、洗涤、干燥。

已知:①铝灰含Al、Al2O3和少量FeO、Fe2O3、SiO2;
②SiO2不溶于强酸;
③不同温度KAl(SO4)2∙12H2O的溶解度:
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 60 | 80 | 90 |
| KAl(SO4)2∙12H2O/g | 3.00 | 3.99 | 5.90 | 8.39 | 11.7 | 24.8 | 71.0 | 109 |
(1)“酸浸”后溶液中主要的金属离子有Fe3+、
(2)①“氧化”过程中H2O2的作用是
②Fe2+的“氧化效率”与温度的关系如图所示,试解释温度过高,“氧化效率”降低的可能原因是

(3)溶液的pH对铝、铁沉淀率的影响如图所示。“调pH”时应控制溶液的pH范围为

A.3.0~3.5 B.4.0~4.5 C.4.5~5.0
(4)“沉铝”中发生的离子方程式为
(5)得到明矾晶体的“系列操作”包括
您最近一年使用:0次
名校
3 . 工业上以铝土矿(主要成分为 ,含少量
,含少量 、
、 、
、 等杂质)为主要原料制备氯化铝,流程如下。
等杂质)为主要原料制备氯化铝,流程如下。

(1)酸浸
①用 溶液浸取铝土矿中的铝元素和铁元素,写出加入
溶液浸取铝土矿中的铝元素和铁元素,写出加入 溶液后产生有色离子的离子方程式
溶液后产生有色离子的离子方程式___________ ;___________ 。
②浸渣的主要成分为___________ (填化学式)。
(2)氧化:用 将
将 氧化为
氧化为 ,反应的离子方程式为
,反应的离子方程式为___________ 。判断 已完全被氧化为
已完全被氧化为 的实验操作是
的实验操作是___________ 。
(3)沉淀:用 溶液调节
溶液调节 ,将
,将 、
、 转化为沉淀,溶液终点
转化为沉淀,溶液终点 对铝、铁沉淀率的影响如图所示。
对铝、铁沉淀率的影响如图所示。

为获得较高的铝、铁沉淀率,应控制溶液 最佳为
最佳为___________ (填字母)。
A.4.0左右 B.5.0左右 C.6.0左右
(4)碱溶:用 溶液溶解沉淀,写出发生反应的离子方程式
溶液溶解沉淀,写出发生反应的离子方程式___________ ,分离出 的实验操作为
的实验操作为___________ (填名称)。
(5)碳分:向碱溶后的溶液中通入足量 气体,该反应的离子方程式为
气体,该反应的离子方程式为___________ 。
 ,含少量
,含少量 、
、 、
、 等杂质)为主要原料制备氯化铝,流程如下。
等杂质)为主要原料制备氯化铝,流程如下。
(1)酸浸
①用
 溶液浸取铝土矿中的铝元素和铁元素,写出加入
溶液浸取铝土矿中的铝元素和铁元素,写出加入 溶液后产生有色离子的离子方程式
溶液后产生有色离子的离子方程式②浸渣的主要成分为
(2)氧化:用
 将
将 氧化为
氧化为 ,反应的离子方程式为
,反应的离子方程式为 已完全被氧化为
已完全被氧化为 的实验操作是
的实验操作是(3)沉淀:用
 溶液调节
溶液调节 ,将
,将 、
、 转化为沉淀,溶液终点
转化为沉淀,溶液终点 对铝、铁沉淀率的影响如图所示。
对铝、铁沉淀率的影响如图所示。
为获得较高的铝、铁沉淀率,应控制溶液
 最佳为
最佳为A.4.0左右 B.5.0左右 C.6.0左右
(4)碱溶:用
 溶液溶解沉淀,写出发生反应的离子方程式
溶液溶解沉淀,写出发生反应的离子方程式 的实验操作为
的实验操作为(5)碳分:向碱溶后的溶液中通入足量
 气体,该反应的离子方程式为
气体,该反应的离子方程式为
您最近一年使用:0次
4 . 利用硫铁矿烧渣(主要成分为Fe3O4、FeO、SiO2等)和粉煤灰(主要成分为Al2O3、Fe2O3、FeO等),制备高效水处理剂聚合硫酸铁铝的流程如下:

已知:SiO2既不溶于H2SO4溶液,也不和H2SO4溶液反应。
(1)“酸溶Ⅰ”得到的溶液中所含的金属阳离子主要有_____ 。
(2)“氧化”时,若用氯水代替H2O2:
①发生反应的离子方程式为_____ 。
②与使用氯水相比,“氧化”时使用H2O2的优点是_____ 。
(3)①“碱溶”时,Al2O3发生反应的化学方程式为_____ 。
②通入CO2后生成沉淀的化学式为_____ 。
(4)在流程中可以循环利用的是_____ (填“滤渣Ⅰ”、“滤渣Ⅱ”或“滤渣Ⅰ和滤渣Ⅱ”)。
(5)向Fe3O4、FeO的固体混合物中,加入足量H2SO4溶液,充分反应后,向溶液中再加入足量铜粉,充分搅拌反应,得到的溶液中离子浓度比为c(Cu2+):c(Fe2+)=2:7,则固体混合物中物质的量比n(Fe3O4):n(FeO)为_____ 。

已知:SiO2既不溶于H2SO4溶液,也不和H2SO4溶液反应。
(1)“酸溶Ⅰ”得到的溶液中所含的金属阳离子主要有
(2)“氧化”时,若用氯水代替H2O2:
①发生反应的离子方程式为
②与使用氯水相比,“氧化”时使用H2O2的优点是
(3)①“碱溶”时,Al2O3发生反应的化学方程式为
②通入CO2后生成沉淀的化学式为
(4)在流程中可以循环利用的是
(5)向Fe3O4、FeO的固体混合物中,加入足量H2SO4溶液,充分反应后,向溶液中再加入足量铜粉,充分搅拌反应,得到的溶液中离子浓度比为c(Cu2+):c(Fe2+)=2:7,则固体混合物中物质的量比n(Fe3O4):n(FeO)为
您最近一年使用:0次
5 . 化学与科学、技术、社会、环境(STSE)密切联系。下列说法错误的是
| A.铝制餐具不宜用来蒸煮或长时间存放酸性或碱性食物 |
| B.榨苹果汁时加入维生素C,可减缓其在空气中发生颜色变化 |
| C.2023年跨年夜部分地方燃放的烟花应用了某些金属的焰色反应 |
| D.红酒中添加了SO2利用其氧化性进行杀菌消毒 |
您最近一年使用:0次
6 . 下列属于两性氧化物的是
| A.H2O | B.SO2 | C.FeO | D.Al2O3 |
您最近一年使用:0次
解题方法
7 . 锂在新能源等领域应用广泛。从粉煤灰(含Al2O3、Fe2O3、Li2O、SiO2等)中回收提取铝、锂元素的化合物的流程如图所示:

已知:碳酸锂的溶解度(g·L-1)见表。
回答下列问题
(1)“粉碎”的目的是___________ ,滤渣1的成分主要是___________ 。(填化学式)
(2)“调pH”的目的是沉淀Fe3+、Al3+。当离子浓度≤1.0×10-5mol·L-1时表示该离子沉淀完全。常温下,如果溶液pH=4,Fe3+、Al3+___________ (填“能”或“否”)均沉淀完全,此时溶液中c(Fe3+)、c(Al3+)之比为___________ 。(已知:Ksp[Fe(OH)3]=8.0×10-38,Ksp[Al(OH)3]=2.0×10-33)
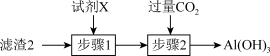
(3)从滤渣2中分离出Al(OH)3,可用如图所示方法,试剂X是___________ ,“步骤2”中主要发生的离子反应方程式有OH-+CO2=HCO 、
、___________ 。
(4)“沉锂”中的“一系列操作”依次为蒸发浓缩、___________ 、洗涤、干燥。检验母液主要溶质的阴离子所用的试剂为___________ 。母液的用途___________ (任写一种)。
(5)太阳能路灯蓄电池是磷酸铁锂电池,其工作原理如图所示。电池总反应式为LixC6 + Li1−xFePO4 LiFePO4 + 6C。试写出充电时,该电池正极材料上的反应式:
LiFePO4 + 6C。试写出充电时,该电池正极材料上的反应式:___________ 。


已知:碳酸锂的溶解度(g·L-1)见表。
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 80 | 100 |
| Li2CO3 | 1.54 | 1.43 | 1.33 | 1.25 | 1.17 | 1.08 | 1.01 | 0.85 | 0.72 |
(1)“粉碎”的目的是
(2)“调pH”的目的是沉淀Fe3+、Al3+。当离子浓度≤1.0×10-5mol·L-1时表示该离子沉淀完全。常温下,如果溶液pH=4,Fe3+、Al3+
(3)从滤渣2中分离出Al(OH)3,可用如图所示方法,试剂X是
 、
、
(4)“沉锂”中的“一系列操作”依次为蒸发浓缩、
(5)太阳能路灯蓄电池是磷酸铁锂电池,其工作原理如图所示。电池总反应式为LixC6 + Li1−xFePO4
 LiFePO4 + 6C。试写出充电时,该电池正极材料上的反应式:
LiFePO4 + 6C。试写出充电时,该电池正极材料上的反应式:
您最近一年使用:0次
8 . 下列有关铝及其化合物的性质说法,正确的是
| A.Al2O3熔点高,可用作耐高温材料 |
| B.氧化铝不能与NaOH溶液反应 |
| C.铝在空气中不易被氧化,是因为其性质不活泼 |
| D.氧化铝是碱性氧化物 |
您最近一年使用:0次
9 . 下列物质中,既能跟盐酸反应又能跟NaOH溶液反应的是
A. | B.MgO | C. | D. |
您最近一年使用:0次
2021-11-22更新
|
529次组卷
|
6卷引用:广东省惠州市惠阳区中山中学2021-2022学年高一上学期期末质量检测化学试题
名校
10 . 某化学兴趣小组模拟工业上从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3等杂质)中提取氧化铝的工艺做实验,流程如图,请回答下列问题:

(1)操作I的名称为___ 。
(2)验证溶液B中是否含有Fe3+的方法:___ 。
(3)步骤①中,加入足量盐酸,所得不溶物A是___ (填化学式)。
(4)步骤②中,加入过量NaOH溶液,其中发生反应的离子方程式有___ 、___ 。
(5)步骤③中得到的不溶物E的化学式为___ 。
(6)如果铝土矿100g,步骤④中的灼烧后得不溶物G质量为51g,则矿石中铝元素的含量为___ 。

(1)操作I的名称为
(2)验证溶液B中是否含有Fe3+的方法:
(3)步骤①中,加入足量盐酸,所得不溶物A是
(4)步骤②中,加入过量NaOH溶液,其中发生反应的离子方程式有
(5)步骤③中得到的不溶物E的化学式为
(6)如果铝土矿100g,步骤④中的灼烧后得不溶物G质量为51g,则矿石中铝元素的含量为
您最近一年使用:0次
2021-10-24更新
|
305次组卷
|
2卷引用:广东省惠州市2020-2021学年高一上学期期末质量检测化学试题



