解题方法
1 . W、X、Y、Z、Q为原子序数依次增大的短周期主族元素,W与Y形成生活中常见的液态化合物,Y的原子序数等于W与X的原子序数之和,Z原子最外层电子数为Y原子最外层电子数的一半,Q的原子半径是第三周期中最小的。下列说法不正确 的是
| A.Y元素与Z元素组成的化合物是两性氧化物 |
| B.由W、X、Y三种元素所组成的化合物可能是酸也可能是碱 |
| C.由Z和Q形成的化合物在熔融状态下能导电 |
| D.简单氢化物的沸点:X<Y |
您最近一年使用:0次
名校
2 . 工业上以铝土矿(主要成分为 ,含少量
,含少量 、
、 、
、 等杂质)为主要原料制备氯化铝,流程如下。
等杂质)为主要原料制备氯化铝,流程如下。

(1)酸浸
①用 溶液浸取铝土矿中的铝元素和铁元素,写出加入
溶液浸取铝土矿中的铝元素和铁元素,写出加入 溶液后产生有色离子的离子方程式
溶液后产生有色离子的离子方程式___________ ;___________ 。
②浸渣的主要成分为___________ (填化学式)。
(2)氧化:用 将
将 氧化为
氧化为 ,反应的离子方程式为
,反应的离子方程式为___________ 。判断 已完全被氧化为
已完全被氧化为 的实验操作是
的实验操作是___________ 。
(3)沉淀:用 溶液调节
溶液调节 ,将
,将 、
、 转化为沉淀,溶液终点
转化为沉淀,溶液终点 对铝、铁沉淀率的影响如图所示。
对铝、铁沉淀率的影响如图所示。

为获得较高的铝、铁沉淀率,应控制溶液 最佳为
最佳为___________ (填字母)。
A.4.0左右 B.5.0左右 C.6.0左右
(4)碱溶:用 溶液溶解沉淀,写出发生反应的离子方程式
溶液溶解沉淀,写出发生反应的离子方程式___________ ,分离出 的实验操作为
的实验操作为___________ (填名称)。
(5)碳分:向碱溶后的溶液中通入足量 气体,该反应的离子方程式为
气体,该反应的离子方程式为___________ 。
 ,含少量
,含少量 、
、 、
、 等杂质)为主要原料制备氯化铝,流程如下。
等杂质)为主要原料制备氯化铝,流程如下。
(1)酸浸
①用
 溶液浸取铝土矿中的铝元素和铁元素,写出加入
溶液浸取铝土矿中的铝元素和铁元素,写出加入 溶液后产生有色离子的离子方程式
溶液后产生有色离子的离子方程式②浸渣的主要成分为
(2)氧化:用
 将
将 氧化为
氧化为 ,反应的离子方程式为
,反应的离子方程式为 已完全被氧化为
已完全被氧化为 的实验操作是
的实验操作是(3)沉淀:用
 溶液调节
溶液调节 ,将
,将 、
、 转化为沉淀,溶液终点
转化为沉淀,溶液终点 对铝、铁沉淀率的影响如图所示。
对铝、铁沉淀率的影响如图所示。
为获得较高的铝、铁沉淀率,应控制溶液
 最佳为
最佳为A.4.0左右 B.5.0左右 C.6.0左右
(4)碱溶:用
 溶液溶解沉淀,写出发生反应的离子方程式
溶液溶解沉淀,写出发生反应的离子方程式 的实验操作为
的实验操作为(5)碳分:向碱溶后的溶液中通入足量
 气体,该反应的离子方程式为
气体,该反应的离子方程式为
您最近一年使用:0次
3 . 化学与科学、技术、社会、环境(STSE)密切联系。下列说法错误的是
| A.铝制餐具不宜用来蒸煮或长时间存放酸性或碱性食物 |
| B.榨苹果汁时加入维生素C,可减缓其在空气中发生颜色变化 |
| C.2023年跨年夜部分地方燃放的烟花应用了某些金属的焰色反应 |
| D.红酒中添加了SO2利用其氧化性进行杀菌消毒 |
您最近一年使用:0次
解题方法
4 . 石墨在材料领域有重要应用。某初级石墨中含SiO2(7.8%)、Al2O3(5.1%)、Fe2O3(3.1%)和MgO(0.5%)等杂质。设计的提纯和综合应用工艺如下:
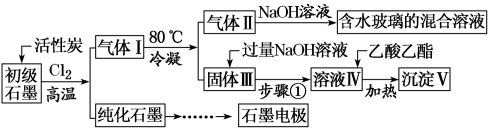
(注:SiCl4的沸点是57.6ºC,金属氯化物的沸点均高于150ºC)
(1)向反应器中通入Cl2前,需通一段时间的N2,主要目的是_______ 。
(2)高温反应后,石墨中的氧化物杂质均转变为相应的氯化物。气体I中的氯化物主要为_______ 。由气体II中某物质得到水玻璃的化学方程式为_______ 。
(3)步骤①为:搅拌、_______ 。
(4)由溶液IV生成沉淀V的总反应的离子方程式为_______ 。100 kg初级石墨最多可获得V的质量为_______ kg。

(注:SiCl4的沸点是57.6ºC,金属氯化物的沸点均高于150ºC)
(1)向反应器中通入Cl2前,需通一段时间的N2,主要目的是
(2)高温反应后,石墨中的氧化物杂质均转变为相应的氯化物。气体I中的氯化物主要为
(3)步骤①为:搅拌、
(4)由溶液IV生成沉淀V的总反应的离子方程式为
您最近一年使用:0次
名校
5 . 铝(熔点660℃)是一种应用广泛的金属,工业上用A12O3(熔点2045℃)和冰晶石(Na2AlF6,六氟合铝酸钠)混合熔融后电解制得。回答下列问题:
(1)铝属于活泼金属却能在空气中稳定存在,原因是(用化学用语及相关文字说明)____________ .
(2)将0.1 mol/L AlCl3溶液和10%NH4F溶液混合制取Na2AlF6。该实验所用试管及盛装NaF 溶液的试剂瓶均为塑料材质,原因是____________ 。
(3)下列关于氧化铝的叙述正确的是
A.氧化铝可以治疗胃酸过多。
B.氧化铝因为熔点高,可以作耐火材料.
C.氧化铝是铝热剂的成分之一。
D.氧化铝是两性氧化物,所以既能浴于盐酸又能溶于氨水。
(4)某工厂排放出有毒物质NOCl , 它遇水就会生成NO3―。NOCl分子中各原子均满足8电子稳定结构,则NOCl的电子式为____________ 。水源中的NO3―对人类健康会产生危害。为了降低水源中NO3―的浓度,有研究人员建议在碱性条件下用铝粉将NO3―还原为N2,该反应的离子方程式为____________ ,此方法的缺点是处理后的水中生成了AlO2―,仍然可能对人类健康产生危害,还需要对该饮用水进行一系列后续处理。已知25℃时,Ksp[Al(OH)3] = l.3×l0-33 Al(OH)3 AlO2-+H++H2O K=1.0×10-13,25℃时,若欲使上述处理后的水中AlO2―浓度降到1.0×10-6mol/L,则应调节至pH=
AlO2-+H++H2O K=1.0×10-13,25℃时,若欲使上述处理后的水中AlO2―浓度降到1.0×10-6mol/L,则应调节至pH= ____________ 。此时水中c(A13+)= ____________
(1)铝属于活泼金属却能在空气中稳定存在,原因是(用化学用语及相关文字说明)
(2)将0.1 mol/L AlCl3溶液和10%NH4F溶液混合制取Na2AlF6。该实验所用试管及盛装NaF 溶液的试剂瓶均为塑料材质,原因是
(3)下列关于氧化铝的叙述正确的是
A.氧化铝可以治疗胃酸过多。
B.氧化铝因为熔点高,可以作耐火材料.
C.氧化铝是铝热剂的成分之一。
D.氧化铝是两性氧化物,所以既能浴于盐酸又能溶于氨水。
(4)某工厂排放出有毒物质NOCl , 它遇水就会生成NO3―。NOCl分子中各原子均满足8电子稳定结构,则NOCl的电子式为
 AlO2-+H++H2O K=1.0×10-13,25℃时,若欲使上述处理后的水中AlO2―浓度降到1.0×10-6mol/L,则应调节至pH=
AlO2-+H++H2O K=1.0×10-13,25℃时,若欲使上述处理后的水中AlO2―浓度降到1.0×10-6mol/L,则应调节至pH=
您最近一年使用:0次
2017-06-03更新
|
422次组卷
|
3卷引用:广东省惠州市燕岭学校2019届高三10月月考化学试题
6 . 软锰矿的主要成分为MnO2,含少量Al2O3和SiO2。闪锌矿主要成分为ZnS,含少量FeS、CuS、CdS杂质。现以软锰矿和闪锌矿为原料制备MnO2和Zn,其简化流程如下(中间产物的固体部分已经略去)。
已知: Ⅰ.矿石中所有金属元素在滤液A中均以离子形式存在。
Ⅱ.各种金属离子完全沉淀的pH如下表:
回答下列问题:
(1)步骤①中为了加快硫酸的浸取速率,可采用的方法是_________________ (任写一种)。①中发生多个反应,其中MnO2、FeS与硫酸共热时有淡黄色物质析出,溶液变为棕黄色,写出MnO2、FeS与硫酸共热发生反应的化学方程式______________________ 。
(2)步骤②加入金属锌是为了回收金属,回收金属的主要成分是_________ 。
(3)步骤③中MnO2的其作用是__________________ ,另外一种物质X可以是__________ 。
A.ZnO B.MgCO3 C.MnCO3 D.Cu(OH)2
(4)MnO2与Li构成LiMnO2,它可作为某锂离子电池的正极材料,电池反应方程式为: Li1-xMnO2+LixC6=LiMnO2+6C,写出该锂离子电池的正极电极反应式__________ 。
(5)已知:HCN的电离常数K=4.9×10-10,H2S的电离常数K1=1.3×10―7,K2=7.0×10―15,向NaCN溶液中通入少量的H2S气体,反应的离子方程式为__________________ 。在废水处理领域中常用H2S将Mn2+转化为MnS除去,向含有0.020 mol·L―1Mn2+废水中通入一定量的H2S气体,调节溶液的pH=a,当HS―浓度为1.0×10―4 mol·L―1时,Mn2+开始沉淀,则a=______ 。[已知:Ksp(MnS)=1.4×10―15]

已知: Ⅰ.矿石中所有金属元素在滤液A中均以离子形式存在。
Ⅱ.各种金属离子完全沉淀的pH如下表:
| Zn2+ | Mn2+ | Fe2+ | Fe3+ | Al3+ | |
| pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
回答下列问题:
(1)步骤①中为了加快硫酸的浸取速率,可采用的方法是
(2)步骤②加入金属锌是为了回收金属,回收金属的主要成分是
(3)步骤③中MnO2的其作用是
A.ZnO B.MgCO3 C.MnCO3 D.Cu(OH)2
(4)MnO2与Li构成LiMnO2,它可作为某锂离子电池的正极材料,电池反应方程式为: Li1-xMnO2+LixC6=LiMnO2+6C,写出该锂离子电池的正极电极反应式
(5)已知:HCN的电离常数K=4.9×10-10,H2S的电离常数K1=1.3×10―7,K2=7.0×10―15,向NaCN溶液中通入少量的H2S气体,反应的离子方程式为
您最近一年使用:0次
2017-02-26更新
|
306次组卷
|
2卷引用:广东省惠阳高级中学2018届高三上学期12月月考理科综合化学试题
真题
名校
7 . 从铝土矿(主要成分是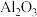 ,含
,含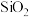 、
、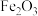 、MgO等杂质)中提取两种工艺品的流程如下:
、MgO等杂质)中提取两种工艺品的流程如下:
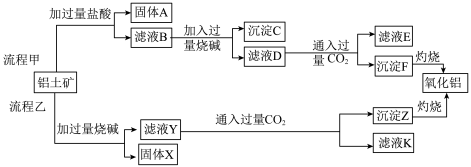
请回答下列问题:
(1)流程甲加入盐酸后生成Al3+的方程式为_________ .
(2)流程乙加入烧碱后生成SiO32-的离子方程式为________ .
(3)验证滤液B含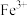 ,可取少量滤液并加入
,可取少量滤液并加入________ (填试剂名称)。
(4)滤液E、K中溶质的主要成分是________ (填化学式),写出该溶液的一种用途________
(5)已知298K时, 的容度积常数
的容度积常数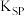 =5.6×
=5.6×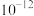 ,取适量的滤液B,加入一定量的烧碱达到沉淀溶液平衡,测得pH=13.00,则此温度下残留在溶液中的
,取适量的滤液B,加入一定量的烧碱达到沉淀溶液平衡,测得pH=13.00,则此温度下残留在溶液中的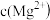 =
=_______ .
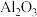 ,含
,含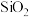 、
、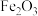 、MgO等杂质)中提取两种工艺品的流程如下:
、MgO等杂质)中提取两种工艺品的流程如下:
请回答下列问题:
(1)流程甲加入盐酸后生成Al3+的方程式为
(2)流程乙加入烧碱后生成SiO32-的离子方程式为
(3)验证滤液B含
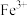 ,可取少量滤液并加入
,可取少量滤液并加入(4)滤液E、K中溶质的主要成分是
(5)已知298K时,
 的容度积常数
的容度积常数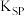 =5.6×
=5.6×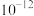 ,取适量的滤液B,加入一定量的烧碱达到沉淀溶液平衡,测得pH=13.00,则此温度下残留在溶液中的
,取适量的滤液B,加入一定量的烧碱达到沉淀溶液平衡,测得pH=13.00,则此温度下残留在溶液中的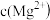 =
=
您最近一年使用:0次
2016-12-09更新
|
235次组卷
|
10卷引用:广东省惠州市惠东中学2019届高三上学期第一次月考化学试题
广东省惠州市惠东中学2019届高三上学期第一次月考化学试题(已下线)2015届江西省南昌市八一中学高三8月月考化学试卷2015届山东省邹城市第一中学高三4月高考模拟理综化学试卷甘肃省会宁县第一中学2021届高三上学期第三次月考化学试题2009年普通高等学校招生统一考试理综试题化学部分(福建卷)2009高考真题汇编-无机综合题(已下线)2014年高考化学苏教版总复习 3-1 从铝土矿到铝合金练习卷2020年安徽省全省教学质量检测统一考试(练习检测一)2020届高中化学第一轮复习第十三章《化学与技术》测试卷贵州省锦屏中学2019-2020学年高二上学期期末考试化学试题
8 . 下列各组混合物,使用氢氧化钠溶液和盐酸两种试剂不能分离的是
| A.氧化镁中混有氧化铝 | B.氯化铝溶液中混有氯化铁 |
| C.氧化铁中混有二氧化硅 | D.氯化亚铁溶液中混有氯化铜 |
您最近一年使用:0次
2016-06-13更新
|
1392次组卷
|
33卷引用:广东省惠州市惠东中学2019届高三上学期第一次月考化学试题
广东省惠州市惠东中学2019届高三上学期第一次月考化学试题2017届内蒙古临河区巴彦淖尔一中高三上9月月考化学卷河北省邢台市第一中学2016-2017学年高二下学期第三次月考化学试题黑龙江省哈尔滨市第六中学2016-2017学年高二6月月考化学试题河北省大名县第一中学2018届高三(普通班)上学期第一次月考化学试题吉林省白城市通榆一中2018届高三上学期12月考试理综化学试题福建省莆田第一中学2018届高三上学期第一学段化学试题福建省厦门市湖滨中学2019届高三上学期阶段测试(二)化学试题河南省南阳市第一中学2020届高三上学期第三次月考化学试题陕西省西安市高陵区第一中学、田家炳中学2020-2021学年高一上学期第一次月考化学试题浙江省诸暨中学2020-2021学年高一上学期10月阶段性考试化学(实验班)试题2016年全国普通高等学校招生统一考试化学(上海卷精编版)2015-2016学年黑龙江牡丹江一中高二下期末化学试卷辽宁省大连市2017届高三3月双基测试化学试题山东省烟台市2016-2017学年高一下学期期中考试化学试题辽宁省大连市2017-2018学年高一上学期期末考试化学试题吉林省安图县中学2017-2018学年高一上学期期末考试化学试题(已下线)解密05 金属及其化合物(教师版)——备战2018年高考化学之高频考点解密(已下线)2019高考备考一轮复习精品资料 第三章 金属及其化合物 第2讲 镁、铝及其重要化合物【押题专练】(已下线)2019高考备考一轮复习精品资料 第三章 金属及其化合物 第3讲 铁及其化合物【教学案】(已下线)2019高考备考一轮复习精品资料 第三章 金属及其化合物 第2讲 镁、铝及其重要化合物【教学案】【全国百强校】福建省三明市第一中学2019届高三上学期期中考试化学试题(已下线)2019高考热点题型和提分秘籍 第三章 金属及其化合物 第3讲 铁及其化合物 (教学案)(已下线)2019高考热点题型和提分秘籍 第三章 金属及其化合物 第2讲 铝及其化合物(已下线)解密17 物质的检验分离与提纯(教师版)——备战2018年高考化学之高频考点解密(已下线)2019高考备考二轮复习精品资料-专题5 金属及其化合物(教学案)【全国百强校】四川省棠湖中学2018-2019学年高一上学期期末考试化学试题2016年全国普通高等学校招生统一考试化学(上海卷参考版)云南省开远市实验中学2020届高三上学期开学考试化学试题云南省屏边县民中2020届高三上学期开学考试化学试题(已下线)【浙江新东方】61黑龙江省哈尔滨市第三中学2022届高三第一次验收考试化学试题江苏省天一中学2021-2022学年高一上学期期末考试化学(强化班)试题
11-12高一下·广东惠州·阶段练习
解题方法
9 . 下列物质能发生铝热反应的是:
| A.铝和氧化镁的混合物 | B.铝和二氧化锰的混合物 |
| C.氧化铝与镁的混合物 | D.氧化铜和铝的混合物 |
您最近一年使用:0次



