名校
解题方法
1 . 用软锰矿(主要成分 ,含有
,含有 、
、 、
、 、
、 等杂质)制备
等杂质)制备 的流程如下:
的流程如下:

已知:
回答下列问题:
(1)焙烧时, 和
和 在纤维素作用下分别转化为
在纤维素作用下分别转化为 、
、 ,则纤维素的作用是
,则纤维素的作用是_______ 。
(2)酸浸时,浸出液的 与锰的浸出率关系如下图所示:
与锰的浸出率关系如下图所示:

实际生产中,酸浸时控制硫酸的量不宜过多,使 在2左右。请结合上图和制备硫酸锰的流程,说明硫酸的量不宜过多的原因:
在2左右。请结合上图和制备硫酸锰的流程,说明硫酸的量不宜过多的原因:_______ 。
(3)净化时,加入30% 的目的是(用离子方程式表示)
的目的是(用离子方程式表示)_______ ;加氨水,调 为5.5的目的是
为5.5的目的是_______ 。
(4)结合 与
与 溶解度曲线,简述“结晶分离”的具体实验操作
溶解度曲线,简述“结晶分离”的具体实验操作_______ 。

(5)产品 纯度测定:称取a
纯度测定:称取a 产品,在适宜的条件下用适量
产品,在适宜的条件下用适量 将
将 氧化为
氧化为 ,再用
,再用
 溶液b
溶液b 刚好把
刚好把 转化为
转化为 。通过计算可知,产品纯度为
。通过计算可知,产品纯度为_______ (用质量分数表示)。
 ,含有
,含有 、
、 、
、 、
、 等杂质)制备
等杂质)制备 的流程如下:
的流程如下:
已知:
| 氢氧化物 |  |  |  |  |  |
| 开始沉淀时的pH | 2.3 | 4.0 | 7.5 | 8.8 | 10.4 |
| 沉淀完全时的pH | 4.1 | 5.2 | 9.7 | 10.4 | 12.4 |
(1)焙烧时,
 和
和 在纤维素作用下分别转化为
在纤维素作用下分别转化为 、
、 ,则纤维素的作用是
,则纤维素的作用是(2)酸浸时,浸出液的
 与锰的浸出率关系如下图所示:
与锰的浸出率关系如下图所示:
实际生产中,酸浸时控制硫酸的量不宜过多,使
 在2左右。请结合上图和制备硫酸锰的流程,说明硫酸的量不宜过多的原因:
在2左右。请结合上图和制备硫酸锰的流程,说明硫酸的量不宜过多的原因:(3)净化时,加入30%
 的目的是(用离子方程式表示)
的目的是(用离子方程式表示) 为5.5的目的是
为5.5的目的是(4)结合
 与
与 溶解度曲线,简述“结晶分离”的具体实验操作
溶解度曲线,简述“结晶分离”的具体实验操作
(5)产品
 纯度测定:称取a
纯度测定:称取a 产品,在适宜的条件下用适量
产品,在适宜的条件下用适量 将
将 氧化为
氧化为 ,再用
,再用
 溶液b
溶液b 刚好把
刚好把 转化为
转化为 。通过计算可知,产品纯度为
。通过计算可知,产品纯度为
您最近一年使用:0次
2021-01-27更新
|
1359次组卷
|
5卷引用:广东省惠州市2022届高三第一次调研考试化学试题
广东省惠州市2022届高三第一次调研考试化学试题2020年北京高考化学真题变式题11-19北京市顺义区2021届高三一模化学试题(已下线)大题01 化学工艺流程题(一)-【考前抓大题】备战2021年高考化学(全国通用)广东省广州市第十六中学2021届高三下学期5月考试化学试题
解题方法
2 . 石墨在材料领域有重要应用。某初级石墨中含SiO2(7.8%)、Al2O3(5.1%)、Fe2O3(3.1%)和MgO(0.5%)等杂质。设计的提纯和综合应用工艺如下:
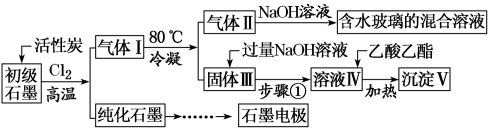
(注:SiCl4的沸点是57.6ºC,金属氯化物的沸点均高于150ºC)
(1)向反应器中通入Cl2前,需通一段时间的N2,主要目的是_______ 。
(2)高温反应后,石墨中的氧化物杂质均转变为相应的氯化物。气体I中的氯化物主要为_______ 。由气体II中某物质得到水玻璃的化学方程式为_______ 。
(3)步骤①为:搅拌、_______ 。
(4)由溶液IV生成沉淀V的总反应的离子方程式为_______ 。100 kg初级石墨最多可获得V的质量为_______ kg。

(注:SiCl4的沸点是57.6ºC,金属氯化物的沸点均高于150ºC)
(1)向反应器中通入Cl2前,需通一段时间的N2,主要目的是
(2)高温反应后,石墨中的氧化物杂质均转变为相应的氯化物。气体I中的氯化物主要为
(3)步骤①为:搅拌、
(4)由溶液IV生成沉淀V的总反应的离子方程式为
您最近一年使用:0次
名校
3 . 下列物质中属于两性氧化物的是( )
| A.CO2 | B.Na2O2 | C.Na2O | D.Al2O3 |
您最近一年使用:0次
2020-04-27更新
|
619次组卷
|
6卷引用:海南省海口市海南中学2019-2020学年高一上学期期末考试化学试题
4 . 下列物质中,既能与盐酸反应又能与氢氧化钠溶液反应的氧化物是( )
| A.Al | B.Al2O3 | C.NaHCO3 | D.Al(OH)3 |
您最近一年使用:0次
2019-03-30更新
|
190次组卷
|
3卷引用:广东惠州市2019-2020学年度高一下学期期末质量检测化学试题
5 . 铝硅合金材料性能优良。铝土矿(含30% SiO2、40.8% Al2O3和少量Fe2O3等)干法制取该合金的工艺如下:

(1)若湿法处理铝土矿,用强酸浸取时,所得溶液中的金属阳离子有_______ 。
(2)焙烧除铁反应:4(NH4)2SO4 + Fe2O3 2NH4Fe(SO4)2 + 3H2O + 6NH3↑(Al2O3部分发生类似反应)。氧化物转化为硫酸盐的百分率与温度的关系如图,最适宜焙烧温度为
2NH4Fe(SO4)2 + 3H2O + 6NH3↑(Al2O3部分发生类似反应)。氧化物转化为硫酸盐的百分率与温度的关系如图,最适宜焙烧温度为______ 。指出气体Ⅰ的用途__________________ (任写一种)。

(3)操作①包括:加水溶解、_______ 。若所得溶液中加入过量NaOH溶液,含铝微粒发生反应的离子方程式为____________________ 。
(4)用焦炭还原SiO2、Al2O3会产生中间体SiC、Al4C3,任写一个高温下中间体又与Al2O3反应生成铝、硅单质的化学方程式______________ 。

(1)若湿法处理铝土矿,用强酸浸取时,所得溶液中的金属阳离子有
(2)焙烧除铁反应:4(NH4)2SO4 + Fe2O3
 2NH4Fe(SO4)2 + 3H2O + 6NH3↑(Al2O3部分发生类似反应)。氧化物转化为硫酸盐的百分率与温度的关系如图,最适宜焙烧温度为
2NH4Fe(SO4)2 + 3H2O + 6NH3↑(Al2O3部分发生类似反应)。氧化物转化为硫酸盐的百分率与温度的关系如图,最适宜焙烧温度为
(3)操作①包括:加水溶解、
(4)用焦炭还原SiO2、Al2O3会产生中间体SiC、Al4C3,任写一个高温下中间体又与Al2O3反应生成铝、硅单质的化学方程式
您最近一年使用:0次
名校
6 . 铝(熔点660℃)是一种应用广泛的金属,工业上用A12O3(熔点2045℃)和冰晶石(Na2AlF6,六氟合铝酸钠)混合熔融后电解制得。回答下列问题:
(1)铝属于活泼金属却能在空气中稳定存在,原因是(用化学用语及相关文字说明)____________ .
(2)将0.1 mol/L AlCl3溶液和10%NH4F溶液混合制取Na2AlF6。该实验所用试管及盛装NaF 溶液的试剂瓶均为塑料材质,原因是____________ 。
(3)下列关于氧化铝的叙述正确的是
A.氧化铝可以治疗胃酸过多。
B.氧化铝因为熔点高,可以作耐火材料.
C.氧化铝是铝热剂的成分之一。
D.氧化铝是两性氧化物,所以既能浴于盐酸又能溶于氨水。
(4)某工厂排放出有毒物质NOCl , 它遇水就会生成NO3―。NOCl分子中各原子均满足8电子稳定结构,则NOCl的电子式为____________ 。水源中的NO3―对人类健康会产生危害。为了降低水源中NO3―的浓度,有研究人员建议在碱性条件下用铝粉将NO3―还原为N2,该反应的离子方程式为____________ ,此方法的缺点是处理后的水中生成了AlO2―,仍然可能对人类健康产生危害,还需要对该饮用水进行一系列后续处理。已知25℃时,Ksp[Al(OH)3] = l.3×l0-33 Al(OH)3 AlO2-+H++H2O K=1.0×10-13,25℃时,若欲使上述处理后的水中AlO2―浓度降到1.0×10-6mol/L,则应调节至pH=
AlO2-+H++H2O K=1.0×10-13,25℃时,若欲使上述处理后的水中AlO2―浓度降到1.0×10-6mol/L,则应调节至pH= ____________ 。此时水中c(A13+)= ____________
(1)铝属于活泼金属却能在空气中稳定存在,原因是(用化学用语及相关文字说明)
(2)将0.1 mol/L AlCl3溶液和10%NH4F溶液混合制取Na2AlF6。该实验所用试管及盛装NaF 溶液的试剂瓶均为塑料材质,原因是
(3)下列关于氧化铝的叙述正确的是
A.氧化铝可以治疗胃酸过多。
B.氧化铝因为熔点高,可以作耐火材料.
C.氧化铝是铝热剂的成分之一。
D.氧化铝是两性氧化物,所以既能浴于盐酸又能溶于氨水。
(4)某工厂排放出有毒物质NOCl , 它遇水就会生成NO3―。NOCl分子中各原子均满足8电子稳定结构,则NOCl的电子式为
 AlO2-+H++H2O K=1.0×10-13,25℃时,若欲使上述处理后的水中AlO2―浓度降到1.0×10-6mol/L,则应调节至pH=
AlO2-+H++H2O K=1.0×10-13,25℃时,若欲使上述处理后的水中AlO2―浓度降到1.0×10-6mol/L,则应调节至pH=
您最近一年使用:0次
2017-06-03更新
|
422次组卷
|
3卷引用:广东省惠州市燕岭学校2019届高三10月月考化学试题
7 . 软锰矿的主要成分为MnO2,含少量Al2O3和SiO2。闪锌矿主要成分为ZnS,含少量FeS、CuS、CdS杂质。现以软锰矿和闪锌矿为原料制备MnO2和Zn,其简化流程如下(中间产物的固体部分已经略去)。
已知: Ⅰ.矿石中所有金属元素在滤液A中均以离子形式存在。
Ⅱ.各种金属离子完全沉淀的pH如下表:
回答下列问题:
(1)步骤①中为了加快硫酸的浸取速率,可采用的方法是_________________ (任写一种)。①中发生多个反应,其中MnO2、FeS与硫酸共热时有淡黄色物质析出,溶液变为棕黄色,写出MnO2、FeS与硫酸共热发生反应的化学方程式______________________ 。
(2)步骤②加入金属锌是为了回收金属,回收金属的主要成分是_________ 。
(3)步骤③中MnO2的其作用是__________________ ,另外一种物质X可以是__________ 。
A.ZnO B.MgCO3 C.MnCO3 D.Cu(OH)2
(4)MnO2与Li构成LiMnO2,它可作为某锂离子电池的正极材料,电池反应方程式为: Li1-xMnO2+LixC6=LiMnO2+6C,写出该锂离子电池的正极电极反应式__________ 。
(5)已知:HCN的电离常数K=4.9×10-10,H2S的电离常数K1=1.3×10―7,K2=7.0×10―15,向NaCN溶液中通入少量的H2S气体,反应的离子方程式为__________________ 。在废水处理领域中常用H2S将Mn2+转化为MnS除去,向含有0.020 mol·L―1Mn2+废水中通入一定量的H2S气体,调节溶液的pH=a,当HS―浓度为1.0×10―4 mol·L―1时,Mn2+开始沉淀,则a=______ 。[已知:Ksp(MnS)=1.4×10―15]

已知: Ⅰ.矿石中所有金属元素在滤液A中均以离子形式存在。
Ⅱ.各种金属离子完全沉淀的pH如下表:
| Zn2+ | Mn2+ | Fe2+ | Fe3+ | Al3+ | |
| pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
回答下列问题:
(1)步骤①中为了加快硫酸的浸取速率,可采用的方法是
(2)步骤②加入金属锌是为了回收金属,回收金属的主要成分是
(3)步骤③中MnO2的其作用是
A.ZnO B.MgCO3 C.MnCO3 D.Cu(OH)2
(4)MnO2与Li构成LiMnO2,它可作为某锂离子电池的正极材料,电池反应方程式为: Li1-xMnO2+LixC6=LiMnO2+6C,写出该锂离子电池的正极电极反应式
(5)已知:HCN的电离常数K=4.9×10-10,H2S的电离常数K1=1.3×10―7,K2=7.0×10―15,向NaCN溶液中通入少量的H2S气体,反应的离子方程式为
您最近一年使用:0次
2017-02-26更新
|
306次组卷
|
2卷引用:广东省惠阳高级中学2018届高三上学期12月月考理科综合化学试题
8 . 铝制品不宜长期盛放酸性食品和碱性食品是因为铝制品表层物质属于
| A.金属铝 | B.碱性氧化物 | C.酸性氧化物 | D.两性氧化物 |
您最近一年使用:0次
2016-12-09更新
|
173次组卷
|
5卷引用:2015-2016学年广东省惠州市高二上学期期末文化学试卷
名校
9 . 除去Fe2O3中少量的Al2O3,可选用的试剂是
| A.HCl | B.HNO3 | C.氨水 | D.NaOH溶液 |
您最近一年使用:0次
2016-12-09更新
|
265次组卷
|
2卷引用:2014-2015学年广东省惠州市高一下学期期末考试化学文科试卷
名校
10 . 下列物质中,既能与NaOH溶液又能与盐酸反应的单质是
| A.Al2O3 | B.Al | C.Al(OH)3 | D.NaHCO3 |
您最近一年使用:0次
2016-12-09更新
|
181次组卷
|
2卷引用:2014-2015学年广东省惠州市高一下学期期末考试化学文科试卷



