解题方法
1 . 无水 可用作有机合成的催化剂、食品膨松剂等。工业上可由铝土矿(主要成分是
可用作有机合成的催化剂、食品膨松剂等。工业上可由铝土矿(主要成分是 和
和 等)和焦炭制备,流程如下:
等)和焦炭制备,流程如下: 、
、 分别在178℃,316℃时升华。
分别在178℃,316℃时升华。
(1)氯化炉中 、
、 和焦炭在高温下发生反应的化学方程式为
和焦炭在高温下发生反应的化学方程式为___________ ;炉气中残余的少量 可用NaOH溶液吸收,其离子方程式为
可用NaOH溶液吸收,其离子方程式为___________ 。
(2)700℃时,升华器中物质经充分反应后需降温实现 和
和 的分离。请选择合适的温度范围:(填字母)
的分离。请选择合适的温度范围:(填字母)___________ 。
A.低于178℃ B.介于178℃和316℃之间 C.高于316℃
(3)升华器中发生反应的基本反应类型是___________ 。
(4)为测定制得的无水 产品(含杂质
产品(含杂质 )的纯度,称取16.25g无水
)的纯度,称取16.25g无水 样品,溶于过量的NaOH溶液中,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,得其质量为0.16g。
样品,溶于过量的NaOH溶液中,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,得其质量为0.16g。
①上述除杂过程中涉及的离子方程式为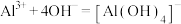 、
、___________ 。
②无水 产品的纯度为
产品的纯度为___________ 。
 可用作有机合成的催化剂、食品膨松剂等。工业上可由铝土矿(主要成分是
可用作有机合成的催化剂、食品膨松剂等。工业上可由铝土矿(主要成分是 和
和 等)和焦炭制备,流程如下:
等)和焦炭制备,流程如下: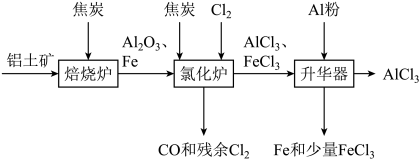
 、
、 分别在178℃,316℃时升华。
分别在178℃,316℃时升华。(1)氯化炉中
 、
、 和焦炭在高温下发生反应的化学方程式为
和焦炭在高温下发生反应的化学方程式为 可用NaOH溶液吸收,其离子方程式为
可用NaOH溶液吸收,其离子方程式为(2)700℃时,升华器中物质经充分反应后需降温实现
 和
和 的分离。请选择合适的温度范围:(填字母)
的分离。请选择合适的温度范围:(填字母)A.低于178℃ B.介于178℃和316℃之间 C.高于316℃
(3)升华器中发生反应的基本反应类型是
(4)为测定制得的无水
 产品(含杂质
产品(含杂质 )的纯度,称取16.25g无水
)的纯度,称取16.25g无水 样品,溶于过量的NaOH溶液中,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,得其质量为0.16g。
样品,溶于过量的NaOH溶液中,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,得其质量为0.16g。①上述除杂过程中涉及的离子方程式为
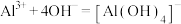 、
、②无水
 产品的纯度为
产品的纯度为
您最近一年使用:0次
名校
2 . 实验室变色硅胶是在硅酸凝胶中添加了CoCl2。一种从水钴矿(主要成分:Co2O3,少量的Fe2O3、CaO、MgO、Al2O3、MnO))制取CoCl2·6H2O工艺流程如下:
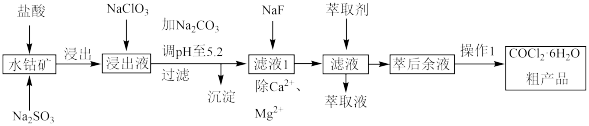
已知:阳离子的氢氧化物沉淀时溶液的pH如下表:
(1)水钴矿在浸取前需要粉碎,目的是___________ 。
(2)Na2SO3在浸取过程中作___________ 剂,写出浸取时Na2SO3与Fe2O3反应的离子方程式___________ 。
(3)写出NaClO3加入浸取后溶液的离子方程式___________ 。
(4)加入碳酸钠调节pH为5.2步骤获得沉淀的成分为___________ 。
(5)“萃取”时发生反应:Co2++n(HA)2⇌CoA2·(n-1)(HA)2+2H+,通过调节pH,设计萃取、反萃取。简述该步骤的原理和目的___________ 。
(6)CoCl2为蓝色,CoC2·6H2O为粉红色。实验室变色硅胶是在硅酸凝胶中添加CoCl2用于指示吸湿程度。请说明CoCl2用于指示吸湿程度的原理___________ 。

已知:阳离子的氢氧化物沉淀时溶液的pH如下表:
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Co(OH)2 | Fe(OH)2 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 4.0 | 7.6 | 7.6 | 7.7 |
| 完全沉淀 | 3.7 | 5.2 | 9.2 | 9.6 | 9.8 |
(2)Na2SO3在浸取过程中作
(3)写出NaClO3加入浸取后溶液的离子方程式
(4)加入碳酸钠调节pH为5.2步骤获得沉淀的成分为
(5)“萃取”时发生反应:Co2++n(HA)2⇌CoA2·(n-1)(HA)2+2H+,通过调节pH,设计萃取、反萃取。简述该步骤的原理和目的
(6)CoCl2为蓝色,CoC2·6H2O为粉红色。实验室变色硅胶是在硅酸凝胶中添加CoCl2用于指示吸湿程度。请说明CoCl2用于指示吸湿程度的原理
您最近一年使用:0次
2023-07-12更新
|
74次组卷
|
2卷引用:甘肃省兰州市等5地2022-2023学年高二下学期期末化学试题
名校
3 . 镍电池的电极活性材料为多组分合金(主要成分为镍、钴,还含有铝、铁等),可重新回收利用。利用废镍电池资源化生产醋酸钴晶体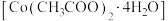 的工艺流程如下。
的工艺流程如下。
②部分金属阳离子沉淀的pH如下表。
请回答下列问题:
(1)“浸取”时可以提高浸取率的操作有___________ (任写1条)。
(2)“调pH”时溶液的pH范围是___________ ,所得滤渣1的主要成分为___________ (填化学式)。
(3)“氧化分离”操作控制溶液pH=2,加入NaClO发生反应的离子方程式为___________ 。
(4)“溶解1”操作中加入H2O2的作用为___________ ,“沉钴”操作过程中发生反应的离子方程式为___________ 。
(5)“溶解2”操作后得到醋酸钴晶体,要使该醋酸钴晶体的纯度更高,所采取的实验操作名称应为___________ 。
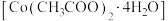 的工艺流程如下。
的工艺流程如下。
②部分金属阳离子沉淀的pH如下表。
| 沉淀物 |  |  | 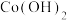 | Co(OH)3 |  |  |
| 开始沉淀pH | 2.2 | 7.4 | 7.6 | 0.1 | 4.0 | 7.6 |
| 完全沉淀pH | 3.2 | 8.9 | 9.2 | 1.1 | 5.2 | 9.2 |
(1)“浸取”时可以提高浸取率的操作有
(2)“调pH”时溶液的pH范围是
(3)“氧化分离”操作控制溶液pH=2,加入NaClO发生反应的离子方程式为
(4)“溶解1”操作中加入H2O2的作用为
(5)“溶解2”操作后得到醋酸钴晶体,要使该醋酸钴晶体的纯度更高,所采取的实验操作名称应为
您最近一年使用:0次
名校
解题方法
4 . 某工厂的废金属屑中主要成分为 、
、 和
和 ,此外还含有少量
,此外还含有少量 和
和 ,为探索工业废料的再利用,某化学兴趣小组设计了如图
,为探索工业废料的再利用,某化学兴趣小组设计了如图 所示实验流程,用该工厂的合金废料制取氯化铝、绿矾晶体
所示实验流程,用该工厂的合金废料制取氯化铝、绿矾晶体 和胆矾晶体。
和胆矾晶体。
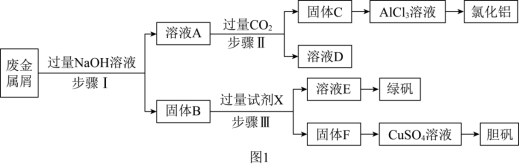
请回答下列问题:
(1)试剂X是_______ 。
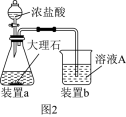
(2)在步骤Ⅱ过程,生成固体C发生的化学反应方程式为_______ ,若用如图 装置制取
装置制取 并通入溶液
并通入溶液 中,一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为避免沉淀减少,可采取的改进措施是
中,一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为避免沉淀减少,可采取的改进措施是_______ 。
(3)检验溶液 中的金属阳离子时,滴加
中的金属阳离子时,滴加_______ ,溶液无明显现象,说明溶液中不存在Fe3+,用离子方程式解释其可能的原因_______ 。
(4)由绿矾晶体(FeSO4•7H2O)固体配制240mL 0.10mol•L-1FeSO4溶液,需要用到的仪器有药匙、玻璃棒、量筒、烧杯、托盘天平、胶头滴管、_______ 。以下操作会导致所配溶液浓度偏低的是_______ 。
A.容量瓶中原有少量蒸馏水
B.洗涤烧杯和玻璃棒的溶液未转入容量瓶中
C.定容时俯视刻度线
D.定容摇匀后发现溶液体积低于刻度线,再补加少量蒸馏水至刻度线
 、
、 和
和 ,此外还含有少量
,此外还含有少量 和
和 ,为探索工业废料的再利用,某化学兴趣小组设计了如图
,为探索工业废料的再利用,某化学兴趣小组设计了如图 所示实验流程,用该工厂的合金废料制取氯化铝、绿矾晶体
所示实验流程,用该工厂的合金废料制取氯化铝、绿矾晶体 和胆矾晶体。
和胆矾晶体。
请回答下列问题:
(1)试剂X是
(2)在步骤Ⅱ过程,生成固体C发生的化学反应方程式为
 装置制取
装置制取 并通入溶液
并通入溶液 中,一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为避免沉淀减少,可采取的改进措施是
中,一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为避免沉淀减少,可采取的改进措施是
(3)检验溶液
 中的金属阳离子时,滴加
中的金属阳离子时,滴加(4)由绿矾晶体(FeSO4•7H2O)固体配制240mL 0.10mol•L-1FeSO4溶液,需要用到的仪器有药匙、玻璃棒、量筒、烧杯、托盘天平、胶头滴管、
A.容量瓶中原有少量蒸馏水
B.洗涤烧杯和玻璃棒的溶液未转入容量瓶中
C.定容时俯视刻度线
D.定容摇匀后发现溶液体积低于刻度线,再补加少量蒸馏水至刻度线
您最近一年使用:0次
2023-03-18更新
|
238次组卷
|
2卷引用:甘肃省天水市第一中学2022-2023学年高一上学期期末考试化学试题
名校
解题方法
5 . 以某冶金工业产生的废渣(含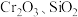 及少量的
及少量的 )为原料,且废渣中各物质在煅烧时均与
)为原料,且废渣中各物质在煅烧时均与 反应,根据下列流程可制备
反应,根据下列流程可制备 ,下列说法错误的是
,下列说法错误的是

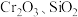 及少量的
及少量的 )为原料,且废渣中各物质在煅烧时均与
)为原料,且废渣中各物质在煅烧时均与 反应,根据下列流程可制备
反应,根据下列流程可制备 ,下列说法错误的是
,下列说法错误的是
A.可循环使用的物质是 和 和 |
B.由 转化为 转化为 的过程中,可先加入硫酸,再加 的过程中,可先加入硫酸,再加 溶液,利用物质溶解度差异,制出 溶液,利用物质溶解度差异,制出 固体 固体 |
C.煅烧时产生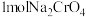 ,转移 ,转移 |
D.滤渣II中主要成分是 和 和 |
您最近一年使用:0次
名校
6 . 磁选后的炼铁高钛炉渣,主要成分有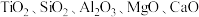 以及少量的
以及少量的 。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。
。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。

已知:①硫酸钙微溶于水,在“水浸”时部分溶到滤液中;
②该工艺条件下,有关金属离子开始沉淀和沉淀完全的 见下表。
见下表。
回答下列问题:
(1)“焙烧”时,尾气中含有氨和水蒸气,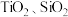 几乎不发生反应,
几乎不发生反应,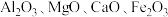 转化为相应的硫酸盐,写出
转化为相应的硫酸盐,写出 转化为
转化为 的化学方程式:
的化学方程式:_______ 。
(2)“水浸”后“滤液”的 的为2.0,滤液中主要含有的金属阳离子
的为2.0,滤液中主要含有的金属阳离子 在“分步沉淀”时用氨水逐步调节
在“分步沉淀”时用氨水逐步调节 至11.6。
至11.6。
①依次析出的金属离子是 、
、_______ 、_______ 。
②“母液①”中 浓度为
浓度为_______  。
。
(3)“水浸渣”在 “酸溶”时最适合的酸是硫酸,“酸溶渣”的成分除
“酸溶”时最适合的酸是硫酸,“酸溶渣”的成分除 外,还有
外,还有_______ 。
(4)“酸溶”后,将溶液适当稀释并加热, 水解析出
水解析出 沉淀,该反应的离子方程式是
沉淀,该反应的离子方程式是_______ 。
(5)将“母液①”和“母液②”混合,用于吸收尾气,再经处理得_______ (填化学式),可循环利用。
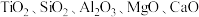 以及少量的
以及少量的 。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。
。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。
已知:①硫酸钙微溶于水,在“水浸”时部分溶到滤液中;
②该工艺条件下,有关金属离子开始沉淀和沉淀完全的
 见下表。
见下表。| 金属离子 |  |  |  |  |
开始沉淀的 | 2.2 | 3.5 | 9.5 | 12.4 |
沉淀完全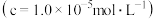 的 的 | 3.2 | 4.7 | 11.1 | 13.8 |
(1)“焙烧”时,尾气中含有氨和水蒸气,
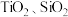 几乎不发生反应,
几乎不发生反应,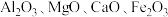 转化为相应的硫酸盐,写出
转化为相应的硫酸盐,写出 转化为
转化为 的化学方程式:
的化学方程式:(2)“水浸”后“滤液”的
 的为2.0,滤液中主要含有的金属阳离子
的为2.0,滤液中主要含有的金属阳离子 在“分步沉淀”时用氨水逐步调节
在“分步沉淀”时用氨水逐步调节 至11.6。
至11.6。①依次析出的金属离子是
 、
、②“母液①”中
 浓度为
浓度为 。
。(3)“水浸渣”在
 “酸溶”时最适合的酸是硫酸,“酸溶渣”的成分除
“酸溶”时最适合的酸是硫酸,“酸溶渣”的成分除 外,还有
外,还有(4)“酸溶”后,将溶液适当稀释并加热,
 水解析出
水解析出 沉淀,该反应的离子方程式是
沉淀,该反应的离子方程式是(5)将“母液①”和“母液②”混合,用于吸收尾气,再经处理得
您最近一年使用:0次
名校
7 . 铝土矿的主要成分是Al2O3,还有部分SiO2、Fe2O3以及少量不溶于酸碱溶液的其他杂质。工业上从铝土矿中提取铝可采取如下工艺:

下列说法正确的是

下列说法正确的是
| A.沉淀Ⅰ只有SiO2 |
| B.①~⑤中包含两个氧化还原反应 |
| C.步骤②发生的反应为Al3++3OH-=Al(OH)3↓ |
| D.溶液Ⅲ中溶质主要为NaHCO3 |
您最近一年使用:0次
2023-01-21更新
|
710次组卷
|
4卷引用:甘肃省张掖市高台县第一中学2022-2023学年高一下学期6月月考化学试题
名校
解题方法
8 . 电解铝技术的出现与成熟让铝从皇家珍品变成汽车、轮船、航天航空制造、化工生产等行业的重要材料。工业上用铝土矿(主要成分为Al2O3,Fe2O3、SiO2等(二氧化硅是酸性氧化物))提取纯Al2O3做冶炼铝的原料,某研究性学习小组设计了如下提取流程图

(1)固体Ⅰ、Ⅱ的化学式分别为____________ 、________________ ;
(2)操作Ⅰ所需玻璃仪器有____________________ ;
(3)写出流程③主要离子方程式______________________ ;
(4)验证滤液Ⅰ中是否含Fe3+,可取少量滤液A并加入_______ (填试剂名称),现象是_______ ;
(5)从铝土矿中提取铝的过程不涉及的化学反应类型是__________;
(6)生产过程中除CaO、CO2可以循环使用外,还可以循环使用的物质有________ ;(填化学式)
(7)若向滤液I中逐滴滴入NaOH溶液至过量,产生沉淀随NaOH滴入关系正确的是_______

(1)固体Ⅰ、Ⅱ的化学式分别为
(2)操作Ⅰ所需玻璃仪器有
(3)写出流程③主要离子方程式
(4)验证滤液Ⅰ中是否含Fe3+,可取少量滤液A并加入
(5)从铝土矿中提取铝的过程不涉及的化学反应类型是__________;
| A.复分解反应 | B.氧化还原反应 | C.置换反应 | D.分解反应 |
(7)若向滤液I中逐滴滴入NaOH溶液至过量,产生沉淀随NaOH滴入关系正确的是_______
A. | B.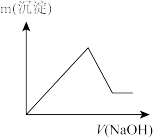 |
C. | D. |
您最近一年使用:0次
2022-12-16更新
|
260次组卷
|
3卷引用:甘肃省兰州第一中学2022-2023学年高一上学期期末考试化学试题
名校
解题方法
9 . 用霞石岩(主要成分为 、
、 、
、 、
、 )制碳酸钠、碳酸钾和氧化铝的工艺流程如下。已知:
)制碳酸钠、碳酸钾和氧化铝的工艺流程如下。已知: 溶液的pH为8~9,
溶液的pH为8~9, 溶液的pH为11~12。
溶液的pH为11~12。

溶解过滤工序产生的滤液中含Na、K和Al的可溶性盐类,含Ca和Si的杂质在滤渣霞石泥中。部分物质的溶解度如图所示,根据题意回答下列问题:

(1)霞石岩的主要成分是_______ ,X物质是_______ 。
(2)实验室进行煅烧操作时盛放固体物质的实验仪器是_______ ,滤液W中主要含有的离子有_______ (写三种即可)。
(3)碳酸化I中发生的主要反应的离子方程式是_______ 。
(4)操作II是_______ (填字母)。
a.趁热过滤 b.冷却过滤 c.蒸馏 d.灼烧
(5)碳酸化II调整 的目的是
的目的是_______ ,产品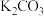 中最可能含有的杂质是
中最可能含有的杂质是_______ (写化学式)。
 、
、 、
、 、
、 )制碳酸钠、碳酸钾和氧化铝的工艺流程如下。已知:
)制碳酸钠、碳酸钾和氧化铝的工艺流程如下。已知: 溶液的pH为8~9,
溶液的pH为8~9, 溶液的pH为11~12。
溶液的pH为11~12。
溶解过滤工序产生的滤液中含Na、K和Al的可溶性盐类,含Ca和Si的杂质在滤渣霞石泥中。部分物质的溶解度如图所示,根据题意回答下列问题:

(1)霞石岩的主要成分是
(2)实验室进行煅烧操作时盛放固体物质的实验仪器是
(3)碳酸化I中发生的主要反应的离子方程式是
(4)操作II是
a.趁热过滤 b.冷却过滤 c.蒸馏 d.灼烧
(5)碳酸化II调整
 的目的是
的目的是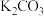 中最可能含有的杂质是
中最可能含有的杂质是
您最近一年使用:0次
名校
解题方法
10 . 工业上常以高硫铝土矿(主要成分为 、
、 ,还含有少量
,还含有少量 等)为原料,生产
等)为原料,生产 和铝单质的工艺流程如图:
和铝单质的工艺流程如图:

已知:高硫铝土矿粉中含有的 在“焙烧Ⅰ”过程中,发生的反应为
在“焙烧Ⅰ”过程中,发生的反应为 ;“焙烧Ⅱ”在隔绝空气的条件下进行。
;“焙烧Ⅱ”在隔绝空气的条件下进行。
(1) 中硫的化合价为
中硫的化合价为_______ 价;“焙烧Ⅰ”时,加入少量 的主要作用为
的主要作用为_______ 。
(2)矿粉经过“焙烧Ⅰ”后,所得的大块烧渣需要进行“碱浸”,为了加快浸取的速率,可采取的措施为_______ 、_______ 。(任写两点)
(3)当反应 中生成标准状况下4.48L
中生成标准状况下4.48L 时,转移了
时,转移了_______ mol电子。
(4)“焙烧Ⅱ”过程中产生的污染性气体是_______ (填化学式),大量排放该气体造成的主要环境问题是_______ 。
(5)“焙烧Ⅲ”发生反应的化学方程式为_______ 。
(6)工业上,以物质X为原料冶炼金属Al的方法为_______ ,发生反应的化学方程式为_______ 。
 、
、 ,还含有少量
,还含有少量 等)为原料,生产
等)为原料,生产 和铝单质的工艺流程如图:
和铝单质的工艺流程如图:
已知:高硫铝土矿粉中含有的
 在“焙烧Ⅰ”过程中,发生的反应为
在“焙烧Ⅰ”过程中,发生的反应为 ;“焙烧Ⅱ”在隔绝空气的条件下进行。
;“焙烧Ⅱ”在隔绝空气的条件下进行。(1)
 中硫的化合价为
中硫的化合价为 的主要作用为
的主要作用为(2)矿粉经过“焙烧Ⅰ”后,所得的大块烧渣需要进行“碱浸”,为了加快浸取的速率,可采取的措施为
(3)当反应
 中生成标准状况下4.48L
中生成标准状况下4.48L 时,转移了
时,转移了(4)“焙烧Ⅱ”过程中产生的污染性气体是
(5)“焙烧Ⅲ”发生反应的化学方程式为
(6)工业上,以物质X为原料冶炼金属Al的方法为
您最近一年使用:0次
2022-07-10更新
|
280次组卷
|
3卷引用:甘肃省白银市2012-2022学年高一下学期期末考试化学试题



