名校
解题方法
1 . 以高铝铁矿石(主要成分为 、
、 ,还含有CuO和
,还含有CuO和 等杂质)为原料制备
等杂质)为原料制备 的一种流程如下:
的一种流程如下:
 、
、 ,还含有CuO和
,还含有CuO和 等杂质)为原料制备
等杂质)为原料制备 的一种流程如下:
的一种流程如下:
| A.“碱溶”中NaOH溶液可以用氨水替代 |
B.固体Y为 |
C.滤液与生石灰的主要反应为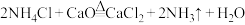 |
D.检验 是否洗净的最佳试剂是NaOH溶液和蓝色石蕊试纸 是否洗净的最佳试剂是NaOH溶液和蓝色石蕊试纸 |
您最近一年使用:0次
2023-10-08更新
|
353次组卷
|
5卷引用:陕西省榆林市靖边县靖边中学、绥德中学、府谷中学联考2023-2024学年高三上学期10月月考化学试题
名校
解题方法
2 . Cr(OH)3可用于油漆颜料及羊毛处理。工业上以高铁铬铁矿(主要成分为Cr2O3,含Fe2O3、SiO2、Al2O3等杂质)为原料生产Cr(OH)3和金属A1的工艺流程如图。回答下列问题:
已知:①焙烧时A12O3转化为可溶性的钠盐;
②“加入Na2S”析铬时,硫离子转化为 。
。
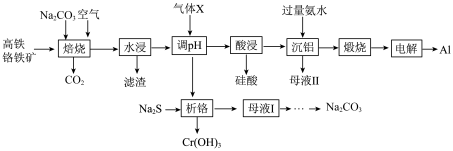
(1)为提高焙烧效率,可以采取的措施为________ (填一种方法即可);“焙烧时,Cr2O3转化为Na2CrO4,请写出该转化过程的化学方程式________ 。
(2)“水浸”后滤渣主要成分为________ (填化学式,下同)。
(3)“调pH”时通入的“气体X”是________ 。
(4)用稀硫酸进行“酸浸”后,再进行“沉铝”操作,所得的母液Ⅱ的主要成分为_______ 。
(5)过滤得到母液I经_______ 、________ 、过滤、洗涤、干燥得到碳酸钠晶体,失去结晶水得到碳酸钠固体。
(6)加入“Na2S”析铬, 被还原的离子方程式为
被还原的离子方程式为________ 。
已知:①焙烧时A12O3转化为可溶性的钠盐;
②“加入Na2S”析铬时,硫离子转化为
 。
。
(1)为提高焙烧效率,可以采取的措施为
(2)“水浸”后滤渣主要成分为
(3)“调pH”时通入的“气体X”是
(4)用稀硫酸进行“酸浸”后,再进行“沉铝”操作,所得的母液Ⅱ的主要成分为
(5)过滤得到母液I经
(6)加入“Na2S”析铬,
 被还原的离子方程式为
被还原的离子方程式为
您最近一年使用:0次
名校
解题方法
3 . 从铝土矿(主要成分为 )中提取铝的工艺流程如图。下列说法错误的是
)中提取铝的工艺流程如图。下列说法错误的是

 )中提取铝的工艺流程如图。下列说法错误的是
)中提取铝的工艺流程如图。下列说法错误的是
| A.对于一些非常活泼的金属,工业上常用电解法冶炼 |
B.“熔融电解”时发生反应的化学方程式为 |
| C.地壳中的铝元素含量丰富,大部分以游离态的形式存在 |
| D.铝合金表面覆盖着致密的氧化铝薄膜导致其具有较强的耐腐蚀性能 |
您最近一年使用:0次
2023-07-06更新
|
185次组卷
|
3卷引用:陕西省商洛市2022-2023学年高一下学期7月期末考试化学试题
名校
4 . 冰晶石(Na3AlF6)微溶于水,工业上用萤石(CaF2含量为96%)、二氧化硅为原料,采用氟硅酸钠法制备冰晶石,其工艺流程如图:

据此分析,下列观点不正确的是

据此分析,下列观点不正确的是
| A.滤渣A主要成分为CaSO4 ,可能含有SiO2 |
| B.“操作i”可用硅酸盐质设备进行分离 |
| C.上述流程中,所涉及的反应均为非氧化还原反应 |
| D.流程中可循环使用的物质除H2SO4、SiO2外,滤液B经浓缩后也能循环使用 |
您最近一年使用:0次
名校
解题方法
5 . 工业上用铝土矿(主要成分为 ,含有Fe2O3、
,含有Fe2O3、 等杂质)制取无水氯化铝的一种工艺流程如下:
等杂质)制取无水氯化铝的一种工艺流程如下:

已知:①
 ;
;
② 、
、 、
、 、
、 的沸点分别为57.6℃、1023℃、300℃(升华)、180℃(升华)。下列说法不正确的是
的沸点分别为57.6℃、1023℃、300℃(升华)、180℃(升华)。下列说法不正确的是
 ,含有Fe2O3、
,含有Fe2O3、 等杂质)制取无水氯化铝的一种工艺流程如下:
等杂质)制取无水氯化铝的一种工艺流程如下:
已知:①

 ;
;②
 、
、 、
、 、
、 的沸点分别为57.6℃、1023℃、300℃(升华)、180℃(升华)。下列说法不正确的是
的沸点分别为57.6℃、1023℃、300℃(升华)、180℃(升华)。下列说法不正确的是A.步骤II发生的反应中包含SiO2+2C Si+2CO Si+2CO |
| B.步骤II 中原料气为Cl2和O2 |
| C.步骤Ⅲ的尾气经足量NaOH溶液吸收,生成物中钠盐有2种 |
| D.步骤V中加入铝粉的目的是除去FeCl3,提高AlCl3纯度 |
您最近一年使用:0次
名校
6 . 工业上用铝土矿(主要成分为 ,含
,含 杂质)为原料冶炼铝的工艺流程如图所示;
杂质)为原料冶炼铝的工艺流程如图所示;

下列叙述正确的是
 ,含
,含 杂质)为原料冶炼铝的工艺流程如图所示;
杂质)为原料冶炼铝的工艺流程如图所示;
下列叙述正确的是
A.反应①过滤后所得沉淀为 |
| B.试剂X可以是NaOH溶液,也可以是盐酸 |
| C.图中所有转化反应都不是氧化还原反应 |
D.反应②的化学方程式为 |
您最近一年使用:0次
名校
7 . 工业上以铝土矿(主要成分为Al2O3,含少量Fe2O3、FeO、SiO2等杂质)为主要原料制备氧化铝,流程如下。
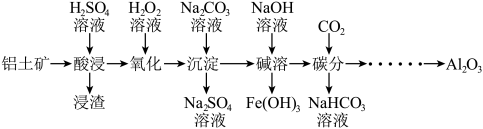
(1)酸浸:
①用H2SO4溶液浸取铝土矿中的铝元素和铁元素,H2SO4溶液的用量不宜过量太多,其原因是___________ 。
②浸渣的主要成分为___________ (填化学式)。
(2)氧化:
①用 溶液将
溶液将 氧化为
氧化为 ,反应的离子方程式为
,反应的离子方程式为___________ 。
② 实际用量比理论上多的原因是
实际用量比理论上多的原因是___________ (用化学方程式解释)。
(3)沉淀:用Na2CO3溶液调节pH,将Al3+、Fe3+转化为沉淀。溶液终点pH对铝、铁沉淀率的影响如图所示。

①为获得较高的铝、铁沉淀率,应控制溶液pH最佳为___________ (填字母)。
A. 4.0左右 B. 5.0左右 C. 6.0左右
②检验Fe3+沉淀完全的实验方法为___________ 。
(4)碱溶:用NaOH溶液溶解沉淀,分离出Fe(OH)3的实验操作为___________ (填名称)。
(5)碳分:向“碱溶”后的溶液中通入足量 气体,生成Al(OH)3沉淀和NaHCO3,该反应的离子方程式为
气体,生成Al(OH)3沉淀和NaHCO3,该反应的离子方程式为___________ 。

(1)酸浸:
①用H2SO4溶液浸取铝土矿中的铝元素和铁元素,H2SO4溶液的用量不宜过量太多,其原因是
②浸渣的主要成分为
(2)氧化:
①用
 溶液将
溶液将 氧化为
氧化为 ,反应的离子方程式为
,反应的离子方程式为②
 实际用量比理论上多的原因是
实际用量比理论上多的原因是(3)沉淀:用Na2CO3溶液调节pH,将Al3+、Fe3+转化为沉淀。溶液终点pH对铝、铁沉淀率的影响如图所示。

①为获得较高的铝、铁沉淀率,应控制溶液pH最佳为
A. 4.0左右 B. 5.0左右 C. 6.0左右
②检验Fe3+沉淀完全的实验方法为
(4)碱溶:用NaOH溶液溶解沉淀,分离出Fe(OH)3的实验操作为
(5)碳分:向“碱溶”后的溶液中通入足量
 气体,生成Al(OH)3沉淀和NaHCO3,该反应的离子方程式为
气体,生成Al(OH)3沉淀和NaHCO3,该反应的离子方程式为
您最近一年使用:0次
2023-05-05更新
|
636次组卷
|
3卷引用:陕西省西安市长安区第一中学2022-2023学年高一下学期期中考试(选择性考试)化学试题
名校
8 . 废旧金属的综合利用有利于节约资源、保护环境。现有废弃物(含 、FeO、CuO),实验室要回收三种金属,工艺流程如图所示:
、FeO、CuO),实验室要回收三种金属,工艺流程如图所示:

已知: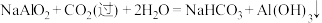
回答下列问题:
(1)“碱溶”时发生反应的离子方程式为_______ 。
(2)“操作1”用到的玻璃仪器有_______ 、玻璃棒。
(3)“沉铝”时加入适量盐酸,该步骤为避免因盐酸控制不当(过量)而导致 溶解,实际操作中可用过量
溶解,实际操作中可用过量_______ (填化学式)气体代替。
(4)“沉铁”时通入空气的目的是_____ ;证明“沉铁”的溶液中没有 的操作为
的操作为_______ 。
(5)“灼烧”时可在_______ (填仪器名称)中进行,写出该反应的化学方程式:_______ 。
 、FeO、CuO),实验室要回收三种金属,工艺流程如图所示:
、FeO、CuO),实验室要回收三种金属,工艺流程如图所示:
已知:
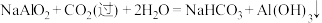
回答下列问题:
(1)“碱溶”时发生反应的离子方程式为
(2)“操作1”用到的玻璃仪器有
(3)“沉铝”时加入适量盐酸,该步骤为避免因盐酸控制不当(过量)而导致
 溶解,实际操作中可用过量
溶解,实际操作中可用过量(4)“沉铁”时通入空气的目的是
 的操作为
的操作为(5)“灼烧”时可在
您最近一年使用:0次
2023-03-06更新
|
230次组卷
|
2卷引用:陕西省西安市周至县第四中学2022-2023学年高一下学期期末考试化学试题
9 . 某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为 、
、 、
、 ,不考虑其他杂质)制备七水合硫酸亚铁
,不考虑其他杂质)制备七水合硫酸亚铁 ,设计了如下流程。下列说法错误的是
,设计了如下流程。下列说法错误的是
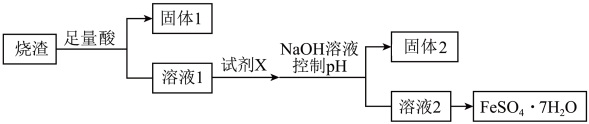
已知: 是酸性氧化物,与酸不反应。
是酸性氧化物,与酸不反应。
 、
、 、
、 ,不考虑其他杂质)制备七水合硫酸亚铁
,不考虑其他杂质)制备七水合硫酸亚铁 ,设计了如下流程。下列说法错误的是
,设计了如下流程。下列说法错误的是
已知:
 是酸性氧化物,与酸不反应。
是酸性氧化物,与酸不反应。A.固体1中一定有 |
B.加入试剂X,可能发生的离子反应为: , ,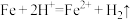 |
C.加入 溶液控制 溶液控制 是为了除去过量的酸 是为了除去过量的酸 |
D.从溶液2中得到 的操作为:蒸发浓缩、冷却结晶 的操作为:蒸发浓缩、冷却结晶 |
您最近一年使用:0次
2023-01-11更新
|
370次组卷
|
2卷引用:陕西省汉中市西乡县第一中学2023-2024学年高二上学期开学考试化学试题
名校
解题方法
10 . 铝土矿(主要成分为 ,还含有
,还含有 、
、 )是工业上制备氧化铝的主要原料。工业上提取氧化铝的工艺流程如图。
)是工业上制备氧化铝的主要原料。工业上提取氧化铝的工艺流程如图。

(1)沉淀A的化学式为_______ ,试剂b的化学式为_______ 。
(2)检验滤液甲中 时使用的试剂为
时使用的试剂为_______ 。
(3)步骤②中加入过量b时,生成沉淀B的离子反应方程式为_______ ;得到滤液乙的离子反应方程式为_______ 。
(4)步骤③中通入过量 气体而不加入过量盐酸的理由是
气体而不加入过量盐酸的理由是_______ 。
(5)准确称取8g铝土矿样品,加入一定量试剂a的溶液,使其中的 、
、 ,恰好溶解;然后向滤液中加入
,恰好溶解;然后向滤液中加入 的NaOH溶液,产生沉淀的质量与加入NaOH溶液的体积关系如图所示,则样品中
的NaOH溶液,产生沉淀的质量与加入NaOH溶液的体积关系如图所示,则样品中 的质量分数为
的质量分数为_______ 。

 ,还含有
,还含有 、
、 )是工业上制备氧化铝的主要原料。工业上提取氧化铝的工艺流程如图。
)是工业上制备氧化铝的主要原料。工业上提取氧化铝的工艺流程如图。
(1)沉淀A的化学式为
(2)检验滤液甲中
 时使用的试剂为
时使用的试剂为(3)步骤②中加入过量b时,生成沉淀B的离子反应方程式为
(4)步骤③中通入过量
 气体而不加入过量盐酸的理由是
气体而不加入过量盐酸的理由是(5)准确称取8g铝土矿样品,加入一定量试剂a的溶液,使其中的
 、
、 ,恰好溶解;然后向滤液中加入
,恰好溶解;然后向滤液中加入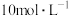 的NaOH溶液,产生沉淀的质量与加入NaOH溶液的体积关系如图所示,则样品中
的NaOH溶液,产生沉淀的质量与加入NaOH溶液的体积关系如图所示,则样品中 的质量分数为
的质量分数为
您最近一年使用:0次
2022-12-28更新
|
227次组卷
|
2卷引用:陕西省渭南市华阴市2021-2022学年高一上学期期末考试化学试题



